基于甲基化捕获联合转录组测序探讨栀子-川芎药对抗动脉粥样硬化的作用机制
2023-06-08贾子君周庆兵徐凤芹
贾子君,周庆兵,张 艳,徐凤芹
动脉粥样硬化(atherosclerosis,AS)是冠状动脉粥样硬化性心脏病、中风和外周动脉疾病的主要病理基础[1]。动脉粥样硬化严重威胁人民群众的身体健康,也给国家和社会带来了沉重的经济负担[2]。现有研究表明,动脉粥样硬化的病理机制主要包括炎症反应、血脂异常、平滑肌细胞异常增殖等[3]。近年来,随着多组学技术的不断发展,动脉粥样硬化基因甲基化的研究受到众多研究者的关注[4]。DNA甲基化是表观遗传学的重要组成部分,是指胞嘧啶添加甲基基团形成5-甲基胞嘧啶,这一过程需要DNA甲基转移酶的介导,并由S-腺苷甲硫氨酸提供甲基供体。DNA甲基化对基因的表达具有重要的调控作用,一般认为启动子区域高甲基化能抑制基因的下游表达,低甲基化能促进基因的表达[5]。现有研究表明,DNA异常甲基化在动脉粥样硬化的发生与发展中扮演重要角色,以动脉粥样硬化异常基因甲基化为靶点的药物开发研究有可能为动脉粥样硬化的治疗带来突破[6]。
传统中医中并没有动脉粥样硬化这一病名,参照动脉粥样硬化类疾病的常见临床症状表现,可将其归入到中医“脉痹”“胸痹”“中风”等疾病范畴中。近年来,陈可冀院士团队提出了以瘀毒病机为核心的动脉粥样硬化致病理论[7]。徐凤芹教授传承了陈可冀院士瘀毒理论思想,从古典名方越鞠丸中发掘出栀子、川芎两味中药,并在临床中广泛使用该药对治疗动脉粥样硬化类疾病,取得了较好的临床疗效。栀子性味苦寒,归心、肺、三焦经,有泻火除烦、清热凉血解毒之功[8]。川芎辛温无毒,活血行气、祛风止痛[9],《神农本草经》中记载川芎“上行头目,中开郁结,下行血海,旁通络脉,为血中之气药”。前期课题组研究表明,活血解毒药对栀子、川芎能够缩小兔动脉粥样硬化斑块厚度及面积,在DNA甲基化研究方面,高通量测序发现栀子、川芎药对能调节动脉粥样硬化兔异常的基因甲基化水平[10]。本研究则从DNA甲基化及下游基因的表达角度,运用多组学技术,进一步深入阐明栀子、川芎药对治疗动脉粥样硬化的现代生物学机制。
1 材料与方法
1.1 实验药物、试剂及仪器 栀子-川芎冻干粉由中国中医科学院西苑医院制剂室制备,栀子与川芎生药质量比为4∶5;人氧化型低密度脂蛋白(human oxidized-LDL,ox-LDL)购于广东奕源生物科技有限公司(货号:YB-002);Gbico DMEM高糖培养基(货号:C11995500BT);细胞毒性试验(CCK-8)细胞活力检测试剂盒购于日本同仁有限公司(货号:CK04-500);可溶性细胞间黏附分子-1(sICAM-1)酶联免疫吸附试验(ELISA)检测试剂盒(货号:EM013-96);小鼠肿瘤坏死因子α(TNF-α)ELISA检测试剂盒(货号:EM008-96);小鼠白细胞介素6(IL-6)ELISA检测试剂盒(货号:EM004-96);DNA提取试剂盒DNeasy Blood Tissue Kit(250)(Qiagen, Valencia,CA,USA,货号:166013782);动物总RNA抽提取试剂盒(磁珠法,货号:T02-096);酶联免疫检测仪(美国,BioTek公司);二氧化碳(CO2)培养箱(美国,Thermo公司);GCMS-TQ8040 NX mass spectrograph(SHIMADZU,Origin,Japan)。
1.2 细胞培养及泡沫细胞模型的建立 RAW 264.7细胞株购于北京协和细胞资源中心,培养基为含10%胎牛血清的DMEM高糖培养基,在37 ℃、5% CO2孵育箱中进行培养。按照前期课题组的方法建立泡沫细胞模型[11],以含有ox-LDL终浓度为80 mg/L的完全培养基培养48 h即可得到泡沫细胞。将细胞分为栀子-川芎冻干粉组(80 mg/L ox-LDL、0.3 g/L栀子-川芎冻干粉干预)、模型组(80 mg/L ox-LDL处理)和空白对照组(未处理)。
1.3 细胞毒性实验 将栀子-川芎冻干粉溶于完全培养基中,进行细胞增殖抑制实验,在细胞贴壁后加入含有栀子-川芎冻干粉不同浓度的完全培养基(药物浓度分别为4.800 g/L、2.400 g/L、1.200 g/L、0.600 g/L、0.300 g/L、0.150 g/L、0.075 g/L),培养48 h后加入CCK-8试剂,检测450 nm波长条件下的吸光度值,计算各组细胞存活率。
1.4 胆固醇和炎性因子检测 使用气相色谱-质谱法(GC-MS)测定不同细胞样本中总胆固醇(total cholesterol,TC)、游离胆固醇(free cholesterol,FC)水平。使用带有 RTX-5MS 色谱柱的 GCMS-TQ8040 NX 质谱仪检测样本。ELISA法检测不同样本细胞上清中TNF-α、IL-6及ICAM-1含量,根据试剂盒说明书步骤进行检测,由样本的OD值计算出对应样本中炎性因子浓度。
1.5 甲基化捕获测序(MC-seq) 细胞样本采用DNeasy Blood Tissue Kit(250)提取DNA,抽提所得DNA经Qubit 2.0 Fluorometer和琼脂糖凝胶电泳进行质检。对合格的DNA进行片段化及亚硫酸盐转化等处理,完成建库并使用Illumina NovaSeq6000测序仪测序。测序数据以GRCm38.p4(mm10)为参考基因组进行比对,计算差异甲基化CpG位点得到基因功能注释。组间对比采用Bioconductor package中的DSS(dispersion shrinkage for sequencing data)工具,进行差异甲基化位点(differential methylation site,DMS)的检测和注释,阈值设为:P<0.05,甲基化差异程度>10%。
1.6 RNA测序(RNA-seq) 提取细胞RNA,抽提所得RNA经Agilent 2100 Bioanalyzer(agilent technologies santa clara,US)电泳质检。对纯化后的总RNA进行分离、片段化、cDNA合成及富集等步骤,完成建库及质检后,使用Illumina NovaSeq6000测序仪进行测序,设定测序模式为PE150。对测序得到Raw Reads进行数据预处理,与基因组GRCm38.p4(mm10)进行比对,将reads转化成FPKM(fragments per kilobase of exon model per million mapped reads)并进行基因表达量的标准化,进行基因功能注释并计算出基因的表达量。应用edgeR进行样本间差异基因分析,得出P值后进行多重假设检验校正,通过控制伪发现率(false discovery rate,FDR)来决定P的阈值。同时,根据FPKM值计算差异表达倍数,即Fold-change。
1.7 京都基因与基因组百科全书(KEGG)富集分析与基因本体(GO)富集分析 将符合筛选条件的基因运用DAVID数据库(https://david.ncifcrf.gov/)进行KEGG富集分析及GO富集分析,并使用微生信在线绘图平台将结果进行可视化展示。

2 结 果
2.1 栀子-川芎冻干粉对RAW264.7细胞增殖的抑制效应 CCK-8实验结果显示,0.075~4.800 g/L 栀子-川芎冻干粉对RAW264.7细胞具有抑制效应,浓度越高,抑制效应越明显,详见图1。本研究选用栀子-川芎冻干粉0.300 g/L作为后续实验浓度。

图1 不同浓度栀子-川芎冻干粉对RAW264.7细胞存活率的影响(n=3)
2.2 栀子-川芎药对的降脂及抗炎效应 与空白对照组比较,模型组TC和FC水平明显升高(P<0.01);与模型组比较,栀子-川芎冻干粉组TC和FC水平明显下降(P<0.01)。详见图2。与空白对照组比较,模型组细胞上清液中TNF-α、IL-6和ICAM-1水平明显升高(P<0.01);与模型组比较,栀子-川芎冻干粉组TNF-α、IL-6和ICAM-1表达水平明显降低(P<0.01)。详见图3。

模型组与空白对照组比较,*P<0.01;与模型组比较,# P<0.01。
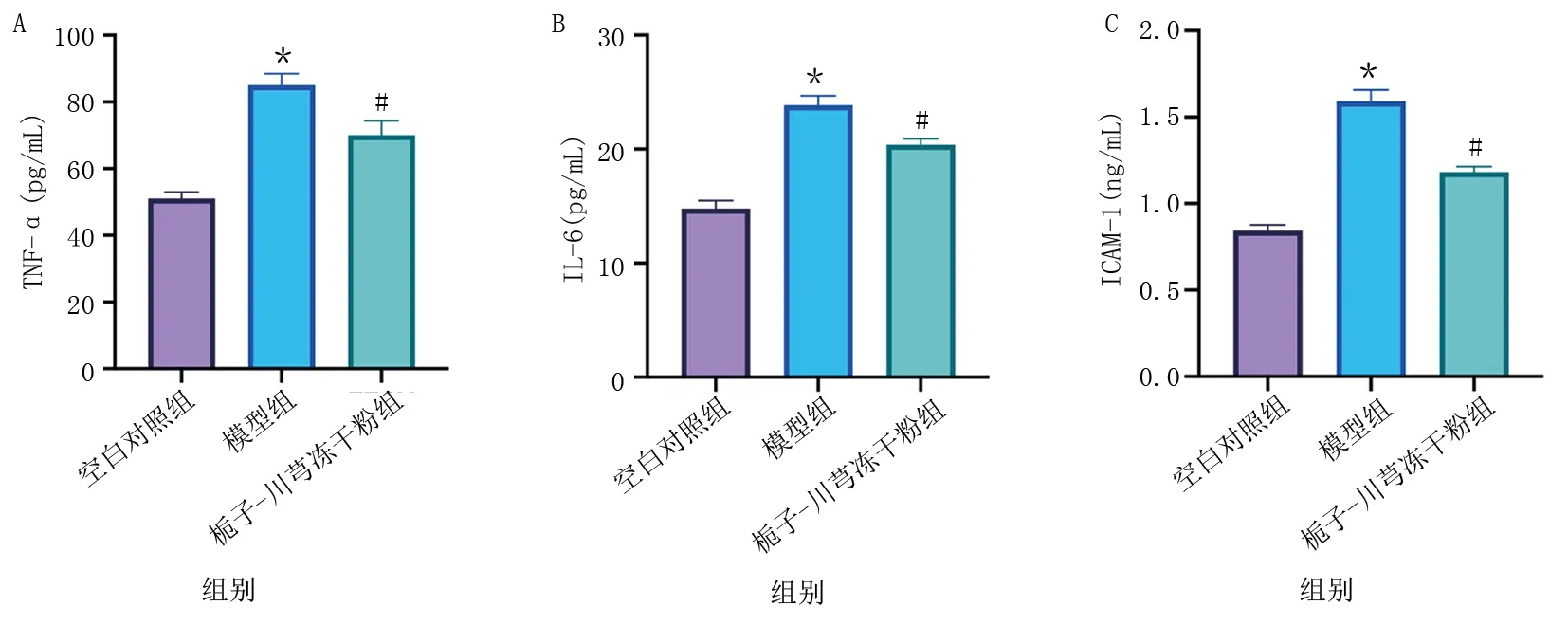
模型组与空白对照组比较,* P<0.01;与模型组比较,# P<0.01。
2.3 栀子-川芎药对逆转ox-LDL诱导的甲基化变化 本研究应用MC-seq来确定栀子-川芎冻干粉是否可以改变泡沫细胞中全基因组DNA甲基化的状态。热图直观地在总体上显示了3组样本中基因的甲基化存在差异(见图4)。进一步分析DMS在启动子至转录起始位点区域(Promoter-TSS)的分布情况,模型组与空白对照组相比,模型组有8 421个DMSs,分别对应5 061个低甲基化和3 405个高甲基化基因位点(见图5)。与模型组比较,栀子-川芎冻干粉组有8 395个DMSs,分别有4 257个高甲基化基因位点和4 138个低甲基化基因位点(见图6)。

图4 3组间基因甲基化程度的总体差异

图5 模型组与空白对照组的差异甲基化基因
对模型组与空白对照组以及栀子-川芎冻干粉组与模型组差异甲基化(聚焦于启动子区域)进行两两比较后取交集,共发现有7 669个DMSs,对应6 016个基因。具体来说,与空白对照组比较,模型组中有3 435个低甲基化的基因(4 315个DMSs)经过栀子-川芎冻干粉处理后变为高甲基化基因(见图7)。有2 581个高甲基化基因(3 049个DMSs)通过栀子-川芎冻干粉处理后变为低甲基化基因(见图8)。表明栀子-川芎冻干粉可以逆转泡沫细胞中ox-LDL诱导的DNA甲基化变化。此外,对栀子-川芎冻干粉诱导的高甲基化与低甲基化基因分别进行KEGG分析,发现高甲基化基因涉及Ras信号通路、磷脂酰肌醇-3-激酶(PI3K)-蛋白激酶B(Akt)信号通路、钙信号通路等(见图9),低甲基化基因涉及Rap1信号通路、Hippo信号通路、Wnt信号通路、PI3K-Akt信号通路等(见图10)。

图7 栀子-川芎冻干粉逆转3 435个模型组低甲基化基因

图8 模型组栀子-川芎冻干粉逆转2 581个高甲基化基因

图9 栀子-川芎冻干粉干预后转为高甲基化基因的KEGG分析

图10 栀子-川芎冻干粉干预后转为低甲基化基因的KEGG分析
2.4 栀子-川芎冻干粉对泡沫细胞RNA表达的影响 RNA-seq检测分析发现栀子-川芎冻干粉对泡沫细胞的基因表达存在影响。主成分分析(principal component analysis,PCA)显示,3组内样本具有良好的一致性且组间有明显差异(见图11),热图(见图12)也发现3组之间的基因表达存在差异。对组间差异表达基因(differentially expressed genes,DEGs)进行可视化展示,与空白对照组比较,模型组有1 344个DEGs,包括874个低表达基因和470个高表达基因(见图13)。与模型组比较,栀子-川芎冻干粉组有634个DEGs,分别对应302个高表达基因上调,332个低表达基因(见图14)。
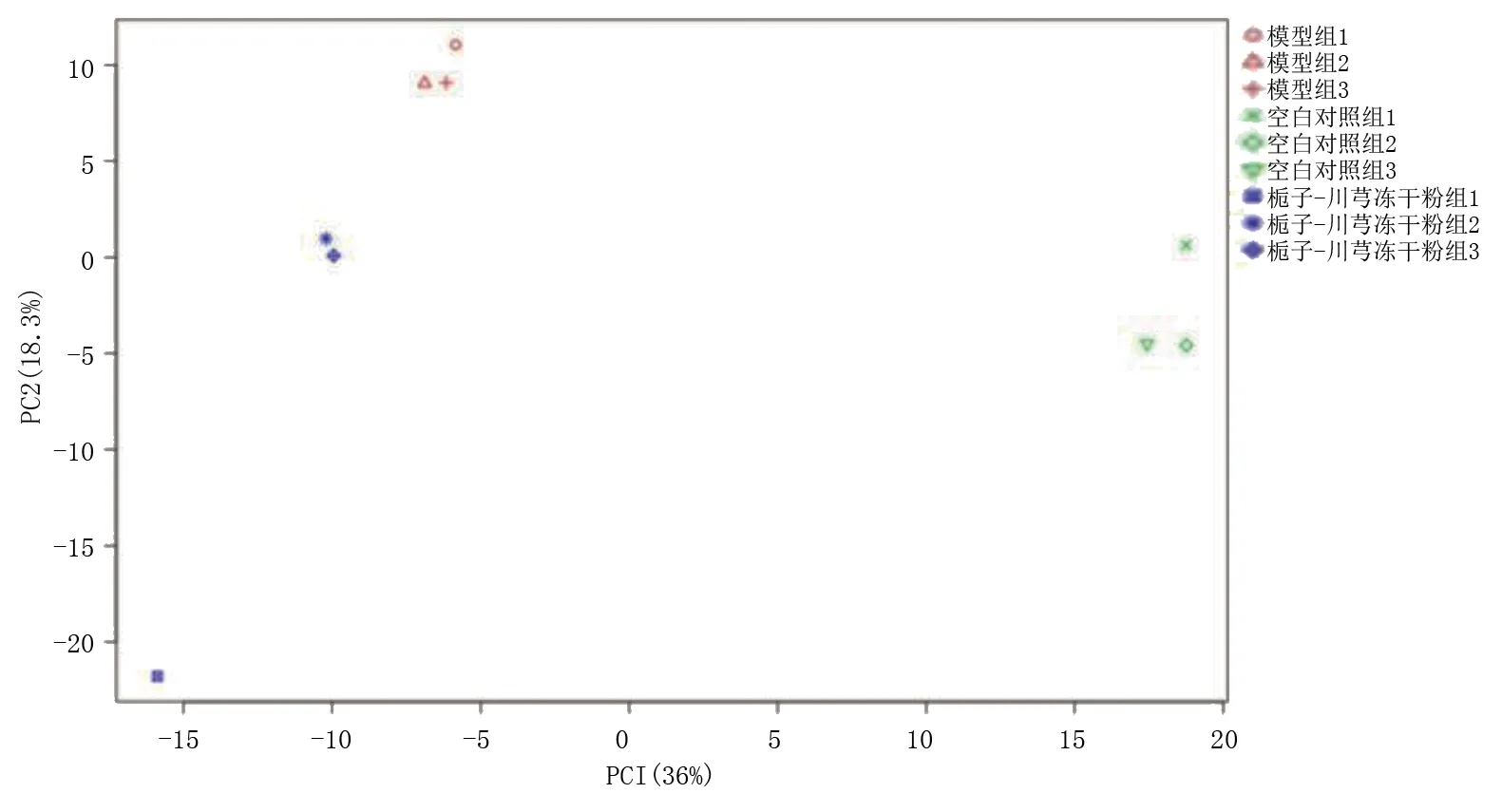
图11 PCA分析

图12 RNA-seq热图

图13 模型组与空白对照组DEGs分布

图14 栀子-川芎冻干粉组与模型组DEGs分布
对模型组与空白对照组,栀子-川芎冻干粉组与模型组DEGs进行两两比较后取交集,共确定119个DEGs。具体而言,ox-LDL处理后上调的39个DEGs经栀子-川芎冻干粉处理后下调,下调的80个DEGs经栀子-川芎冻干粉处理后上调。表明栀子-川芎冻干粉可以逆转ox-LDL诱导的基因表达变化。
2.5 DNA甲基化与RNA表达谱关联分析 DNA甲基化在基因转录中起着重要的调节作用。本研究对栀子-川芎冻干粉对诱导的基因表达变化与DNA甲基化进行关联分析。与模型组相比,栀子-川芎冻干粉组分别有29个低甲基化高表达基因和33个高甲基化低表达基因,详见图15。KEGG分析提示这些基因涉及Focal adhesion信号通路、PI3K-Akt信号通路、晚期糖基化终末产物受体(AGE-RAGE)信号通路等,详见图16。GO分析显示涉及白细胞介素-1的产生、血管生成、肿瘤坏死因子产生的调节等生物学过程,详见图17。

图15 栀子-川芎冻干粉组与模型组 DNA甲基化与RNA表达谱关联分析散点图

图16 栀子-川芎冻干粉组与模型组低甲基化高表达基因以及高甲基化低表达基因的KEGG分析气泡图

图17 栀子-川芎冻干粉组与模型组低甲基化高表达基因以及高甲基化低表达基因的GO分析条形图
3 讨 论
他汀类药物是当前治疗动脉粥样硬化类疾病的主要手段。然而临床研究也发现,部分病人在服用他汀类药物治疗过程中出现的肌肉疼痛或血糖升高等副作用限制了该类药物的使用[12],并且有相当部分病人在接受他汀类药物治疗后仍不可避免地出现了急性心脑血管事件[13]。近年来,从瘀毒致病理论出发创立的活血解毒法抗动脉粥样硬化研究受到众多中医研究者的关注。已有的众多研究表明,与单纯活血化瘀或解毒中药相比,解毒活血中药具有更强的抗动脉粥样硬化效应[14-15]。与既往研究结果一致,本研究中活血解毒中药栀子-川芎药对能够明显降低泡沫细胞中胆固醇与炎性因子水平,显示出了较强的抗动脉粥样硬化效应。
既往大量的研究表明,DNA异常基因甲基化在动脉粥样硬化的发生与发展中扮演重要角色,是动脉粥样硬化的重要治疗靶标。Kumar等[16]发现ox-LDL通过诱导人Kruppel样因子2(endothelial Kruppel-like factor 2,KLF2)高甲基化导致该基因下游的表达降低,最终加重内皮细胞的炎症反应,引发内皮细胞功能紊乱。另一方面,动脉粥样硬化存在基因异常的低甲基化。Aavik等[17]运用高通量技术发现,与9例正常人相比,22例动脉粥样硬化斑块病人存在3 997个异常的高甲基化基因,同时伴有782个异常的低甲基化基因。本研究还发现,与空白对照组相比,模型组存在大量异常的甲基化基因,进一步证明了异常基因甲基化是动脉粥样硬化重要的分子机制。与此同时,本研究发现,栀子-川芎药对能部分恢复ox-LDL诱导的基因异常甲基化水平,异常高甲基化基因[血小板源性生长因子受体α多肽(platelet-derived growth factor receptor alpha,PDGFRα)、纤维连接蛋白1(fibronectin-1,FN1)及Ⅰ型胶原蛋白α2(collagen type I alpha,COL1A2)、酪氨酸蛋白激酶受体B4(Ephb4)等]与异常低甲基化基因[YAM1、硫酯酶超家族成员4(THEM4)、神经型一氧化氮合酶(NOS1)等]被栀子-川芎药对逆转,说明栀子-川芎药对能够双向调控基因甲基化。KEGG分析发现,这些被逆转甲基化的基因涉及Ras信号通路、PI3K-Akt信号通路、Hippo信号通路、Wnt信号通路等。
DNA甲基化调控基因的表达,因而在生命活动中占有重要地位。本研究运用RNA-seq观察栀子-川芎药对调控基因甲基化后的下游效应。经ox-LDL诱导后,出现了异常的DEGs,包括874个低表达基因和470个高表达基因。分别进行两两比较后取交集(模型组与空白对照组,栀子-川芎冻干粉组与模型组),发现共有119个DEGs可被栀子-川芎药对逆转。DNA甲基化在基因转录中起着至关重要的作用,启动子区域高甲基化可引起下游基因的低表达。相反,低甲基化可诱导基因的高表达。在对栀子-川芎药对诱导的基因表达变化与DNA甲基化进行关联分析时发现,与模型组相比,栀子-川芎冻干粉组分别有29个低甲基化高表达基因和33个高甲基化低表达基因,充分证明栀子-川芎药对可通过调节基因甲基化进而调控基因的表达。KEGG富集分析显示上述基因参与Focal adhesion信号通路、PI3K-Akt信号通路、AGE-RAGE信号通路等,涉及的基因包括PDGFRα、FN1及COL1A2等。
进一步分析发现,栀子-川芎冻干粉干预后,PDGFRα、COL1A2、FN1均呈高甲基化低表达的状态。既往研究表明,PDGFRα被激活后可诱导血管平滑肌细胞(VSMCs)的增殖和迁移,引发新内膜病变形成和动脉粥样硬化[18]。Thankam等[19]研究发现,高脂血症猪模型颈动脉血管中PDGFRα的表达明显上调,提示该基因与动脉粥样硬化的进展密切相关。此外,研究发现,动脉粥样硬化病变中COL1A2与FN1的表达明显上调,提示上调的COL1A2与FN1可能与心血管风险增加相关[20-21]。因此,推测栀子-川芎药对可能通过提高PDGFRα、COL1A2和FN1基因的启动子区域甲基化水平进而引起下游的表达,从而起到抗动脉粥样硬化的作用。
综上所述,体外研究发现栀子-川芎药对具有明显的抗动脉粥样硬化效应,其机制可能与双向调控DNA异常甲基化进而影响下游基因的表达有关。研究筛选到的PDGFRα、COL1A2、FN1等基因可能是栀子-川芎药对抗动脉粥样硬化的潜在治疗靶点,为未来进一步深入研究奠定了基础。
