基于网络药理学与动物实验探讨参苓白术散缓解顺铂肾毒性的作用机制*
2023-06-08焦琳殷春霞夏琦曹丽芬余万霖邓时贵
焦琳,殷春霞,夏琦,曹丽芬,余万霖,邓时贵
1.广州中医药大学第二附属医院,广东 广州 510006; 2.广州中医药大学第二临床医学院,广东 广州 510006
顺铂是一线抗癌药物,具有广谱疗效显著、性价比高的优势,但肾毒副作用严重,且呈剂量依赖性,据报道,大约有20%~30%的患者在使用顺铂化疗后会出现不同程度的肾脏功能下降,因此临床应用受限[1-2]。为解决此问题,临床上常采用水化利尿法或调节顺铂给药方式治疗,虽显现出了一定的肾脏保护作用,但效果有限,并存在远期疗效差、药品价格高等缺点[3];同时,大量补液会对患者不利,也给临床工作带来不便,新的缓解顺铂肾毒性(cisplatin nephrotoxicity,C-IN)的疗法急待开发。
中医认为,顺铂肾毒属于“药毒”范畴[4-5],其根本病机是邪盛正虚,是肾脾功能受损所致“湿浊中阻”而引起的一种代谢异常性副作用,以祛邪扶正为基本原则,采用祛湿化浊法或可调节机体代谢、缓解顺铂肾毒性。参苓白术散是常用的祛湿经典名方,具有益气健脾,渗湿止泻,通调水道之功效,主治脾虚湿盛证[6],临床多与化疗药物联用提高患者行为能力。然而参苓白术散与顺铂联用改善C-IN的效果及其机制均未清楚。因此,本研究通过网络药理学方法结合分子对接技术预测参苓白术散核心活性成分、作用通路与关键分子靶点,然后应用小鼠肾损伤模型验证预测结果,阐明参苓白术散缓解 C-IN的潜在作用机制,为开发缓解C-IN的临床办法提供新策略。
1 基于网络药理学探究参苓白术散缓解C-IN的作用机制
1.1 资料与方法
1.1.1 参苓白术散活性成分和靶点的搜集运用中药系统药理学数据库与分析平台(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP,http://tcmspw.com/tcmsp.php,数据收集日期为2022年1月)检索参苓白术散中白扁豆、白术、茯苓、甘草、桔梗、莲子、人参、砂仁、山药、薏苡仁的化学成分,并以口服生物利用度(oral bioavailability,OB)≥ 30%、类药性(drug-likeness,DL)≥ 0.18为条件进行筛选,得出相应活性成分及靶标蛋白。由于TCMSP平台未收录莲子的化学成分,故以“莲子”为检索词,在中医药百科全书(The encyclopedia of traditional Chinese medicine,ETCM,http://www.tcmip.cn/ETCM/index.php)、SymMap数据库(http://www.symmap.org/)查找,同时结合文献收集莲子的成分,通过PubChem网站(https://pubchem.ncbi.nlm.nih.gov/)下载其2D结构的SDF文件,基于SwissADME(http://www.swissadme.ch/)和SwissTargetPrediction平台(http://swisstargetprediction.ch/)筛选出莲子的活性成分与靶点。利用UniProt数据库(https://www.uniprot.org/),选择物种为“Human”,对获得成分靶点信息进行基因名称的规范统一。
1.1.2 C-IN相关靶点搜集以“cisplatin-induced kidney injury”“cisplatin-induced renal injury”“cisplatin-induced kidney failure”“cisplatin-induced renal failure”“cisplatin-induced kidney damage”“cisplatin-induced nephrotoxicity”“cisplatin kidney damage”为检索词在在线人类孟德尔遗传数据库(online mendelian inheritance in man,OMIM,https://www.omim.org/)、Drugbank数据库(https://go.drugbank.com/)、GeneCards数据库(https://www.genecards.org/)收集C-IN的靶点,其中GeneCards数据库筛选条件为Score≥10。将3个数据库的靶点汇总,删除重复值。
1.1.3 参苓白术散缓解C-IN的潜在相关靶点筛选将参苓白术散活性成分靶点与C-IN疾病相关靶点录入Venny 2.1.0软件,绘制韦恩图,得到两者的交集靶点,即为参苓白术散缓解C-IN的潜在靶点。
1.1.4 蛋白质相互作用(protein-protein interaction,PPI)网络及核心靶点的筛选利用STRING数据库(https://cn.string-db.org/)构建交集靶点的PPI网络,物种选择“Homo sapiens”,相互作用阈值为0.9,隐去游离靶点,将文件导入Cytoscape 3.8.2软件进行网络拓扑分析,筛选同时大于2倍网络中介中心性中位数、2倍节点连接度值中位数、接近中心性中位数的靶点;同时结合MCODE模块筛选核心靶点。MCODE模块参数设置为:Degree cutoff:2,Node Score Cutoff:0.2,K-Core:2。
1.1.5 基因本体(gene ontology,GO)功能富集分析和京都基因与基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)信号通路富集分析将交集靶点导入DAVID数据库(https://david.ncifcrf.gov/home.jsp)中进行GO与KEGG分析,其中GO分析包括分子功能(molecular function,MF)、细胞组分(cellular component,CC)、生物学过程(biological process,BP)3个部分。选择“OFFICIAL-GENE-SYMBOL”,物种为“Homo”,根据Pvalue与Count值筛选结果。
1.1.6 分子对接与可视化在RCSB PDB网站(https://www.pdbus.org/)中根据物种、Score值及分辨率选取核心靶点骨架,在PubChem网站中下载核心化合物的3D结构,将两者导入AutoDock 1.5.6软件进行分子对接并计算结合能,利用PyMol 2.5软件进行可视化分析。
1.2 结果
1.2.1 参苓白术散活性成分及靶点筛选通过检索TCMSP、ETCM、SymMap数据库,同时结合文献共获得参苓白术散活性成分213个,其中白扁豆1个,白术7个,茯苓15个,甘草92个,桔梗7个,莲子34个,人参22个,砂仁10个,山药16个,薏苡仁9个,去重后共得到204个活性成分,包括生物碱类、黄酮类、多酚类等,主要活性成分见表1。根据TCMSP、SwissADME和SwissTargetPrediction平台筛选活性化合物的靶点,汇总删除重复值后共得到靶点335个。

表1 参苓白术散主要活性成分
1.2.2 C-IN靶点筛选基于OMIM、Drugbank、GeneCards数据库收集C-IN的靶点,将3个数据库的靶点汇总,删除重复值共得到C-IN疾病相关靶点1 298个。
1.2.3 核心活性成分及核心靶点分析将参苓白术散活性成分靶点与C-IN疾病相关靶点录入Venny 2.1.0软件,如图1所示,共得到参苓白术散缓解C-IN的潜在治疗靶点(交集靶点)137个,选出靶向治疗靶点的活性化合物作为参苓白术散的有效成分。利用Cytoscape 3.8.2软件分析参苓白术散“有效成分-交集靶点”网络,将有效成分按照度值大小排列,得到排名前3位的核心活性成分分别为槲皮素、山柰酚、木犀草素,结果见表2。

图1 参苓白术散缓解顺铂肾毒性的交集靶点韦恩图

表2 参苓白术散核心活性成分(度值前10位)
为了进一步研究参苓白术散缓解C-IN的作用机制,将137个治疗靶点通过STRING网站进行PPI网络分析,发现网络共有137个节点,742条边(其中节点表示靶点,边表示靶点之间的相互作用关系)。随后将结果录入Cytoscape3.8.2软件构建可视化网络拓扑图,分析筛选出同时大于2倍网络中介中心性中位数(0.006 8)、2倍节点连接度值中位数(22)、接近中心性中位数(0.426 0)的靶点19个。最后利用MCODE插件选出核心模块,同时结合度值筛选出排名前10位的核心靶点分别为TP53、STAT3、AKT1、HSP90AA1、JUN、SRC、MAPK3、MAPK1、ESR1、PIK3R1,结果见图2与表3。

注:图中节点越大,颜色越深表明该靶点度值越大,在网络中越重要;连线越粗,颜色越深表明靶点之间的关系越紧密

表3 PPI网络核心靶点信息
1.2.4 GO与KEGG富集分析利用DAVID数据库,将137个治疗靶点进行GO富集分析,结果共富集得到794项BP,84项CC,152项MF。根据显著性与基因富集数目筛选出排名前10位的GO条目,其中BP主要涉及细胞因子信号转导过程(cytokine-mediated signaling pathway)、RNA聚合酶Ⅱ启动子转录的正调控过程(positive regulation of transcription from RNA polymerase Ⅱ promoter)、负调控凋亡过程(negative regulation of apoptotic process)等;CC主要涉及细胞核(nucleus)、细胞溶质(cytosol)、细胞质(cytoplasm)等;MF主要涉及蛋白结合(protein binding)、相同蛋白结合(identical protein binding)、酶结合(enzyme binding)等,结果见图3。

图3 GO富集分析条形图
KEGG富集分析共得到188条通路,选取P值排名前20位的通路进行可视化分析,结果如图4所示,参苓白术散主要通过作用于癌症相关通路(pathways in cancer)、脂质和动脉粥样硬化相关通路(lipid and atherosclerosis)以及糖尿病并发症的AGE-RAGE通路(AGE-RAGE signaling pathway in diabetic complications)、PI3K/AKT信号通路(PI3K/AKT signaling pathway)和MAPK信号通路(MAPK signaling pathway)等来缓解C-IN。
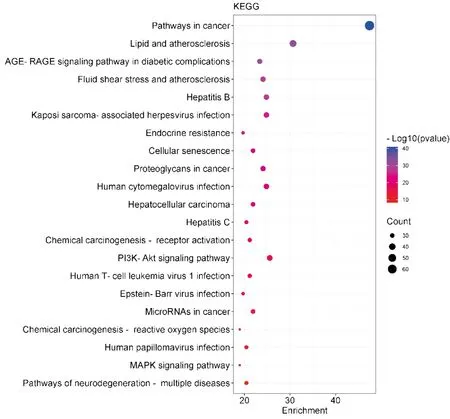
注:圆形节点代表通路。
采用Cytoscape3.8.2软件构建参苓白术散缓解C-IN的“靶点-信号通路”网络,如图5所示。对“靶点-信号通路”网络进行拓扑分析后对得到的靶点度值进行排序,同时与1.2.3项下得到的核心靶点比对取交集,筛选出AKT1、PIK3R1、TP53、MAPK1、MAPK3是其关键作用靶点(红色图标)。

注:蓝色三角形为通路;黄色菱形为作用靶点;红色菱形为关键作用靶点
1.2.5 分子对接选择核心活性成分槲皮素、山柰酚、木犀草素分别与关键作用靶点蛋白AKT1、PIK3R1、TP53、MAPK1、MAPK3进行分子对接,进一步验证参苓白术散缓解C-IN的关键成分与作用靶点。较低的结合能代表配体和蛋白质之间较高的亲和力,一般认为受体和配体的结合能≤-5.0 kcal·mol-1说明两者有较好的结合活性[7-8]。分子对接结果如表4所示,核心活性成分与关键作用靶点具有较好结合活性,且均与MAPK1蛋白有最优结合活性。
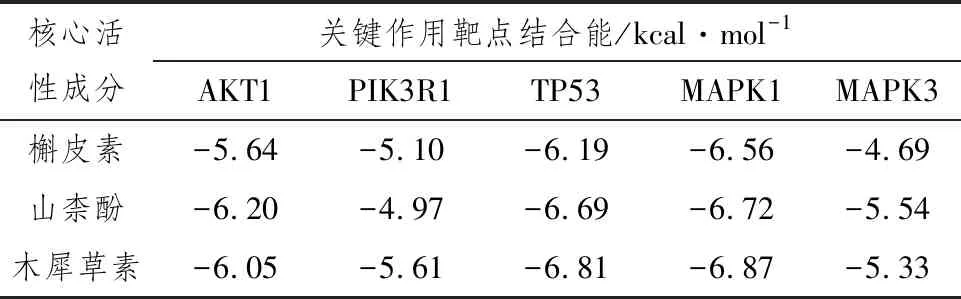
表4 参苓白术散核心活性成分与关键作用靶点分子对接结果
将核心活性成分与MAPK1蛋白对接结果经PyMol 2.5软件可视化,结果见图6。槲皮素与MAPK1相互作用的氨基酸残基为异亮氨酸-84、亮氨酸-73、异亮氨酸-81、组氨酸-78、精氨酸-77和亮氨酸-74;山柰酚与MAPK1相互作用的氨基酸残基为苏氨酸-61、丙氨酸-33、酪氨酸-34和丝氨酸-55;木犀草素与MAPK1相互作用的氨基酸残基为天冬氨酸-104、赖氨酸-162、异亮氨酸-81、组氨酸-78和亮氨酸-74。
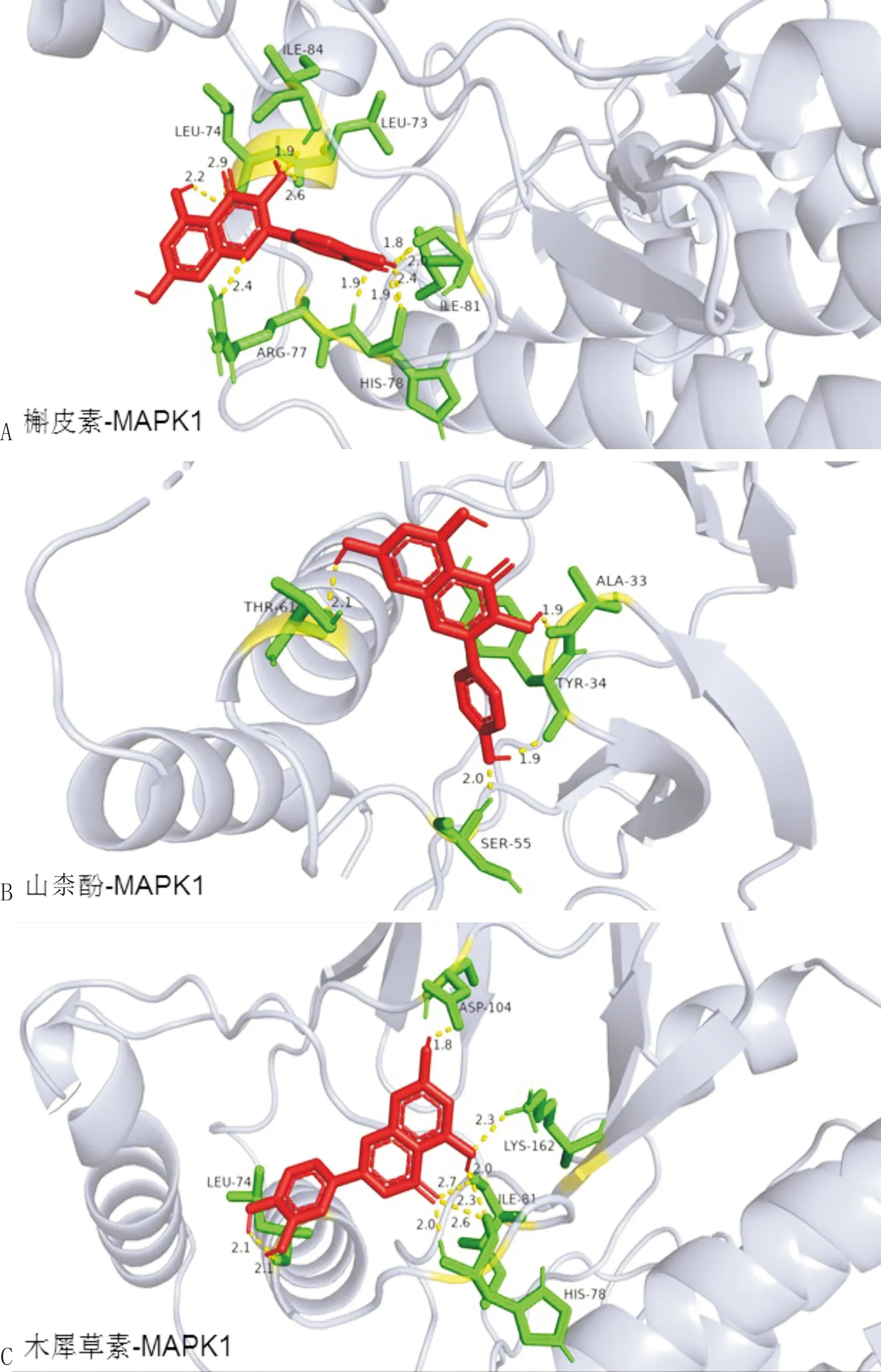
注:蓝色为MAPK1蛋白骨架结构;红色为活性成分3D结构;绿色为氨基酸残基;黄色虚线为氢键;数字为氢键长度
2 基于动物实验验证参苓白术散缓解C-IN的作用机制
2.1 材料
2.1.1 动物SPF级雄性C57BL/6J小鼠24只,购于广东省医学实验动物中心,许可证号:SCXK(粤)2018-0002,饲养于广东省中医院实验动物中心,许可证号:SYXK(粤)2018-0094,饲养条件为SPF级环境,温度23~25 ℃,湿度45%~65%,12 h昼夜节律,800—2000光照,小鼠自由摄食饮水。实验通过了广东省中医院实验动物福利伦理审查,伦理审查批准号:202243。
2.1.2 药物与试剂参苓白术散(北京同仁堂股份有限公司同仁堂制药厂,规格:每袋12 g,批号:21101018);顺铂注射液(江苏豪森药业集团有限公司,规格:30 mg/5 mL,批号:601210607)。优级纯硝酸(天津市科密欧化学试剂有限公司);调谐液(安捷伦科技有限公司,货号:5185-5959);铂(Pt)ICP-MS标准液(美国o2si Smart Solutions公司,货号:060078-04-01);尿素氮(urea,BUN)测试盒 (脲酶法)、肌酐(Creatinine,Cr)测定试剂盒 (肌氨酸氧化酶法)(微板法)(南京建成生物工程研究所,货号:C013-2-1、C011-2-1);HE染色试剂盒(上海碧云天生物技术有限公司,货号:C0105);中性树脂、4%多聚甲醛(上海晶欣生物科技有限公司,货号:C1010、JX0100);β-actin引物、AKT1引物、TP53引物、PIK3R1引物、MAPK1引物、MAPK3引物均由生工生物工程(上海)股份有限公司合成;反转录试剂盒(湖南艾科瑞生物工程有限公司,货号:AG11711);预混型qPCR试剂盒(湖南艾科瑞生物工程有限公司,货号:AG11701)。
2.1.3 仪器真空冷冻干燥机(型号:FreeZone,美国LABCONCO公司);微波消解仪(型号:MARS6,美国CEM公司);电感耦合等离子体质谱(型号:8800ICP-MS,美国Agilent公司);万分之一天平(型号:BSA323S-CW,德国Sartorius公司);冷冻离心机(型号:5418R,德国Eppendorf公司);恒温孵育箱(型号:DNP-9162,上海精宏实验设备有限公司);水浴锅(型号:DK-S22,上海精宏实验设备有限公司);酶标仪(型号:EonC,美国BioTek公司);全自动组织脱水机(型号:VIP6 AI-J2,日本SAKURA公司);组织包埋机、超微量分光光度计、荧光定量PCR仪(型号:HistoStar、NanoDrop 2000c、ABI7500,美国Thermo Fisher Scientific公司);切片机(型号:RM2245,德国Leica公司);全自动染色工作站(型号:ST5020,德国Leica公司);研究级电动显微镜(型号:BX53,日本Olympus公司);梯度PCR仪(型号:Veriti,美国Applied Biosystems公司)。
2.2 方法
2.2.1 肾损伤动物模型制备及分组将24只C56BL/6J雄性小鼠适应性喂养3 d后,随机分为对照组、模型组、减毒组及参苓白术散组,每组6只。模型组每3天注射1次顺铂注射液(3 mg·kg-1)诱导肾损伤[9-11];减毒组注射顺铂注射液(3 mg·kg-1)同时灌胃给予参苓白术散治疗(3 g·kg-1);参苓白术散组仅灌胃给予参苓白术散(3 g·kg-1),对照组每天给予等量的生理盐水。30 d后处死小鼠,取肾脏与血液做后续研究。通过观察肾组织HE病理切片,检测小鼠血清中Cre、BUN的含量,同时采用 ICP-MS检测肾组织内铂离子含量判定模型建立是否成功。
2.2.2 铂离子在肾脏中的含量测定采用电感耦合等离子体质谱(inductively coupled plasma mass spectrometry,ICP-MS)检测肾脏中铂离子的含量。(1)供试品准备:将肾脏组织于-80 ℃预冷24 h后真空干燥研成粉状保存。称取适量肾组织冻干粉至消解罐中,加入5 mL硝酸室温预消解30 min,按照表5程序完成消解后进行赶酸,最后用10%硝酸定容至10 mL。(2)ICP-MS仪器条件:等离子体工作线圈射频功率为1 550 W,采样深度8.00 mm,冷却气、辅助气、雾化气均为氩气,流速分别为 15.00 L·min-1、1.00 L·min-1和0.99 L·min-1,雾化室温度为2 ℃,蠕动泵转速为0.30RSP。(3)标准曲线建立:取Pt标准溶液,使用2%硝酸将其稀释成浓度分别为0.00 μg·L-1、10.00 μg·L-1、25.00 μg·L-1、50.00 μg·L-1、100.00 μg·L-1、500.00 μg·L-1、1 000.00 μg·L-1的标准品溶液,ICP-MS检测后根据其CPS响应值与浓度关系建立标准曲线。(4)供试品经ICP-MS检测后,根据其CPS响应值与标准曲线,计算检测肾组织中铂离子的含量,并计算组织的药物含量,其中300.05为顺铂注射液相对分子量,195.08为铂的相对分子量。

表5 消解程序
顺铂含量=检测铂含量×300.05/195.08
2.2.3 肾功能检查将小鼠血液离心后取血清,按照试剂盒列出的方法检测各组小鼠血清中BUN、Cre的含量。
2.2.4 HE病理检查肾脏组织经脱水、石蜡包埋后,将蜡块切成4 μm的片状,在66 ℃烘箱烘烤 2 h,按照说明书进行HE染色,封片后用病理显微镜观察拍照。
2.2.5 核心靶点的基因表达水平检测取适量肾脏组织提取总RNA并检测浓度,参照逆转录试剂盒说明书将其反转录为cDNA,参照预混型qPCR试剂盒加入SYBR Green后进行扩增,反应体系:10 μL 2X SYBR Green Pro Taq HS Premix,2 μL cDNA,0.8 μL 上游引物,0.8 μL下游引物,0.4 μL ROX Reference Dye(4 μmol·L-1),6 μL无菌超纯水。扩增程序:95 ℃ 预变性30 s,95 ℃变性5 s,60 ℃退火30 s,共40个循环。反应结束后确认PCR的扩增曲线和溶解曲线,记录Ct值,以β-actin作为内参,采用 2-ΔΔCt方法计算核心靶点的基因表达量。引物序列见表6。

表6 引物序列
2.3 结果
2.3.1 参苓白术散显著减少肾组织内铂离子蓄积采用ICP-MS检测各组肾组织内铂离子含量,如表7所示,与对照组比较,模型组肾组织内铂离子含量明显升高(P<0.01);与模型组比较,参苓白术散用药后(减毒组)能显著降低铂离子蓄积(P<0.01),调节顺铂代谢。

表7 参苓白术散缓解顺铂肾毒性评价
2.3.2 参苓白术散能够降低顺铂肾毒副作用与模型组比较,参苓白术散与顺铂联用能够降低小鼠血清中BUN(P<0.05)含量,结果见表7。同时病理HE结果表明,模型组小鼠肾脏组织有明显的结构损伤现象:肾小管变性、坏死(胞浆空泡样变),管腔内有大量受损的管型及脱落的上皮细胞,细胞排列紊乱,肾间质有大量炎细胞浸润;减毒组小鼠肾脏组织中肾小管与肾小球形态比较清晰,有少量肾小管管壁细胞坏死,少见炎性细胞浸润。结果见图7。根据 Paller 法对各组小鼠肾小管损伤进行病理评分[12],与模型组比较,减毒组肾小管损伤程度明显降低(P<0.01),结果见表7。以上结果说明参苓白术散能够有效缓解C-IN。

注:A:对照组;B:模型组;C:减毒组;D:参苓白术散组
2.3.3 参苓白术散与顺铂联用对小鼠体质量的影响实验过程中每5天记录小鼠体质量,结果显示对照组与参苓白术散组小鼠体质量随实验进程而增长,与对照组比较,从第20天开始模型组和减毒组小鼠体质量明显减少(P<0.01),说明参苓白术散未能缓解顺铂引起的小鼠体质量的下降,结果见表8。

表8 参苓白术散与顺铂联用对小鼠体质量的影响
2.3.4 参苓白术散对小鼠肾组织AKT1、PIK3R1、TP53、MAPK1、MAPK3mRNA表达的影响根据网络药理学系统分析结果,选取小鼠各组肾组织检测复方关键作用靶点的mRNA表达水平。结果如表9所示,与对照组比较,模型组TP53、MAPK1、MAPK3的mRNA表达水平显著升高(P<0.01);与模型组比较,减毒组能够显著升高PIK3R1mRNA的表达(P<0.01),降低TP53、MAPK1、MAPK3的mRNA表达(P<0.01)。说明参苓白术散可能通过调控PIK3R1、TP53、MAPK1、MAPK3mRNA的表达发挥缓解C-IN的作用。

表9 肾组织中关键作用靶点mRNA相对表达水平比较
3 讨论
参苓白术散出自《太平惠民和剂局方》,为中医健脾祛湿经典名方,由莲子、薏苡仁(炒)、砂仁、桔梗、白扁豆(炒)、茯苓、人参、甘草、白术(炒)、山药组成,具有调节免疫系统、改善胃肠功能、抗氧化、抗肿瘤、抗炎等药理作用[13],临床上常用参苓白术散(单用或以加减方)辅助铂类化疗药治疗结直肠癌、肺癌,以改善术后患者生活质量[14-15]。最新研究发现,参苓白术散具有镇痛作用并可延长肺癌骨转移小鼠的生存期[16],说明参苓白术散在参与癌症治疗过程中具有减毒潜力,然而其对化疗药物的减毒作用与机制尚不清楚。今后可进一步应用现代多学科交叉技术阐明其作用机制和有效成分,为参苓白术散更好地运用于临床治疗提供依据。
本研究利用网络药理学分析筛选出槲皮素、山柰酚、木犀草素是参苓白术散的核心活性化合物。槲皮素、山柰酚和木犀草素都是具有多种生物活性的黄酮类化合物。槲皮素具有抗氧化、清除自由基、抗炎、抗病毒、抗肿瘤、降糖及免疫调节等作用[17],有研究证实其能够抑制肾小管细胞凋亡[18],或通过抑制巨噬细胞炎症反应等方式缓解顺铂引起的肾毒性[19]。最近有研究制备了槲皮素胶束制剂,在增加槲皮素血药浓度与生物利用度的同时保留了其对顺铂肾毒的缓解作用[20]。山柰酚和木犀草素均具有抗肿瘤、抗氧化、抑菌、抗炎等功效,能从氧化应激、凋亡、炎症等多方面缓解顺铂介导的肾毒性[21-22],尤其是木犀草素能够减少铂离子在肾脏内的蓄积[23],与本研究中参苓白术散的体内实验结果一致。
PPI网络拓扑分析得到参苓白术散缓解C-IN的关键作用靶点为AKT1、PIK3R1、TP53、MAPK1、MAPK3。分子对接显示槲皮素、山柰酚和木犀草素能较好地与AKT1、PIK3R1、TP53、MAPK1、MAPK3结合。AKT是PI3K下游主要效应分子之一,当PI3K与生长因子受体结合后,可改变AKT的蛋白结构使其活化,并以磷酸化作用激活或抑制下游一系列底物[24],激活AKT1能够有效缓解顺铂引起的肾脏毒性[25]。TP53基因是一种抑癌基因,因编码一种分子量为53 kDa的蛋白质(p53蛋白)而得名[26],抑制p53表达或于近端小管靶向缺失p53可在顺铂肾毒性实验模型中发挥肾保护作用[27-30]。MAPK是一组进化保守的丝/苏氨酸蛋白激酶,MAPK1和MAPK3分别编码细胞外调节蛋白激酶2(extracellular regulated protein kinases 2,ERK2)与ERK1,通过抑制MAPK1的表达能够降低顺铂耳毒性[31],且越来越多的研究证实ERK1/2参与改善顺铂副作用[32-33]。此外,5个关键靶点均与肿瘤的发生发展密切相关[34-35],推测参苓白术散与化疗药联用时可能参与肿瘤治疗进程,其配伍效果需要进一步深入探究。
GO富集分析发现,参苓白术散能够调控相关细胞因子信号转导、基因转录、蛋白结合等过程,进一步说明中药复方具有多层次的药理功能。KEGG分析结果表明参苓白术散缓解C-IN的主要信号通路为AGE-RAGE信号通路、PI3K/AKT信号通路和MAPK信号通路。AGE-RAGE信号通路是糖尿病肾病重要发病通路之一,该通路激活后可促使PI3K/AKT和MAPK等通路的激活[36]。PI3K/AKT信号通路是一种细胞内信号转导途径,响应细胞外信号,促进代谢、增殖、细胞存活、生长和血管生成等,PI3K和AKT是该通路的关键基因[37],激活PI3K/AKT信号通路能抑制肾小管细胞凋亡,减轻顺铂引起的肾毒性[38-40]。MAPK信号通路参与细胞的增殖、分化、应激、炎症等多种反应[41],抑制MAPK通路能够降低ERK1/2等基因与蛋白的表达,减轻顺铂耐药与毒副作用[31,42-44]。此外,近期有学者发现通过激活PI3K/AKT信号通路拮抗MAPK介导的自噬通路能够抑制顺铂肠毒性[45],进一步证明PI3K/AKT与MAPK信号通路与顺铂的副作用具有相关性。
为了验证参苓白术散缓解C-IN的作用,本研究构建了C57BL/6J小鼠顺铂肾损伤模型,结果显示,参苓白术散和顺铂联用可以降低顺铂在小鼠肾组织的蓄积,调节顺铂代谢,降低小鼠血清中BUN和Cre含量,改善肾小管细胞形态。qPCR实验结果表明,参苓白术散能够降低模型小鼠肾组织TP53、MAPK1及MAPK3mRNA的表达,升高PIK3R1mRNA的表达。
本研究基于网络药理学初步预测了参苓白术散在多成分、多靶点、多通路的共同作用下缓解C-IN的作用机制,同时利用动物实验进一步验证了参苓白术散可通过调节PI3K/AKT信号通路、MAPK信号通路相关基因的表达发挥缓解C-IN的作用,为开发降低顺铂毒副作用的临床办法提供新思路与实验依据。然而中药复方成分复杂且具有作用通路与靶点不唯一的特点,网络药理学分析仍有一定局限性,后续需要更深入的分子生物学与临床实验来探究。
