牛膝甾酮抑制miR-98-5p促进激素性股骨头坏死大鼠BMSC自噬及成骨分化*
2023-06-08武瑞臣崔书伟李双庆
武瑞臣,崔书伟,李双庆
1.邯郸中心医院,河北 邯郸 056000; 2.冀中能源峰峰集团总医院邯郸院区,河北 邯郸 056000;3.沧州市中心医院,河北 沧州 061000
股骨头坏死(osteonecrosis of the femoral head,ONFH)是临床常见骨科疾病,多发于20~50岁青中年,发病隐匿且进展极快,临床表现为髋部及腹股沟疼痛[1]。激素类药物因其较强的抗炎及免疫抑制作用,被广泛应用于多种疾病的临床治疗,但会导致机体代谢紊乱、痤疮、多毛、高血压、骨质疏松等副作用的出现,其中激素性股骨头坏死(steroid induced osteonecrosis of the femoral head,SONFH)是其最严重的副作用之一。我国是SONFH发病大国,因滥用激素引发的SONFH占ONFH 25%以上[2]。目前,治疗SONFH方式多样,通常采用口服抗凝及抗骨质疏松药物、中药敷贴及手术髓芯加压治疗,但治疗周期长、疗效欠佳、治疗费用过高[3]。牛膝甾酮是从传统中药牛膝中提取的甾酮类物质,具有抗炎、抗病毒、调节机体免疫、延缓衰老等多种生物医学功能[4]。研究表明,牛膝甾酮可提高软骨细胞增殖活性,从而治疗骨关节炎[5]。然而,目前关于牛膝甾酮用于SONFH治疗的报道甚少。本研究通过建立SONFH大鼠模型,观察牛膝甾酮对SONFH大鼠骨髓间充质干细胞(bone manrrow mesenchymal stemcells,BMSC)自噬及成骨分化的影响,以期为临床应用提供实验基础。
1 材料
1.1 实验动物SPF级SD大鼠10只,雄性,6周龄,体质量(200±20) g,购自上海茂生衍生物科技有限公司,生产许可:SCXK(沪)2017-0004。大鼠购入后于通风环境中饲养,保持温度(24±2) ℃、相对湿度50%~60%,给予充足饮水和饲料,12 h/12 h 光照黑暗交替,适应性饲养1周。本研究经邯郸中心医院动物伦理委员会审批通过。
1.2 药物与试剂醋酸泼尼松龙注射液(华中药业股份有限公司,国药准字H42021216,规格:0.125 g);牛膝甾酮(纯度≥98%,上海泽叶生物科技有限公司);LipofectamineTM3000试剂(美国invitrogen公司,货号:L3000008);miR-98-5p mimics及其阴性对照(negative control,NC)(上海拓然生物科技有限公司);双荧光素酶检测试剂盒(上海联迈生物工程有限公司,货号:LM130595-100);2×SYBR Green PCR Mastermix和二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒(北京索莱宝科技有限公司,货号:SR1110、 PC0020);茜素红染色试剂盒(北京百奥莱博科技有限公司,货号:KFS128);兔抗大鼠CD29、CD34、CD45、CD44、Beclin1、微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)、酪蛋白激酶2相互作用蛋白1(casein kinase 2 interaction protein 1,CKIP-1)一抗(美国genetex公司,货号:GTX128839、GTX02602、GTX65913、GTX102111、GTX31722、GTX00949、GTX85240)。
1.3 仪器Synergy-HD型显微镜(日本Toshiba公司);CytoFLEX型流式细胞仪(美国Beckman Coulter公司);Stepone 型实时荧光定量聚合酶链反应(Quantitative Real-time PCR,qRT-PCR)仪(美国ABI公司);Infinite F50 型酶标仪(瑞士Tecan公司);WD-9413A型凝胶成像分析系统(北京六一生物科技有限公司)。
2 方法
2.1 建立激素性股骨头坏死模型取10只SD大鼠,按文献记载的方法建立激素性股骨头坏死模型[6],具体如下:以10 μg·kg-1的剂量给予大鼠尾静脉注射内毒素,24 h后以20 mg·kg-1的剂量腹腔注射醋酸泼尼松龙注射液,每日1次,持续3 d。造模结束后,采用磁共振成像技术检查大鼠股骨头,观察到股骨头内出现严重水肿则表明造模成功。
2.2 BMSCs的提取及鉴定建模成功的大鼠腹腔注射戊巴比妥钠进行麻醉,脱颈处死后无菌环境下切取双侧股骨及胫骨,注射器冲出骨髓,获取骨髓细胞悬液,去除杂质后置于离心机,1 000 r·min-1离心 5 min(离心半径8 cm),弃上清,采用α-MEM培养基(含有10%胎牛血清、1%青霉素和链霉素双抗)于37 ℃,5%CO2条件下培养,培养3 d后换液,待细胞融合至80%,胰酶消化传代,取第3代BMSC,胰酶消化后离心,PBS冲洗后重悬细胞,调整细胞密度为1×106mL-1,注入无菌管内,加入CD29、CD34、CD45、CD44一抗(12 000),4 ℃避光孵育20 min,PBS冲洗后重悬细胞,经流式细胞仪分析CD29、CD34、CD45、CD44的表达。
2.3 细胞分组与干预方式取第3代BMSC,胰酶消化后离心,PBS冲洗后重悬细胞,调整细胞密度为1×106mL-1,接种至6孔板,根据LipofectamineTM3000试剂盒说明书操作,将miR-98-5p过表达质粒miR-98-5p mimics转染至BMSC,转染48 h后分为转染组、牛膝甾酮联合转染组,转染组细胞置于α-MEM培养基中常规培养,牛膝甾酮联合转染组细胞培养基中需另外加入牛膝甾酮,使其终浓度为10 mg·L-1[7],继续培养48 h。另取第3代BMSC分为对照组、牛膝甾酮组,对照组置于α-MEM培养基中常规培养,牛膝甾酮组细胞培养基中需另外加入牛膝甾酮,使其终浓度为10 mg·L-1。每组均设置5个复孔,培养48 h用于后续实验。
2.4 qRT-PCR检测转染后各组细胞miR-98-5p mRNA表达情况取2.3项中培养48 h后的各组细胞,PBS冲洗,采用Trizol法提取总RNA,逆转录为cDNA,以U6为内参定量检测miR-98-5p的表达,根据试剂盒说明书要求配制反应体系:双倍核酸染料12 μL,无菌双蒸水4 μL,上下游引物(10 μmol·L-1)各1 μL,模板cDNA 2 μL,总体积20 μL。扩增条件:94 ℃预变性4 min;94 ℃变性40 s,60 ℃退火40 s,72 ℃延伸90 s,重复40个循环。实验所用引物:miR-98-5p Forward primer 5′-ATCCAGTGCGTGTCGTG-3′;Reverse primer 5′-TGCTTGAGGTAGTAAGTTG-3′;U6 Forward primer 5′-CTCGCTTCGGCAGCACA-3′;Reverse primer 5′-AACGCTTCACGAATTTGCGT-3′。
2.5 Western blot法检测细胞Beclin1、LC3Ⅱ、CKIP-1蛋白表达量取2.4项中培养48 h后的各组细胞,PBS冲洗,加入RIPA裂解液,置于离心管内,8 000 r·min-1离心20 min(离心半径8 cm),收集沉淀物,采用BCA试剂盒定量蛋白。取50 μg待测样本,以体积比15与上样缓冲液混合,100 ℃ 水浴5 min变性蛋白,同条件离心,取其上清液,恒压下行聚丙烯酰胺凝胶电泳分离,湿法转至硝酸纤维素膜,5%脱脂牛奶封闭2 h,TBST洗膜,加入兔抗大鼠Beclin1、LC3Ⅱ、CKIP-1一抗(稀释比例1500),4 ℃摇床孵育过夜,TBST洗膜,加入二抗(稀释比例12 000),常温孵育2 h,加入ECL发光液显色,置于暗室曝光,经凝胶成像系统分析,以Beclin1、LC3Ⅱ、CKIP-1蛋白条带灰度值与内参GAPDH条带灰度值比值表示Beclin1、LC3Ⅱ、CKIP-1蛋白表达量。
2.6 对硝基苯磷酸盐法检测碱性磷酸酶(phosphatase alkaline,ALP)活性取2.3项中培养48 h后的各组细胞,胰酶消化后离心,PBS冲洗后重悬细胞,调整细胞密度为1×106mL-1,接种至96孔板,各孔均加入α-MEM培养基200 μL,待细胞融合至80%,更换为成骨诱导培养基,2周后加入对硝基苯磷酸盐反应液(每孔100 μL),37 ℃孵育20 min,每孔加入0.2 mol·L-1氢氧化钠终止液50 μL,经酶标仪测定405 nm处吸光度值。
2.7 茜素红染色法检测钙化结节面积占比取2.3项中培养48 h后的各组细胞,加入成骨诱导液,待显微镜下可见黄褐色钙化结节,成骨诱导培养基继续培养2周,弃去培养液,PBS冲洗,无水乙醇固定20 min,加入茜素红染液常温下染色30 min,PBS冲洗,置于显微镜下观察钙化结节形成情况,随机选取5个不重复的视野,使用Image Pro软件处理图片,计算钙化结节面积平均占比。
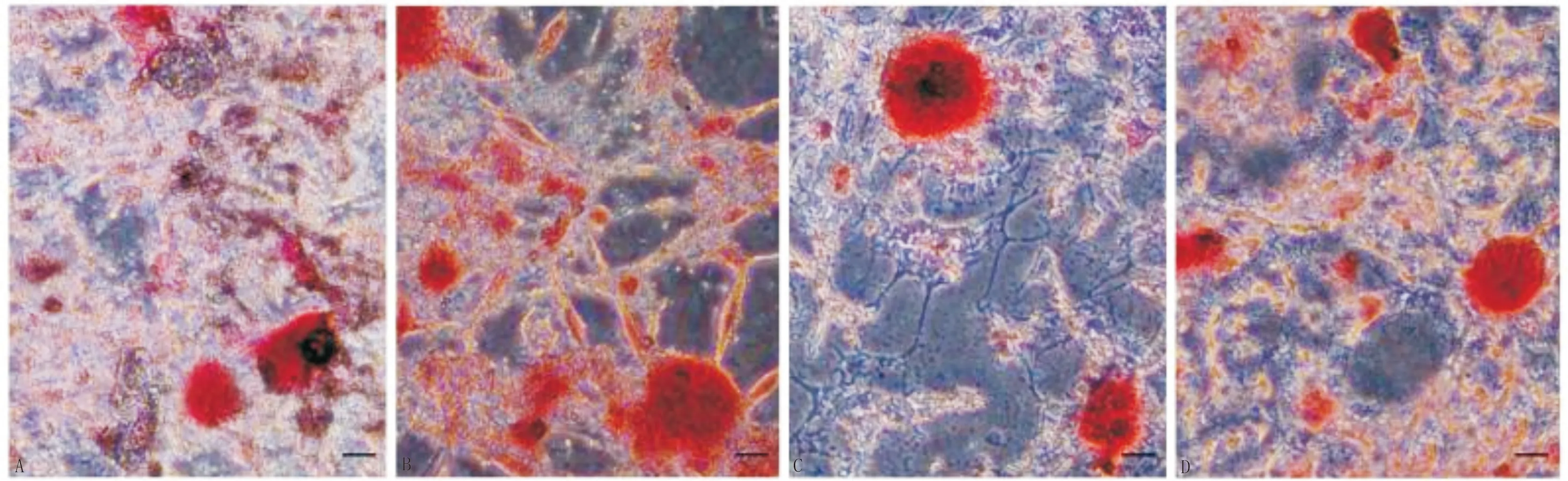
2.8 双荧光素酶实验验证miR-98-5p与CKIP-1的靶向关系TargetScan预测CKIP-1 3′UTR可能与miR-98-5p结合的潜在位点,上海经科化学科技有限公司对其进行鉴定。构建合成CKIP-1野生型和突变型3′UTR,分别为CKIP-1 3′-UTR-WT、CKIP-1 3′-UTR-MT,并将其插入双荧光素酶载体,与miR-98-5p质粒(miR-98-5p mimic、miR-98-5p mimic-NC)共转染至293T细胞,分为CKIP-1 3′-UTR-WT+miR-98-5p mimic-NC组、CKIP-1 3′-UTR-WT组+miR-98-5p mimic组、CKIP-1 3′-UTR-MT+miR-98-5p mimic-NC组、CKIP-1 3′-UTR-MT组+miR-98-5p mimic组。24 h后收集细胞,经双荧光素酶检测试剂盒检测荧光素酶活性,萤火虫荧光素酶活性/海肾荧光素酶活性=目标相对荧光素酶活性。
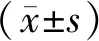
3 结果
3.1 BMSC形态观察、表面特异性标志物鉴定经显微镜观察发现,第3代BMSC形态呈三角形、梭形、扇形、圆形,胞浆丰富,排列有序;传代后细胞生长旺盛,增殖较快,第7天融合度达80%,梭形生长。经流式细胞仪检测,BMSCs表面CD29、CD44表达率均超过95%,CD34、CD45为阴性表达,表明培养的细胞为BMSCs。
3.2 转染后各组miR-98-5p表达量比较与对照组比较,牛膝甾酮组miR-98-5p表达量显著降低(P<0.05),转染组miR-98-5p表达量显著升高(P<0.05);与牛膝甾酮组比较,牛膝甾酮联合转染组miR-98-5p表达量显著升高(P<0.05);与转染组比较,牛膝甾酮联合转染组miR-98-5p表达量显著降低(P<0.05)。见表1。

表1 各组miR-98-5p表达量比较
3.3 BMSC自噬相关蛋白Beclin1、LC3Ⅱ表达量比较与对照组比较,牛膝甾酮组Beclin1、LC3Ⅱ蛋白表达量显著升高(P<0.05),转染组Beclin1、LC3Ⅱ蛋白表达量显著降低(P<0.05);与牛膝甾酮组比较,牛膝甾酮联合转染组Beclin1、LC3Ⅱ蛋白表达量显著降低(P<0.05);与转染组比较,牛膝甾酮联合转染组Beclin1、LC3Ⅱ蛋白表达量显著升高(P<0.05)。见表2,图1。
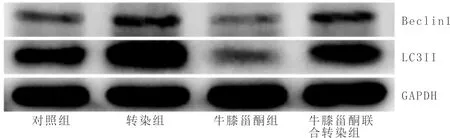
图1 各组细胞Beclin1、LC3Ⅱ蛋白条带图

表2 各组细胞Beclin1、LC3Ⅱ蛋白表达量比较
3.4 各组细胞ALP活性比较与对照组比较,牛膝甾酮组ALP活性显著升高,转染组ALP活性显著降低(P<0.05);与牛膝甾酮组比较,牛膝甾酮联合转染组ALP活性显著降低(P<0.05);与转染组比较,牛膝甾酮联合转染组ALP活性显著升高(P<0.05)。见表3。

表3 双荧光素酶实验结果比较

表3 各组细胞ALP活性比较
3.5 各组细胞钙化结节面积占比比较与对照组比较,牛膝甾酮组钙化结节面积占比显著升高(P<0.05),转染组钙化结节面积占比显著降低(P<0.05);与牛膝甾酮组比较,牛膝甾酮联合转染组钙化结节面积占比显著降低(P<0.05);与转染组比较,牛膝甾酮联合转染组钙化结节面积占比显著升高(P<0.05)。见图2。
注:A:对照组;B:牛膝甾酮组;C:转染组;D:牛膝甾酮联合转染组
3.6 双荧光素酶实验结果双荧光素酶结果显示,与CKIP-1 3′-UTR-WT+miR-98-5p mimic组比较,CKIP-1 3′-UTR-WT+miR-98-5p mimic-NC组、CKIP-1 3′-UTR-MT+NC mimic组、CKIP-1 3′-UTR-MT组+miR-98-5p mimic组荧光素酶活性值显著升高(P<0.05);CKIP-1 3′-UTR-WT+miR-98-5p mimic-NC组、CKIP-1 3′-UTR-MT+miR-98-5p mimic-NC组、CKIP-1 3′-UTR-MT组+miR-98-5p mimic组3组荧光素酶活性值比较差异无统计学意义(P>0.05),推测CKIP-1是miR-98-5p的一个靶基因,两者结合位点为CKIP-1的3′-UTR片段。见图3,表3。
图3 双荧光素酶实验结果
3.7 各组细胞CKIP-1蛋白表达量比较与对照组比较,牛膝甾酮组CKIP-1蛋白表达量显著降低,转染组CKIP-1蛋白表达量显著升高(P<0.05);与牛膝甾酮组比较,牛膝甾酮联合转染组CKIP-1蛋白表达量显著升高(P<0.05);与转染组比较,牛膝甾酮联合转染组CKIP-1蛋白表达量显著降低(P<0.05)。见图4,表4。
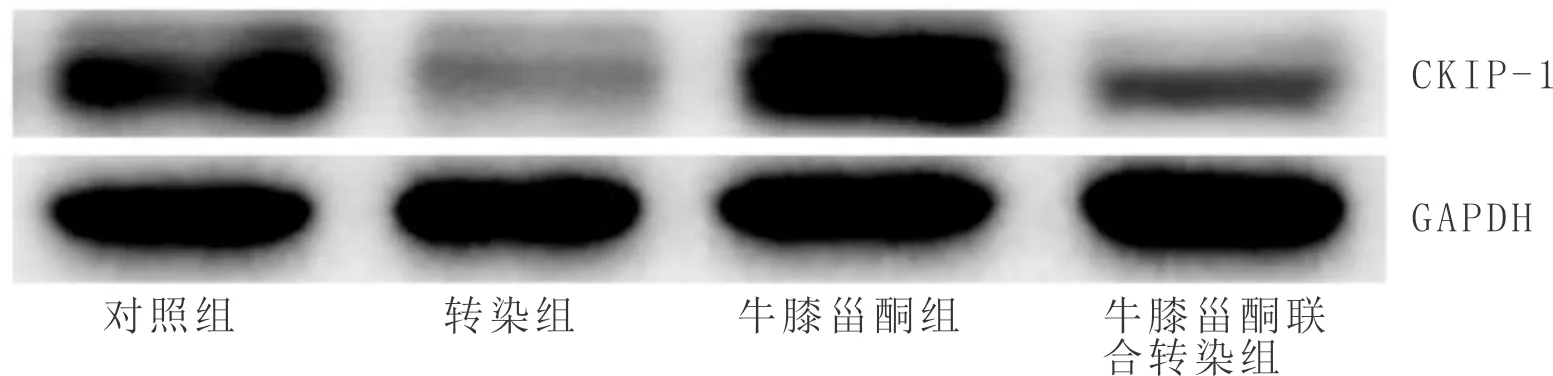
图4 各组细胞CKIP-1蛋白条带图

表4 各组细胞CKIP-1蛋白表达量比较
4 讨论
SONFH是因长期或大量应用激素类药物造成股骨头血液循环障碍,引起的髋关节障碍疾病,早期表现为股骨头广泛性骨质疏松、骨小梁中断,后发展为股骨头塌陷、关节间隙变窄、股骨头缺血性坏死,引发严重髋关节炎,致残率居高不下[8-11]。目前国内外对SONFH发病机制的研究尚无突破性进展,骨细胞凋亡、脂肪栓塞、凝血机制改变、骨内高压等均是其可能机制[12-14]。近年来,新研究结果表明,SONFH的发生可能与激素抑制BMSC成骨分化及自噬功能有关,在激素的作用下,BMSC发生衰老,传代及成骨分化能力下降,打破股骨头内破骨-成骨动态平衡,大量分化为脂肪细胞,造成脂肪堆积,同时BMSC保护性自噬功能降低,细胞大面积凋亡,破坏股骨头内骨结构,从而发病[15-17]。因此,探寻提高BMSC自噬功能及成骨分化能力的新型治疗方式,对于改善患者预后、降低致残率具有积极意义。
ALP是促进骨形成的重要磷酸酶,可提升骨基质钙、磷浓度,促进其钙化成熟,其活性越强代表成骨分化能力越强,可作为成骨细胞早期分化指标[18]。钙化结节是钙盐沉淀产物,是成骨的早期阶段,是判定成骨细胞分化完成的重要标志[19]。中医将SONFH归入“骨蚀”“骨痹”范畴,其主要病机为肝肾虚亏、阳气不足,以致腰脊不举、骨枯髓减,进而发病,激素为辛温燥热之物,壮火食气、阳邪过盛、伤津耗气,以致肾阳虚衰、脉络血瘀,故而治疗上应以补肾益肝,活血化瘀为主[20-21]。中药牛膝取自苋科植物牛膝的干燥根,性平,味苦、酸,归肝经、肾经,可补肝肾,强筋骨,逐瘀通经,汉末《名医别录》记载,牛膝可治疗伤中少气、男肾阴消、老人失溺、补中续绝、填骨髓、除脑中痛及腰脊痛[22]。牛膝甾酮是牛膝主要活性物质之一,可促进成骨细胞增殖、分化[23]。本研究结果显示,与对照组比较,牛膝甾酮组Beclin1、LC3Ⅱ蛋白表达量、ALP活性、钙化结节面积占比升高,提示牛膝甾酮可提升BMSC自噬功能及成骨分化能力。
miRNA是机体内一种小型内生非编码RNA,可通过与mRNA非翻译区碱基互补配对,抑制转录及蛋白质翻译,从而调控基因表达,在多种疾病发生和发展过程中扮演重要角色[24]。郑峰等[25]研究发现,干扰miR-98-5p可通过激活下游基因促进成骨细胞增殖、分化。CKIP-1是成骨分化重要调控因子,广泛存在于大脑组织、心肌组织、骨组织及BMSC、免疫细胞中,在细胞增殖、分化、凋亡过程中发挥重要作用,可通过蛋白酶体降解途径,加速骨相关蛋白降解,参与骨发育、骨再生过程,起到负向调控作用[26-27]。Huang等[28]研究认为,低表达CKIP-1可提升间充质细胞增殖及成骨分化能力,提示CKIP-1在成骨分化方面的作用。本研究经双荧光素酶实验验证,miR-98-5p与CKIP-1存在结合位点,CKIP-1是其靶向调控基因之一。此外,本研究结果显示,与对照组比较,转染组Beclin1、LC3Ⅱ蛋白表达量、ALP活性、钙化结节面积占比降低,CKIP-1蛋白表达升高,且转染后对牛膝甾酮的成骨促进作用有所影响,提示miR-98-5p在SONFH大鼠BMSC中高表达,牛膝甾酮可能通过抑制miR-98-5p从而下调CKIP-1促进BMSC自噬及成骨分化。
综上所述,牛膝甾酮可促进SONFH大鼠BMSC自噬及成骨分化,其作用机制可能与抑制miR-98-5p从而下调CKIP-1表达有关。
