关节病型银屑病动物模型的发展现状
2023-06-07晏少琛史琳丽戴生明毕新岭
晏少琛,史琳丽,戴生明,毕新岭
关节病型银屑病(psoriasis arthropathica)又称银屑病关节炎(psoriatic arthritis,PsA)是银屑病的一种特殊类型,常见表现为外周关节炎、指(趾)炎、附着点炎和脊柱炎[1]。据研究,世界各个地区银屑病患者中PsA的年发病率从0.27%到2.7%不等[2],在中国银屑病患者中的患病率约为6%~13%[3],多数患者首先出现皮肤症状,然后是关节病变。早期识别PsA并且及时给予治疗对改善预后非常重要,但由于无法对PsA患者进行常规活检,因此模拟人类PsA特征的动物模型的建立对该病的研究十分重要。目前尚缺乏既表现银屑病皮肤同时伴有关节病变的理想动物模型,本文对近年国内外PsA动物模型的发展概况进行了阐述(表1)。
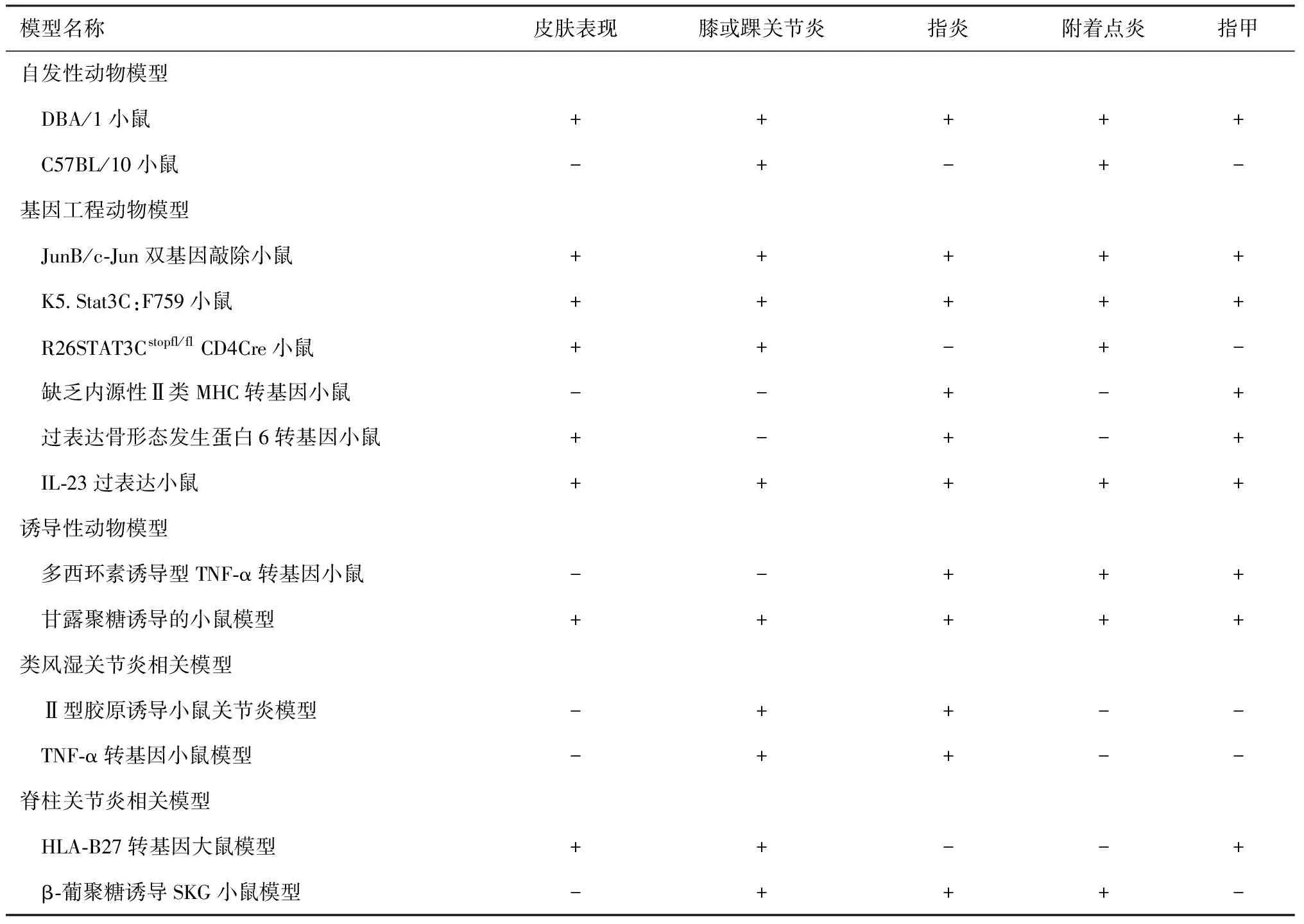
表1 主要PsA动物模型表型特点
1 自发性动物模型
1.1DBA/1小鼠 DBA小鼠模型最初为Little建立,包括DBA/1和DBA/2两个主要的亚系。Lories等[4]详细记录了33只12周龄雄性DBA/1小鼠的关节表现,并在出现症状和体征后的不同时间点处死,对后爪进行组织学检查。发现61%的后爪(40只)出现不同程度的关节病变,表现为关节肿胀、关节僵硬以及关节畸形,病理表现主要为软骨内骨形成、指炎及骨膜炎,其中8只还出现了甲受累。近年的研究还表明,该小鼠模型能自发出现银屑病样皮损,并且与白细胞介素(interleukin,IL)-17密切相关[5],与PsA极为相似。
1.2C57BL/10小鼠 强直性肌腱端病(ankylosing enthesopathy,ANKENT)是一种自发的小鼠关节疾病,具有人类强直性脊柱炎的一些特征。该病最常在C57BL/10背景的小鼠中观察到,其中以B10.BR(H-2k)为代表。早期表现为增殖性炎症,轻度白细胞浸润,关节韧带附着处轻度骨质侵蚀,随后可以观察到软骨细胞在肌腱和骨结合部增殖,类似于PsA中的附着点病变。将雄性C57BL/10小鼠同笼饲养,在6~10月龄时关节炎发生达高峰期,约20%的小鼠自发出现踝关节强直性附着点炎[6],如果在小鼠体内转入人HLA-B27基因,自发性关节炎的发病率会明显增加,但在无菌环境下这些小鼠不出现自发性关节炎[7]。
2 基因工程动物模型
2.1JunB/c-Jun双基因敲除小鼠 JunB蛋白是转录因子AP-1的一个组成部分,有调节细胞增殖、分化、应激反应和细胞因子表达的作用。JunB在银屑病患者正常皮肤表皮层普遍表达,在重度的银屑病皮损中的表达显著降低,提示JunB可能在银屑病的发生发展中起作用。c-Jun是JunB的一种拮抗剂,它在正常人表皮中弱表达,但在银屑病患者皮肤中的表达相当明显。
在JunB/c-Jun双基因敲除小鼠中,腹腔注射他莫昔芬8~10 d后,无毛皮肤处开始出现银屑病样病变。在用药18 d后,所有实验小鼠均出现明显皮损,主要表现为耳朵、足爪和尾巴的鳞屑性斑块。组织学表现为表皮角化过度、角化不全、棘层增厚明显、皮突延长,并可见表皮中性粒细胞浸润,真皮内血管增生,巨噬细胞数量增多。所有小鼠中都能观察到伴有大量骨质破坏和骨膜炎的关节病变,与PsA有一定的类似之处。此实验小鼠中一些细胞因子及蛋白(如S100A8和S100A9)的变化也与人类银屑病患者有相似之处,有助于研究银屑病和PsA的临床和分子特征[8]。
2.2K5.Stat3C:F759小鼠 Gp130F759基因敲入小鼠由于细胞因子信号转导抑制因子3依赖的负调控功能受损,导致持续的核磷酸化-信号转导子与转录激活子3(the nuclear phospho-signal transducer and activator of transcription3,STAT3)激活从而在8月龄左右发生自身免疫性关节炎,近年也被用作类风湿关节炎的相关研究[9];K5.Stat3C转基因小鼠中角质形成细胞表达活化STAT3蛋白,导致小鼠银屑病样皮损,是常用的银屑病动物模型之一[10-11]。将上述两种小鼠杂交后,携带K5.Stat3C基因的F759小鼠不仅皮损加重,而且早在3周龄时足爪就自发地出现了高外显率关节炎。关节病变包括外周关节肿胀和与皮肤病变相邻的指甲变形,组织病理学检查显示存在附着点炎和骨侵蚀,并有单个核细胞浸润;免疫组织化学分析和流式细胞术等检测也显示,受累关节中IL-23/辅助性T细胞(T helper cell,Th)-17通路上调,与PsA非常相似。此外,用12-o-十四烷酰佛波-13局部刺激F759小鼠足爪也可促进银屑病样皮损产生,并导致相应关节肿胀[12]。
2.3R26STAT3Cstopfl/flCD4Cre小鼠 R26STAT3Cstopfl/flCD4Cre小鼠首先是在研究哮喘时使用的转基因小鼠模型,该模型的T淋巴细胞选择性高表达活性STAT3蛋白。Yang等[13]将其用于银屑病及PsA的研究,研究表明R26STAT3Cstopfl/flCD4Cre小鼠模型在大约5周龄时开始出现体毛稀疏,耳朵和尾巴上的皮肤干燥。随着周龄增长,小鼠出现局灶性脱毛、脱屑,组织病理学显示棘层增厚、角化过度及角化不全,而且表皮中还观察到与Munro微脓肿相似的细胞团块。同时,该小鼠还自发地出现附着点炎和滑膜炎,尽管肉眼检查没有发现明显的关节肿胀,但通过定量聚合酶链反应检测关节处炎症基因mRNA的表达、组织病理学分析、显微计算机断层扫描等手段发现肌腱及关节滑膜炎细胞浸润,外周及中轴关节发生骨量减少或者骨侵蚀。拮抗IL-17或敲除IL-22可改善该小鼠模型皮肤和骨骼病变,验证了Th17在银屑病及PsA发病机制中的中心地位。
2.4缺乏MHCⅡ类基因转基因小鼠 Bardos等[14]用人白细胞抗原(human leukocyte antigen,HLA)基因取代小鼠内源性自身主要组织相容性复合体(major histocompatibility complex,MHC)Ⅱ类基因,这种小鼠在6月龄后会自发出现趾炎和甲病变,并伴有严重的骨质破坏,病变主要集中在远端指骨,雌性好发,其临床表现、组织病理学和影像学改变与人类PsA相似。但不同亚型HLA转基因小鼠发病率存在较大差异,其中HLA-DR4转基因小鼠发病率最高。类似的动物模型也越来越多地用于其他疾病的研究[15],深入揭示了人类HLA基因的作用。
2.5过表达骨形态发生蛋白6转基因小鼠 骨形态发生蛋白6(bone morphogenetic protein 6,BMP6)属于转化生长因子-β家族,有调节皮肤动态平衡的作用[16]。利用角蛋白10启动子在小鼠表皮基底层过表达BMP6,实验小鼠表现出一些银屑病的典型组织学特征,比如角化过度、角化不全等。同时,这些小鼠还出现明显的趾甲异常,伴有掌部及趾关节的肿胀[17]。但是近年的研究表明,BMP6在银屑病患者皮肤中的表达是下调的,并且可能在银屑病的发展中起关键作用[16,18],所以该小鼠模型发生机制以及BMP6蛋白的作用还有待更深入的研究。
2.6IL-23过表达小鼠 将编码IL-23的微环DNA导入小鼠,在小鼠体内过表达IL-23,从而诱发了外周及中轴关节的附着点炎、指炎和一些关节外表现(银屑病样皮肤病变和主动脉根部炎症)。和人类PsA相似,实验小鼠病变关节也出现骨质破坏和新骨生成。该研究还表明,IL-17虽然也在PsA等关节炎中发挥作用,但使用同样技术手段建立的IL-17过表达小鼠未能出现相关病理变化[19-20],这与临床IL-17抑制剂的有效性不符。该小鼠模型模拟了PsA发生的部分机制,可靠性较强,当前很多相关研究也以此模型为基础[21]。
3 诱导性动物模型
3.1多西环素诱导型TNF-α转基因小鼠 有研究者利用四环素反应启动子构建了TNF-α转基因小鼠模型,定期给6周龄该模型小鼠喂食含多西环素的蔗糖水,2周后出现前后爪红肿、活动能力下降等症状,并随着多西环素的持续应用而不断加重。小鼠踝关节没有受到影响,但是远端指间关节肿胀和趾甲变形明显,组织学上表现为远端指骨炎症伴有软骨、骨破坏,类似人类PsA的典型特征“腊肠指”。虽然没有观察到皮肤病变,但在棘层发现S100A9蛋白表达的改变。这种小鼠疾病模型是可控制的,在停止给药后,关节肿胀明显减轻,握力逐渐增加,3~5周后病变的趾甲也恢复正常[22],这对PsA恢复过程研究可能具有重要意义。
3.2甘露聚糖诱导的小鼠模型 给易感小鼠腹腔注射酿酒酵母产生的甘露聚糖,小鼠产生了耳、足掌为主的银屑病样皮损(表皮角化过度、棘层增厚及炎细胞浸润)和关节病变(红肿)。在缺乏活性氧的Ncf1基因突变小鼠中更为明显,关节病变特征是附着点炎、滑膜炎、软骨损伤和骨膜炎。研究人员推测,甘露聚糖可以诱导组织内巨噬细胞激活,进而分泌TNF-α并同时激活γδT细胞,从而导致局部产生IL-17引起PsA样病变[23]。最近也有学者认为,巨噬细胞产生的一氧化氮促进了病变的产生[24]。无论如何,此模型小鼠的开发对于研究PsA患者的新疗法可能会非常有意义。但是在人类PsA病程发展中,获得性免疫和先天免疫均发挥重要作用,而此模型中获得性免疫作用较小[25]。
4 类风湿关节炎相关模型
PsA和类风湿关节炎(rheumatoid arthritis,RA)在免疫机制及组织病理上有很多相似之处,如滑膜炎、骨质破坏、抗TNF-α治疗有效等,两者最终都导致关节的畸形和功能丧失,因此RA的动物模型常被应用于PsA的研究。
4.1Ⅱ型胶原诱导小鼠关节炎模型 Ⅱ型胶原诱导的关节炎(collagen-induced arthritis,CIA)模型是RA研究中最常用的模型,与RA最基本的相似之处是产生了针对胶原蛋白的自身抗体。CIA模型通常采用DBA/1小鼠,给药后4周左右就可以观察到滑膜增生伴炎性细胞浸润、软骨破坏和骨侵蚀等病理变化,是一种高效、经济、可重复性的模型[26]。在人类RA发病过程中涉及的典型细胞因子轴(如Th-17轴)等,也常采用CIA模型进行研究[27],这些机制在PsA的发展过程中同样扮演着重要角色,因此CIA模型也是进行PsA治疗研究的常用模型[28]。
4.2TNF-α转基因小鼠模型 George Kollias在1991年培育出了过表达人类TNF-α的转基因小鼠,3个月左右开始出现踝关节病变,随着月龄增大而发展成一种侵蚀性多关节炎,具有RA的许多组织学特征,使用抗TNF-α抗体可以防止病变的发生[29]。该小鼠模型不但验证了TNF-α在RA中的重要作用、抗TNF-α治疗的显著疗效,并且改变了在后续研究中RA、PsA等疾病的管理策略。近年来,基于TNF-α转基因小鼠上的信号通路及相关分子作用的发现可能会为PsA的发展及治疗的研究提供新的思路[30-31]。
5 脊柱关节炎相关模型
脊柱关节炎(spondyloarthritis,SpA)是一组炎症性关节疾病,中轴型PsA可作为其亚型,具有SpA共同的临床和免疫学特征,也有共同的遗传因素[32],因此相关的动物模型可用来研究共同的作用机制。
5.1HLA-B27转基因大鼠模型 SpA具有明显的遗传性,这主要与HLA-B27基因相关[33]。Hammer等[34]将HLA-B27和人类β2微球蛋白基因导入大鼠体内,6~10周后出现以下肢为主的外周关节炎和脊柱炎,雄性发病率明显高于雌性,同时可伴随关节外表现诸如炎症性肠病、银屑病样皮损和趾甲病变等,这些系统受累与HLA-B27相关的人类疾病惊人的相似。Khare等[35]建立的β2微球蛋白缺陷的HLA-B27转基因小鼠也出现了脱毛、指甲病变、关节肿胀等症状,但这种表型似乎与小鼠的β2微球蛋白缺陷关系更密切,因为其他HLA-B27转基因小鼠并没有出现相似的病变,而在几个不同遗传背景和品系的HLA-B27转基因大鼠身上均可以观察到相应的病变[33]。
5.2β-葡聚糖诱导SKG小鼠模型 SKG小鼠携带突变的ZAP-70基因,减弱了T细胞受体信号转导并增加了外周T细胞的自身反应性,使其具有自身免疫倾向,在巨噬细胞的c型凝集素受体(Dectin 1)介导的真菌感染后,实验小鼠出现IL-17依赖的关节炎[36]。腹腔注射凝胶多糖(一种β-葡聚糖)后,所有实验小鼠均出现了踝关节和腕关节的进行性关节炎,雌性更为明显,40%~50%小鼠还出现了趾炎,同时实验小鼠中也观察到类似克罗恩病的回肠炎存在。组织病理学显示,炎症首先出现在跟腱的骨质附着处、足底筋膜及椎间盘周围,10周后所有实验小鼠都出现了肌腱端炎、足底筋膜炎、骶髂关节炎以及脊柱炎。虽然实验小鼠没有出现明显银屑病皮损,但组织学提示存在有表皮增厚和真皮炎症[37]。最近有研究者使用酵母多糖(主要成分为葡聚糖和甘露聚糖)诱导出类似的病理变化,并且皮肤损害更为明显,与咪喹莫特诱导的银屑病动物模型类似[36],证明此小鼠模型是研究PsA的可靠材料。
6 小结
在实际临床研究中很难建立具有PsA所有表型的动物模型,可能由于人和小鼠皮肤存在组织学差异、小鼠缺乏真正的附着点等。上述模型很好地模拟了人类PsA的部分疾病特点,尤其以DBA/1小鼠、JunB/c-Jun双基因敲除小鼠、K5.Stat3C:F759小鼠、IL-23过表达小鼠和甘露聚糖诱导的小鼠模型等更为符合。IL-23过表达小鼠从机制上和表型都与人类PsA极为相似,是开展相关研究很好的模型,但基因工程小鼠制备较为复杂,且成本较高,不能满足大样本的实验需求,也不利于各个层次的学者开展广泛的研究。DBA/1小鼠成本较低且造模过程简便,但其只在高龄小鼠中才会产生典型的病理变化,也限制了其在实验研究中的使用。相较之下,操作方便且成模较快的甘露聚糖诱导小鼠模型可能是一个更为合适的选择,但如何在普通小鼠中提高疾病外显率应该成为重要的研究方向。而且随着遗传学、免疫学领域的研究深入,相信将来一定会探索出揭示PsA发病机制和药物靶点的理想动物模型。
