特应性皮炎差异表达基因筛选及KLF15对AD小鼠血清中Th1/Th2型细胞因子水平的影响
2023-06-07唐情汪海珍汪碧滢易婷婷王力罗菲菲冉崇军罗美俊子严伊宁黄盼彭友华潘意周蓉
唐情,汪海珍,汪碧滢,易婷婷,王力,罗菲菲,冉崇军,罗美俊子,严伊宁,黄盼,彭友华,潘意,周蓉
特应性皮炎(atopic dermatitis, AD)是常见的慢性、炎症性皮肤病,患者常伴有皮肤干燥、剧烈瘙痒,还具有反复发病的特点[1]。全球约有15%~30%的儿童和2%~10%的成年患有AD,并受剧烈瘙痒带来的困扰,是全球的一大公共问题[2]。目前发现,AD发病可能与遗传、免疫异常、皮肤屏障功能异常有关,但具体病因尚未十分明确。AD治疗上以常规外用药为主,必要时口服药物或进行物理治疗,虽然可短暂缓解,但是有反复发病的风险[3]。近年来,随着对AD发病机制的深入了解,小分子靶向精准治疗及生物制剂也逐渐应用于临床,给中、重度患者的治疗带来希望。因此,本研究拟通过生物信息学分析相关基因芯片筛选AD差异表达基因,并进行功能分析及通路富集。筛选差异最为显著的基因验证使用度普利尤单抗或环孢素系统治疗后的表达变化,并进一步在动物水平验证该差异基因的表达水平及功能作用,以期为缓解AD疾病提供新的作用靶标。
1 材料与方法
1.1生物信息学分析
1.1.1筛选差异表达基因 在基因表达综合数据库(gene expression omnibus, GEO)下载AD相关基因芯片GSE157194(包含57例AD患者皮损组织样本、54例正常皮肤组织样本、21例使用度普利尤单抗及8例使用环孢素系统治疗后3个月的AD患者皮损组织样本。从GPL21290 Illumina HiSeq 3000 (Homo sapiens)获取注释信息,利用R语言包及limma工具包对相关数据芯片数据集进行分析,筛选出差异表达基因(differentially expressed gene, DEGs)(|log2FC|>1,P<0.05)。
1.1.2DEGs的GO功能富集和PPI分析 本研究通过Metascape在线分析工具(http://meta-scape.org)对筛选得到的DEGs进行基因本体论(gene ontology, GO)功能富集分析和京都基因与基因组百科全书(kyoto encyclopedia of genes and genomes, KEGG)通路富集分析,设置P<0.05。
1.2动物实验
1.2.1实验动物 6周龄无特定病原体(specific pathogen free, SPF)清洁级BALB/c雄性小鼠购自于湖南斯莱克景达公司,所有小鼠饲养温度为20~25 ℃,相对湿度为45%~60%,昼夜交替12 h,自由摄食、饮水,严格遵循国家动物饲养规则饲养1周进行实验。本研究经湖南中医药大学第二附属医院动物伦理委员会批准。
1.2.2实验材料 二硝基氯苯(2,4-dinitrochlorobenzene, DNCB)购自上海晅科生物科技有限公司;苏木精-伊红(hematoxylin-eosin, HE)染色试剂盒、多聚甲醛购自上海碧云天生物技术有限公司;基因组提取试剂盒、聚合酶链式反应(polymerase chain reaction, PCR)产物纯化试剂盒及反转录试剂盒购于上海联硕生物科技有限公司;放射免疫沉淀法缓冲液(radioimmunoprecipitation assay buffer, RIPA裂解液)、Bradford蛋白检测试剂盒购自上海源叶生物科技有限公司;酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)检测试剂盒购自上海酶联生物科技有限公司;Lipo-fectamine 2000转染试剂购自美国Invitrogen公司;腺病毒载体GV314、大肠杆菌菌株DH5α购自上海吉凯基因化学技术有限公司。
1.2.3小鼠分组及模型构建 将16只BALB/c小鼠随机分为对照组、模型组、OE-NC组、OE-Krüppel样因子15(Krüppel like factor 15, KLF15)组,每组4只。对照组小鼠不做任何处理,模型组小鼠耳部脱毛后使用2% DNCB及溶液(丙酮∶橄榄油3∶1)涂抹诱导造模,涂抹至21 d,前期1次/d,自第8天起,隔天1次。OE-NC组及OE-KLF15组分别在小鼠皮损处分多点均匀皮内注射空载质粒或KLF15过表达质粒,注射间距约为0.5 cm。
1.2.4HE染色 造模成功后,处死实验小鼠,取小鼠耳部皮损部位组织,在4%甲醛中固定24 h,生理盐水冲洗并在PBS溶液中浸泡。使用浓度梯度的酒精脱水并进行透明处理,包埋后制成石蜡切片,烤干后进行透明脱蜡,使用HE染色后封片。光学显微镜下观察各组小鼠的皮肤组织的病理学变化。光学显微镜下观察皮损内3个不重叠视野,并计数炎症细胞数量。
1.2.5qPCR 提取总RNA 使用紫外分光光度计检测OD260/OD280处的吸收峰并检测其浓度,将RNA反转录获得相应的cDNA,使用PCR仪扩增并分析相对应的mRNA。GAPDH为内参,以2-ΔΔCT法计算mRNA相对表达水平。
1.2.6Western blot 选取小鼠皮损组织切碎后放入相应AP管中,加入裂解液后置于冰上静置裂解。在匀浆机中进行匀浆后使用离心机离心,取上清液煮沸变性。使用BCA蛋白检测试剂盒测定总蛋白含量,将蛋白样品经SDS-PAGE电泳转移至过滤膜上,室温下使用5%脱脂奶粉TBST封闭并孵育2 h,添加相关抗体孵育至过夜,洗涤后再加入二抗,室温下孵育2 h。然后使用ECL底物观察检测蛋白质的表达水平,GAPDH作为内源性对照。
1.2.7ELISA 摘取小鼠眼球进行取血,并分离血清,使用ELISA试剂盒检测白细胞介素(interleukin, IL)-4、IL-13、IL-31和干扰素γ(interferon, IFN-γ)。实验操作严格按照试剂盒说明书进行。配制相应浓度梯度的标准液,与待测样品混匀后在37 ℃条件下加热,加入相关抗体稀释液后继续孵育。30 min后加入添加亲和素过氧化物酶复合物继续孵育。显色反应终止后,使用酶标仪测定450 nm波长的吸光度值,通过标准曲线的绘制计算相应的浓度。
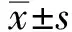
2 结果
2.1筛选AD皮损组织中的差异表达基因 基于GSE157194测序数据,分析比较AD患者皮损组织样本与正常皮肤组织样本之间的DEGs,获得74个下调的DEGs(|log2FC|<-1,P<0.05)及331个上调的DEGs(|log2FC|>1,P<0.05),见图1。

图1 AD皮损组织中的差异表达基因热图
2.2DEGs的GO功能富集分析 使用Metascape在线分析,对筛选到的331个上调DEGs及74个下调DEGs进行GO功能富集分析。GO分析结果显示,DEGs主要与细菌应答、炎症反应、Th2型免疫激活、皮肤发育、细胞离子代谢、调节类固醇代谢过程以及Wnt通路调控显著相关,见图2。

图2 DEGs的GO功能富集分析
2.3DEGs的KEGG富集分析 蛋白质互作网络的KEGG富集分析发现,DEGs主要富集在病毒蛋白与细胞因子和细胞因子受体的相互作用、趋化因子信号传导途径、Th1和Th2细胞的分化等过程,见图3。
2.4KLF15在GSE157194芯片中的表达水平 GSE157194芯片结果显示,与治疗前正常皮肤组织样本(AN)相比,皮损组织样本(AL)中KLF15表达显著下调(|log2FC|>1,P<0.05)。使用度普利尤单抗或环孢菌素治疗3个月后,AN与AL中KLF15表达水平差异无统计学意义(|log2FC|>1,P>0.05),见图4。
2.5KLF15在AD小鼠皮损组织中的表达水平 构建AD小鼠模型,HE染色观察小鼠皮肤病理变化并计数炎症细胞数量。qPCR及Western blot检测KLF15在小鼠皮损组织中的表达水平。结果显示,对照组小鼠表皮、真皮结构正常,无炎性细胞浸润。模型组小鼠出现棘层肥厚、真皮层水肿并伴有大量炎细胞浸润。与对照组小鼠比较,AD小鼠皮损组织中炎症细胞计数显著上调(t=16.01,P<0.01),KLF15 mRNA及蛋白水平显著下调(t=10.02、10.34,P<0.01),见图5。

Note: Compared with the control group, **P<0.01.
2.6KLF15对小鼠血清中Th1、Th2细胞相关因子的影响 构建KLF15过表达质粒,将KLF15过表达质粒注射至模型小鼠,通过qPCR及Western blot检测转染效率(t=34.74、24.26,P<0.01),见图6。并通过ELISA检测小鼠血清Th2相关因子IL-4、IL-13、IL-31和IFN-γ的表达水平。结果显示,与OE-NC组比较,OE-KLF15组小鼠的IL-4、IL-13和IL-31的表达水平显著下调(t=16.80、18.06、16.12,P<0.01),IFN-γ的表达水平显著上升(t=10.75,P<0.01),见图7。

Note: Compared with OE-NC group, **P<0.01.

Note: Compared with OE-NC group, **P<0.01.
3 结论
AD是影响儿童和成年人最常见的炎症性皮肤病之一,剧烈的瘙痒及皮疹严重影响患者生活质量及日常工作[4]。在治疗方面,轻度患者在临床常使用皮肤护理联合外用抗炎药物有较好的疗效,但针对重度及反复发作的AD患者的治疗,目前仍然是一个巨大的挑战[5]。随着精准医疗的快速发展,各种疾病的靶向分子及相关药物的研究在医学界广泛进行,针对AD相关治疗靶点的研究也逐步开展。
本研究首先基于AD相关基因芯片GSE157194筛选出DEGs,进一步经GO功能富集及KEGG富集分析发现,AD皮损组织DEGs主要与细菌应答、炎症反应、Th2型免疫等功能显著相关。在上述筛选出的DEGs中,KLF15与AD之间关联性的研究报道较少,但这一基因在皮损组织中显著下调,且使用度普利尤单抗或者环孢菌素等系统治疗3个月后,KLF15在AD皮损处与正常皮肤组织之间的表达水平差异无统计学意义,所以KLF15可能是AD的潜在治疗靶点,表达水平可能能够作为临床AD治疗效果的参考。KLF15具有抗纤维化作用,可有效抑制肝组织纤维化[6]及肾脏纤维化[7]等相关疾病的进展,但其在AD进展中发挥作用的具体机制尚未阐明。
众所周知,AD进展中的炎症反应是Th2型免疫功能亢进的常见后果[8],Th1/Th2在健康的机体内处于动态平衡,可进一步维持机体免疫系统的平衡状态[9]。Th1细胞主要分泌IFN-γ、TNF-β等炎症因子,介导细胞免疫;Th2细胞主要分泌IL-4、IL-13、IL-31等炎症因子,介导体液免疫,引起Ⅰ型超敏反应的发生[10]。IL-4、IL-13和IL-31炎症通路已被确定为AD发病机制的标志性特征,对免疫和屏障异常以及瘙痒等关键症状具有独特作用[11]。有研究[12]发现,SKP2通过抑制FOXO3/KLF15/LRP5轴增强卵清蛋白(ovalbumin,OVA)诱导的大鼠模型中的气道高反应性和炎症,增加了IL-4、IL-5、IL-13等Th2型炎症表达因子的水平。因此推测,KLF15可能通过促进Th1细胞功能,抑制Th2细胞功能在缓解AD中发挥作用。因此,本研究通过小鼠体内转染过表达KLF15,研究其对小鼠血清IL-4、IL-13、IL-31及IFN-γ的影响,以证实KLF15对Th1/Th2轴的调控作用。本研究结果显示,过表达KLF15可有效下调小鼠血清中Th2相关炎症因子IL-4、IL-13和IL-31的表达水平,上调Th1相关炎症因子IFN-γ的表达水平。
综上所述,生物信息学分析显示KLF15在AD患者皮损部位显著下调,且使用度普利尤单抗或者环孢菌素等系统治疗3个月后,KLF15表达水平有所上调。动物实验中实现KLF15过表达,可调控小鼠血清中Th1/Th2平衡,缓解AD小鼠的疾病进展,为治疗AD提供潜在的作用靶点。
