MIR1基因影响白念珠菌对唑类药物的敏感性
2023-06-07邢信昊王欣荣陈莉仲华韩蕾王彦海军军医大学药学系上海00433福建中医药大学药学院福州350军事药学国家级实验教学示范中心上海00433
邢信昊,王欣荣,陈莉,仲华,韩蕾,王彦,3*(. 海军军医大学药学系,上海 00433;. 福建中医药大学药学院,福州 350;3. 军事药学国家级实验教学示范中心,上海 00433)
白念珠菌是最常见的病原真菌之一,可引起皮肤感染、黏膜感染甚至危及生命的系统性感染。对脓毒症、器官移植、恶性肿瘤等免疫功能低下的患者来说,白念珠菌引起的系统性感染尤为凶险,据统计,念珠菌血症患者的归因死亡率高达10%至47%[1-2]。
唑类药物是现今临床上常用的抗真菌药物,然而其耐药性问题日益凸显,严重困扰了抗真菌治疗的有效实施。目前临床上多采用优化剂量和多药联合疗法应对耐药性问题,但存在毒性大、效率低、价格高等缺点[3]。研究白念珠菌的药物敏感性相关基因,开发抗真菌新药并解决耐药性问题具有重要的临床意义。
真菌耐药的机制包括药物外排功能增强、药物摄入减少、生物被膜形成、靶蛋白动态变化以及药物代谢相关通路改变等,而白念珠菌对唑类药物耐药的最主要机制是药物外排能力的增强,尤其是能量依赖的药物外排[3-5]。线粒体是能量代谢的核心细胞器,众多研究表明,线粒体功能影响白念珠菌的药物敏感性。例如,白念珠菌氧化磷酸化解偶联突变体对氟康唑和伏立康唑的敏感性显著降低[6],线粒体复合体Ⅰ活性必需基因GOA1或其亚基编码基因NDH51的缺失都会使白念珠菌对唑类药物的敏感性显著提高[7],线粒体生物发生必需基因FZO1缺失使唑类药物耐受性显著降低[8]。可见,线粒体能量代谢是白念珠菌对唑类药物的敏感性的关键影响因素。
前期有研究报道,小分子化合物ML316通过选择性抑制线粒体磷酸盐转运蛋白Mir1发挥抗真菌作用,并在酿酒酵母中研究了其可能的机制[9]。我们推测,线粒体磷酸盐转运蛋白可能影响线粒体有氧呼吸进而影响能量代谢,成为新的白念珠菌抗真菌药物靶点。然而,其编码基因MIR1在白念珠菌药物敏感性中的作用还缺乏系统研究。课题组前期研究了白念珠菌MIR1基因的功能,然而是基于传统的营养标记型敲除筛选策略[10],对表型研究有一定干扰[11-12]。本研究聚焦MIR1基因对白念珠菌对唑类药物敏感性的影响,利用SAT1 flipper法对白念珠菌标准株进行敲除和重组,并探索MIR1基因在其中的作用机制。
1 材料
野生型白念珠菌SC5314(wild-typeCandida albicans,WT,由美国乔治敦大学William A Fonzi教授馈赠);SanPrep柱式质粒抽提试剂盒(上海生工生物),SacⅠ内切酶、XhoⅠ内切酶、ApaⅠ内切酶、SacⅡ内切酶(New England Biolabs),酵母转化试剂盒、诺尔斯菌素(上海懋康生物),Ex Taq DNA聚合酶(TaKaRa),罗丹明6G(Sigma-Aldrich),JC-1膜电位检测试剂盒(上海碧云天生物),ATP检测试剂盒BacTiter-Glo Microbial Cell Viability Assay(Promega),三磷酸腺苷(ATP)溶液(北京索莱宝);蛋白胨、酵母浸膏、营养肉汤(美国BD公司);糖类、抗菌药物、缓冲液、培养基、引物、DNA Marker等其他基础试剂购自上海生工生物。
2 方法
2.1 菌株培养
挑取冻存菌株,在YPD液体培养基中活化,30℃、200 r·min-1振荡培养24 h后,吸取10 μL于新的1 mL YPD液体培养基中,相同条件下继续培养16 h。取该菌液后接种于沙氏葡萄糖琼脂(SDA)培养基,30℃培养静置培养48 h。实验时挑取单克隆菌落置于YPD液体培养基中,振荡培养16 h至对数生长期用于实验。
2.2 MIR敲除菌(mir1Δ/Δ)和回复菌(mir1Δ/MIR1)的构建与鉴定
用引物MIR1-up-FWD和MIR1-up-RV扩增MIR1基因5'-端的一个0.661 kb片段,经ApaⅠ和XhoⅠ双酶切后,克隆到pSFS2载体中MAL2p-CaFLP-CaSAT1盒的上游,得到质粒pSFS2-MIR1up;同理,用引物MIR1-down-FWD和MIR1-down-RV扩增MIR1基因3'-端的一个0.504 kb片段,经SacⅡ和SacⅠ双酶切后,克隆到pSFS2载体中MAL2p-CaFLP-CaSAT1盒的下游,得到质粒pSFS2-MIR1updwn。用ApaⅠ和SacⅠ两种限制性内切酶对其进行双酶切,酶切后的片段用醋酸锂法转化进白念珠菌SC5314,然后此片段会以同源重组的方式替换掉目的基因的一个等位基因。使用多个引物通过菌落PCR鉴定出对诺尔丝菌素表现出抗性的转化子,将正确的转化子删除诺尔丝菌素抗性标记CaSAT1后即可得到目的基因的单等位基因敲除菌。经过两次重组和删除,即可得到双等位基因敲除菌mir1Δ/Δ。
为了将MIR1基因重新整合到mir1Δ/Δ中,用引物MIR1-FWD和MIR1-RV扩增一个2.30 kb的片段,其中包含完整的开放阅读框,以及MIR1等位基因上游0.661 kb和下游0.504 kb的序列,用ApaⅠ和XhoⅠ双酶切。以该酶切片段替换pSFS2-MIR1updwn中MIR1基因序列的5'-端,生成质粒pSFS2-MIR1Rec。pSFS2-MIR1Rec质粒用ApaⅠ和SacⅠ酶切,用该酶切片段转化mir1Δ/Δ。由此获得了具有诺尔斯菌素抗性的菌株,再经删除诺尔丝菌素抗性标记CaSAT1后,即得回复菌mir1Δ/MIR1,以供进一步研究。菌株构建和鉴定所用引物如表1所示,PCR鉴定的引物设计原理如图1所示,预测结果如表2所示。
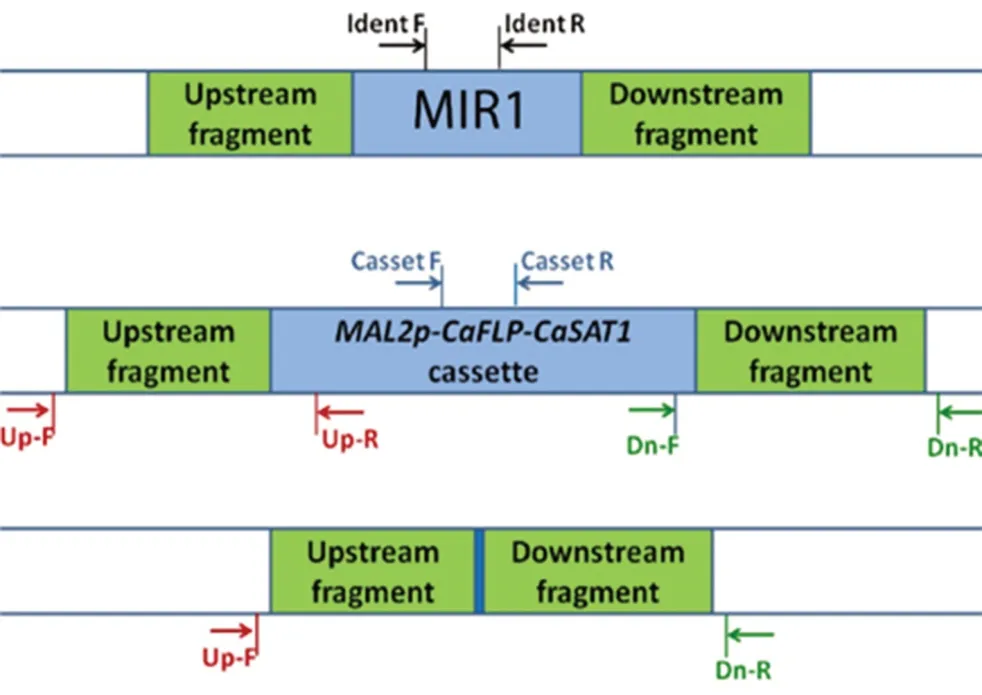
图1 用于PCR鉴定的引物设计示意图Fig 1 Schematic diagram of primer design in PCR identification
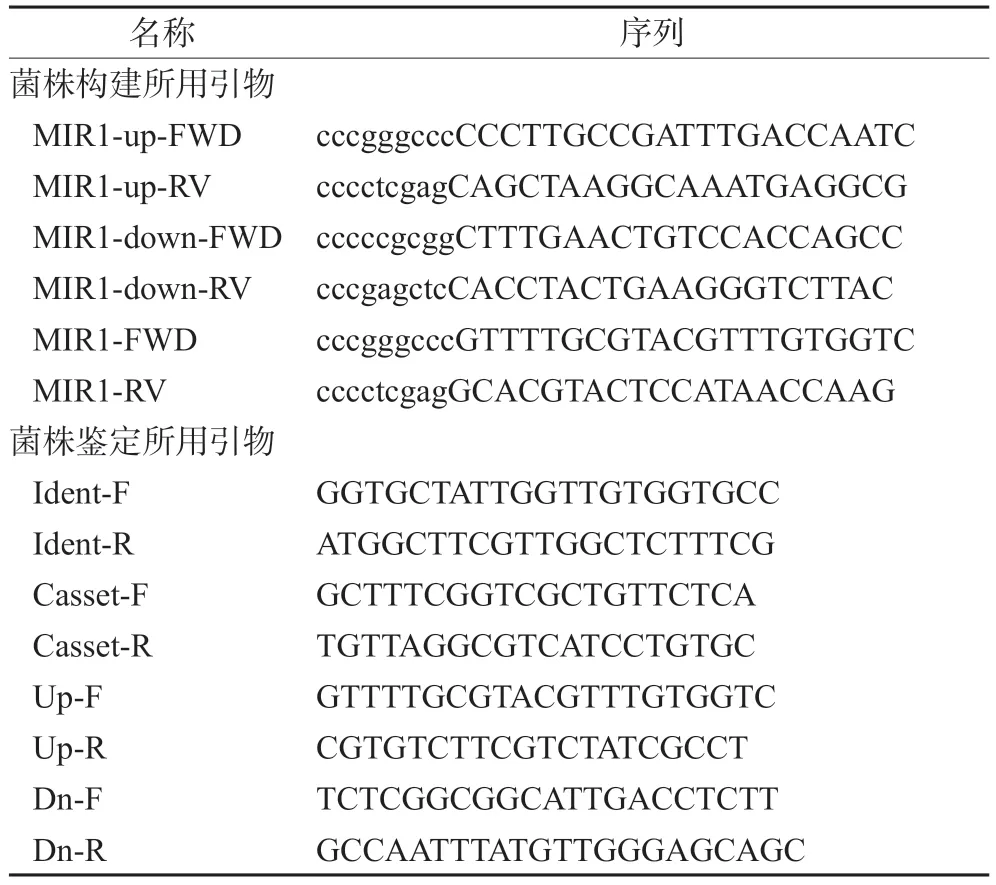
表1 菌株构建和鉴定所用引物Tab 1 Primers for strain construction and identification
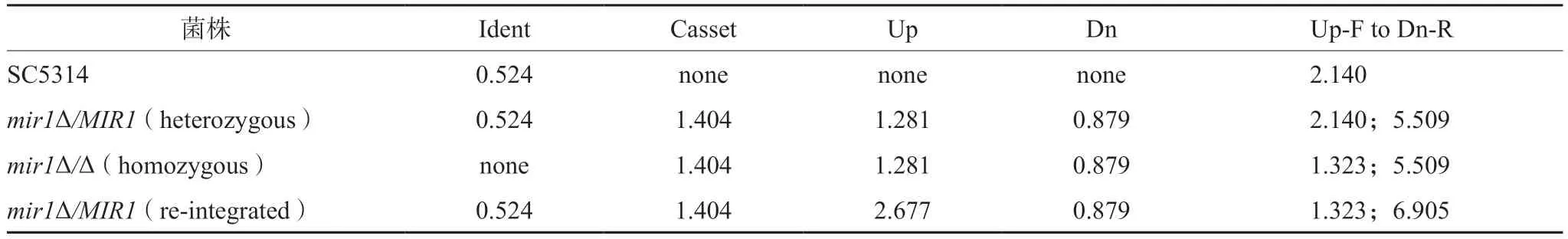
表2 所构建菌株的PCR鉴定预测结果(kb)Tab 2 Predicted results of PCR identification of the constructed strains (kb)
2.3 斑点法(spot assay)检测药物敏感性
取活化的野生型白念珠菌,敲除菌mir1Δ/Δ,回复菌mir1Δ/MIR1,用PBS洗涤后,调整野生型和回复菌菌液浓度为2×106个·mL-1,再倍比稀释为2×105、2×104、2×103、2×102个·mL-1,敲除菌浓度分别为野生型的2倍。各浓度菌液分别取5 μL点于含不同抗真菌药物[氟康唑(Fluconazole)、酮康唑(Ketoconazole)、伊曲康唑(Itraconazole)、咪康唑(Miconazole)和伏立康唑(Voriconazole)等5种唑类药物,以及布雷非德菌素A(Brefeldin A)、特比萘芬(Terbinafine)、卡泊芬净(Caspofungin)、氟胞嘧啶(Flucytosine)和两性霉素(Amphotericin)等其他药物]的YPD平板上,自然晾干。于30℃静置培养48 h,观察并拍照。
结果显示,在YPD培养平板以及含有特比萘芬、卡泊芬净、氟胞嘧啶和两性霉素的培养平板上,mir1Δ/Δ敲除菌的菌落生长情况与野生型或回复菌没有显著差异;而在含有5种唑类药物和布雷非德菌素A的平板上,与野生型或回复菌相比,mir1Δ/Δ敲除菌的菌落生长明显较少(见图2)。该结果表明,MIR1基因敲除使白念珠菌对唑类药物的敏感性显著提高。

图2 MIR1敲除菌、回复菌与野生型白念珠菌对抗真菌药物的敏感性Fig 2 Sensitivity of MIR1 knockout,revertant and wild-type Candida albicans to antifungal drugs
2.4 药物外排能力检测
将上述菌株在YPD中振荡培养16 h,PBS洗涤后,调整菌液浓度5×107个·mL-1。用PBS重悬细胞并振荡培养2 h,耗竭能量。加入罗丹明使其终浓度为10 μmol·L-1,30℃、200 r·min-1振荡培养60 min。菌液离心,PBS洗涤后,计数并调整菌液浓度为5×107个·mL-1。加入葡萄糖使其终浓度为20 mmol·L-1,提供供能底物,取1 mL在30℃下、200 r·min-1振荡培养2 h。3000 r·min-1离心菌液5 min,取100 μL上清液,检测527 nm处的OD值。
结果显示,在30℃培养环境下,与野生型相比,mir1Δ/Δ敲除菌泵出的罗丹明6G显著较低(P<0.05,见图3)。该结果表明,MIR1基因敲除使白念珠菌的药物外排能力缺陷。
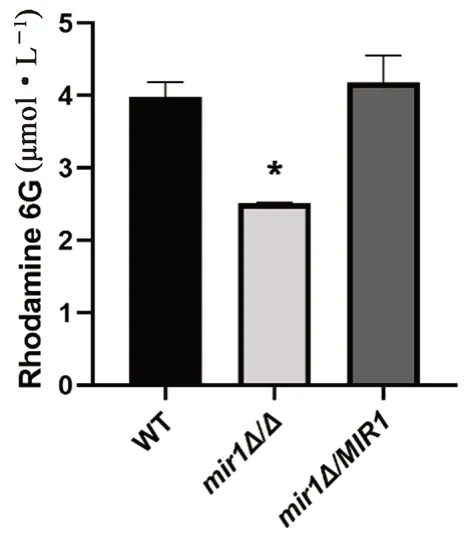
图3 MIR1敲除菌、回复菌与野生型白念珠菌对罗丹明6G的外排能力Fig 3 Efflux of Rhodamine 6G by MIR1 knockout,revertant and wildtype Candida albicans
2.5 线粒体膜电位检测
活化的菌株经200 r·min-1振荡培养16 h,收集细胞,经PBS洗涤后,使用YPD培养基重悬细胞,在30℃下振荡培养30 min。收集细胞并洗涤,然后用PBS调节菌液浓度至5×106个·mL-1。将0.5 mL菌液与等体积的JC-1染色工作液混合,阳性对照组使用线粒体电子传递链抑制剂CCCP(终浓度为10 μmol·L-1),37℃避光孵育20 min。使用JC-1染色缓冲液洗涤3次,重悬至100 μL。使用多功能酶标仪在490 nm激发波长下,检测并计算红色/绿色荧光强度比(590 nm/530 nm)。
结果显示,与野生型相比,mir1Δ/Δ敲除菌的红绿荧光强度之比有降低趋势(见图4A),表明MIR1基因敲除使白念珠菌的线粒体膜电位有降低趋势。
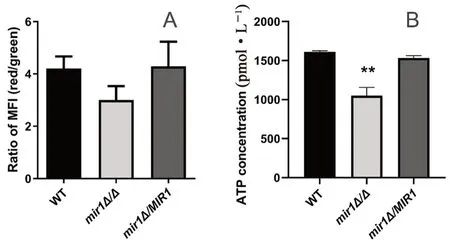
图4 MIR1敲除菌、回复菌与野生型白念珠菌的线粒体膜电位(A)和ATP生成能力(B)Fig 4 Mitochondrial membrane potential(A)and ATP production(B)in MIR1 knockout,revertant and wild-type Candida albicans
2.6 ATP生成检测
活化的菌株经200 r·min-1振荡培养16 h,收集细胞,经PBS洗涤后,用YPD培养基调整菌液浓度至1×106个·mL-1,在30℃下振荡培养30 min。取50 μL菌液与等体积BacTiter-Glo Reagent,在96孔板中混匀,孵育10 min后,使用多功能酶标仪测定荧光信号强度。按说明书制备ATP标准曲线,根据标准曲线计算ATP含量。
结果显示,mir1Δ/Δ敲除菌与野生型相比ATP浓度显著降低(P<0.01,见图4B),表明MIR1基因敲除使白念珠菌的ATP生成能力缺陷。
3 讨论
本项研究发现MIR1基因的缺失显著提高了白念珠菌的唑类药物敏感性,而对特比萘芬、卡泊芬净、氟胞嘧啶和两性霉素等其他抗真菌药物的敏感性没有显著改变,表现出一定的特异性。通过罗丹明6G外排实验发现MIR1敲除使白念珠菌对唑类药物敏感性的提高可能与药物外排能力缺陷有关,MIR1敲除引起的线粒体膜电位降低和ATP生成能力缺陷可能是其作用机制。
与其他抗真菌药物耐药机制不同,ABC转运蛋白依赖的药物外排作用是白念珠菌对唑类药物耐药性的主要机制,特异性阻断ABC转运蛋白是逆转唑类药物耐药性的一种可行手段,小分子抑制剂FK506、普罗帕酮以及米尔贝霉素等均可以提高对唑类药物的敏感性[13-14]。由于ABC转运蛋白功能的发挥依赖于ATP,因此线粒体ATP生成障碍会抑制其转运功能,进而提高白念珠菌对唑类药物敏感性。例如,白念珠菌线粒体复合物Ⅰ、Ⅲ和Ⅴ的功能变化,可能会改变线粒体有氧呼吸及ATP生成,影响药物外排活性,从而改变对唑类药物的敏感性[7,15]。琥珀酸脱氢酶编码基因SDH2缺失也会导致白念珠菌药物外排能力下降,唑类药物敏感性提高[16]。可见,线粒体相关基因是研究白念珠菌唑类耐药性机制及其逆转手段的重要方向。
MIR1基因编码线粒体磷酸盐转运蛋白,其缺失会导致向线粒体基质的磷酸盐转运障碍[17]。在线粒体基质中,二磷酸腺苷(ADP)和无机磷酸盐在ATP合酶的催化下生成ATP,无机磷酸盐的转运障碍会引起ATP合成受阻[9],这可能是本研究中MIR1敲除提高白念珠菌对唑类药物敏感性的主要机制。此外,线粒体功能障碍也可能通过减少药物外排泵表达或提高活性氧(ROS)累积来提高抗真菌药物敏感性,未来值得通过实验进一步探索。
课题组前期在白念珠菌MIR1基因功能的研究中,考察了MIR1基因和白念珠菌耐药性的相关性[10],但是存在缺陷:在构建MIR1基因敲除菌时采用了营养缺陷型标记筛选策略,亲本菌是URA3基因缺陷的白念珠菌CAI4株,不能在缺乏尿苷或尿嘧啶的培养基上生长,这种代谢相关基因的缺陷会对白念珠菌的表型产生影响,继而对表型研究造成干扰[11]。在本研究中,我们以SC5314标准株为亲本菌,采用了更加先进的SAT1 flipper技术进行敲除菌的构建,得到了更加可信的结果和结论。
综上所述,本研究发现MIR1基因缺失会导致白念珠菌对唑类药物敏感性提高;MIR1基因缺失后,白念珠菌的药物外排能力缺陷,可能是MIR1敲除对线粒体膜电位降低和ATP生成能力缺陷所导致的。可见,MIR1基因对白念珠菌的能量供应和药物敏感性至关重要,Mir1蛋白特异性抑制剂有望开发为与唑类药物协同的新型抗真菌药物,以MIR1为靶点开发抗真菌药物可能具有较好的应用前景。
