甘草次酸衍生物配体18-GA-Ala介导脂质体的制备及肝靶向性研究△
2023-06-06金粟顾蘅董人华王秀丽李耿曲舒显
金粟,顾蘅,董人华,王秀丽*,李耿,曲舒显
1.北京中医药大学,北京 100102;
2.昆明市中医医院 中药房,云南 昆明 650011;
3.中国医学科学院 北京协和医学院 药用植物研究所,北京 100193
肝纤维化是指在各种因素的影响下,肝脏持续受损,肝星状细胞(HSC)被诱导激活转变为肌成纤维细胞,进而过量分泌细胞外基质,最终导致肝脏纤维化的过程。肝纤维化是各种慢性肝病向肝硬化及肝癌发展的关键环节,因此早期干预并逆转肝纤维化对阻止肝病的进一步发展非常重要。目前,西医尚无疗效确切的抗肝纤维化药物,而一些单味中药、中药单体或复方可作用于肝纤维化发病机制中的多个环节,发挥综合的抑制作用,显著阻止或逆转肝纤维化的进展[1]。
丹参为药用植物丹参Salvia miltiorrhizaBge.的干燥根及根茎,归心、肝经,性微寒,味苦,具活血通络、清心除烦、凉血消痈等功效,临床上常用于心血管系统疾病、神经系统疾病、肝纤维化及肿瘤等疾病的治疗。在丹参的诸多化学成分中,丹参酮ⅡA(TSN)为最主要的脂溶性成分,丹酚酸B(Sal B)为最主要的水溶性成分,两者的含量最高,活性也最强。TSN 可通过靶向Smad6/7 蛋白、HSC及内源性干细胞,Sal B 可通过靶向凋亡蛋白胱天蛋白酶9(Cleaved Caspase-9)、转化生长因子(TGF)-β1及转录因子MEF2 等来阻止肝纤维化的发生和发展,两者已被证实具有确切的抗肝纤维化疗效[2-3]。但TSN 在水中的溶解性较差,Sal B 性质不稳定且入血后易降解,两者生物利用度均不高[4]。
脂质体与肝脏亲和性高,静脉给药后可被动靶向网状内皮系统最发达的肝脏,同时脂质体无毒、无免疫原性、可生物降解,生物相容性好。并且脂质体具有结构封闭、可保护药物、提高药物稳定性、有效控制药物释放、降低药物不良反应、提高药物生物利用度等诸多优点,被广泛用于靶向给药系统及肝病的治疗[4-8]。另外,肝实质细胞表面存在大量特异性甘草次酸结合位点,含有甘草次酸或甘草次酸衍生物的药物载体在体内具有明显的主动肝靶向作用[9-14]。
因此,本研究将以甘草次酸为基本母核,合成亲水性增强的肝靶向配体丙氨酸丁二酸甘草次酸十八烷酯(18-GA-Ala)。将模型药物的Sal B 和TSN包埋在脂质体后,研究其在小鼠体内的药动学及组织分布情况,评价配体18-GA-Ala 修饰对脂质体的肝靶向作用,以期获得主动与被动相结合的肝靶向制剂,将药物有效浓集于肝脏,提高药物治疗指数,降低药品不良反应,提高药物生物利用度,为治疗肝纤维化等肝组织靶向药物的开发提供参考。
1 材料
1.1 仪器
ACQUITY I-Class 型超高效液相色谱仪(美国Waters公司);BSl10S型万分之一电子分析天平(北京赛多利斯仪器系统有限公司);RW-2000A 型旋转蒸发器(上海亚荣生化仪器厂);SCIENTZ-ⅡD 型超声波细胞粉碎机、S10 型高速匀浆机均购于浙江新芝有限公司;Zetasize Nano ZS 型纳米粒度仪(英国Malvern 公司);JEM-1230 型透射电镜(日本JEOL 公司);G16 型医用高速离心机(白洋离心机厂);Ultracel YM-100 型超滤管(美国Millipore 公司);Barnstead GenPure Pro 型超纯水系统(美国Thermo Fisher 公司);Qilinbeier®VORTEX-5 型涡旋混合仪(北京东南仪诚实验室设备有限公司);TTL-DC 型多功能氮吹仪(北京同泰联科技发展有限公司);KQ5200DE 型数控超声仪(昆山市超声仪器有限公司)。
1.2 试药
对照品Sal B(批号:10113-081107,纯度>98%)、TSN(批号:110766-200417,纯度>98%)均购于中国食品药品检定研究院;配体18-GA-Ala[自合成,甘草次酸(GA,宝鸡国康生物科技有限公司,批号:111215,纯度>98%)、丁二酸酐(国药集团化学试剂有限公司,批号:F20101208)、丙氨酸(中国食品药品检定研究院,批号:140680-201604)、硬脂酸(天津市光复精细化工研究所,批号:20200923)];大豆磷脂(德国Lipoid公司,批号:01/2015,纯度>94%);胆固醇(美国Amresco公司,批号:0433,超纯级);娃哈哈纯净水;甲醇和乙腈为色谱纯;其余试剂均为分析纯。
1.3 动物
无特定病原体(SPF)级昆明种小鼠100 只,雄性,5周龄,体质量(20±2)g,购于北京斯倍福实验动物科技有限公司,合格证号:SCXK京2016-0002,动物伦理批准号:BUCM-4-2016011003-1003。
2 方法
2.1 18-GA-Ala的合成工艺
甘草次酸与硬脂醇经酯化反应生成甘草次酸十八醇酯(18-GA);18-GA 与丁二酸酐酰化反应后,合成丁二酸甘草次酸十八烷酯(18-GA-Suc);18-GA-Suc 与丙氨酸反应得到18-GA-Ala(分子式:C55H91NO8,相对分子质量:893.67)。18-GA-Ala 的结构式和工艺见图1。

图1 18-GA-Ala的结构式及合成工艺
2.2 脂质体的制备
称量TSN、配体18-GA-Ala、磷脂(SPC)和胆固醇(CH,SPC 与CH 的质量比为6∶1,SPC 与TSN 的质量比为30∶1),超声共溶于无水乙醇中。在30 ℃条件下,真空蒸发去除有机溶剂,于圆底烧瓶内壁形成均匀薄膜。随后使用超声波仪,用少量去离子水水合脂质膜,分离瓶壁的脂质体。经过380 W探头超声匀化后,用高速匀浆机进行均质处理,随后逐滴加入Sal B的甘氨酸-盐酸缓冲溶液(pH=3.32),充分混合后,30 ℃条件下水浴30 min。最终获得含有配体18-GA-Ala 的复方脂质体18-GA-Ala 修饰的TSN-Sal B(Ala-TS-lip)。
TSN-Sal B 脂质体(TS-lip)的制备方法与Ala-TS-lip的制备方法类似,但未添加配体18-GA-Ala。
2.3 脂质体的表征
2.3.1 脂质体的粒径分布、电位测定及形态观察25 ℃条件下,采用Zetasize Nano ZS 型纳米粒度仪测量脂质体的粒径、多分散系数(PDI)和电位:吸取待测定脂质体混悬液80 μL 于离心管中,超纯水稀释100 倍,混合均匀。使用氦激光作为光源收集动态光散射数据,并通过光子相关光谱提供平均结果。
通过透射电子显微镜检测Ala-TS-lip的形态:将样品稀释25倍后,滴于铜网表面,静置15 min,滤纸吸干多余水分,采用2%的磷钨酸负染色3 min,观察并拍照。
2.3.2 包封率及载药量测定 为了测定包封率,使用适当体积的甲醇破坏分散脂质体,通过超高效液相色谱法(UPLC)测定18-GA-Ala、TSN和Sal-B的总药物含量;将脂质体于2000 r·min–1离心(离心半径为8.6 cm)5 min,取上清液并用甲醇分散,分别检测TSN和18-GA-Ala的含量,记录为TSN的质量(WTSN)和W18-GA-Ala;将脂质体在15 000 r·min–1下离心(离心半径为8.6 cm)30 min,取上清液400 μL 置超滤管中在6000 r·min–1下离心(离心半径为8.6 cm)30 min,提取超滤液100 μL与甲醇100 μL超声混合,测定Sal B的含量,并记录为WSalB。按公式(1)~公式(3)计算药物包封率(EE)[15-16]。
2.4 药动学和组织分布研究
2.4.1 给药和取样 将100 只小鼠随机分为TS-lip组和Ala-TS-lip 组,每组50 只小鼠,共分为10 个时间点,1个时间点5只。给药前小鼠禁食12 h,自由饮水。一组通过尾静脉注射给予Ala-TS-lip 脂质体(0.25 mL/只),折合小鼠体质量Sal B、TSN 给药剂量分别为48.25、4.88 mg·kg–1;而另一组以相同剂量和相同方式给予TS-lip 脂质体。于给药后5、10、20、30、45 min 和1.0、1.5、2.0、4.0、6.0 h 摘眼球取血,收集心、肺、肝、脾、肾组织,用0.9%氯化钠溶液洗净所有组织样本表面的血液,滤纸吸干,于–20 ℃下储存。
2.4.2 组织样本处理 自然解冻组织样本,剪碎,加入1.5 倍的0.9%氯化钠溶液后,制备组织匀浆。分别将小鼠心、肺和脾组织全量及肝、肾组织匀浆液500 μL移取至离心管中,向组织匀浆中加入甲酸-水(1∶3)混合溶液(肝、肾:70 μL,脾、肺、心脏:50 μL),并精密加入氯霉素(作为内标物)10 μL。向提取物中加入乙酸乙酯1 mL,涡旋3 min,并在15 000 r· min–1下离心(离心半径为8.6 cm)10 min,沉淀蛋白质。将上清液移取至另一个离心管中,残留物与乙酸乙酯1 mL混合,再次如上所述涡旋离心提取药物。将2次提取的上清液合并后,采用氮气在37 ℃的水浴条件下吹干溶剂。用甲醇100 μL重新溶解残留物,涡旋1 min 后15 000 r·min–1离心(离心半径为8.6 cm)10 min。取样品1 μL,采用UPLC进行分析。
2.4.3 UPLC 分析 色谱分析条件:ACQUITY UPLC BEH C18色谱柱(50 mm×2.1 mm,1.7 μm);流动相为乙腈(A)-0.5%甲酸溶液(B)梯度洗脱(0~1.5 min,20%~25%A;1.5~3.0 min,25%~64%A;3.0~5.1 min,64%A;5.1~5.8 min,64%~90%A;5.8~6.0 min,90%~20%A);流速:0.4 mL·min–1;柱温:30 ℃;二极管阵列检测器(PDA)监测,检测波长:Sal B为289 nm,TSN为265 nm;进样量:1 μL。
2.4.4 数据分析 采用 DAS 3.2 软件,按非房室模型计算Sal B和TSN的组织分布含量;绘制血药浓度-时间曲线,采用SAS 8.1 分析统计数据,采用t检验两两比较分析,多组间采用One-way ANOVA方差分析法比较分析;绘制各组组织的药物浓度-时间柱形图,比较脂质体在小鼠体内的靶向作用。计算相对摄取率(RE)、最大峰浓度之比(CE)和靶向效率(TE),评价靶向性。
3 结果
3.1 脂质体的表征
由图2 可知,脂质体形状为均匀圆形,粒径为150~200 nm。表1 显示了TS-lip 和Ala-TS-lip 的包封率、粒径、电位、PDI和结合率。
表1 TS-lip和Ala-TS-lip的理化性质(,n=5)

表1 TS-lip和Ala-TS-lip的理化性质(,n=5)
注:—表示该项未检测。
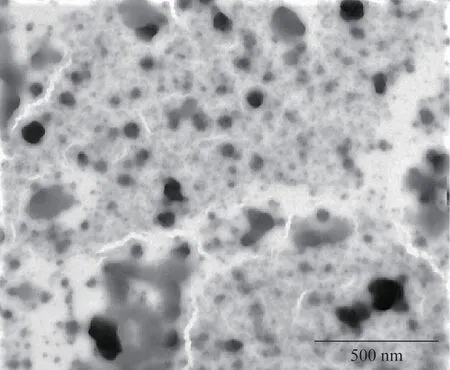
图2 Ala-TS-lip透射电镜图(×25 000)
3.2 UPLC检测结果
如图3 所示,主要峰成分被完全分离,故可通过光谱图进行鉴别和分析。
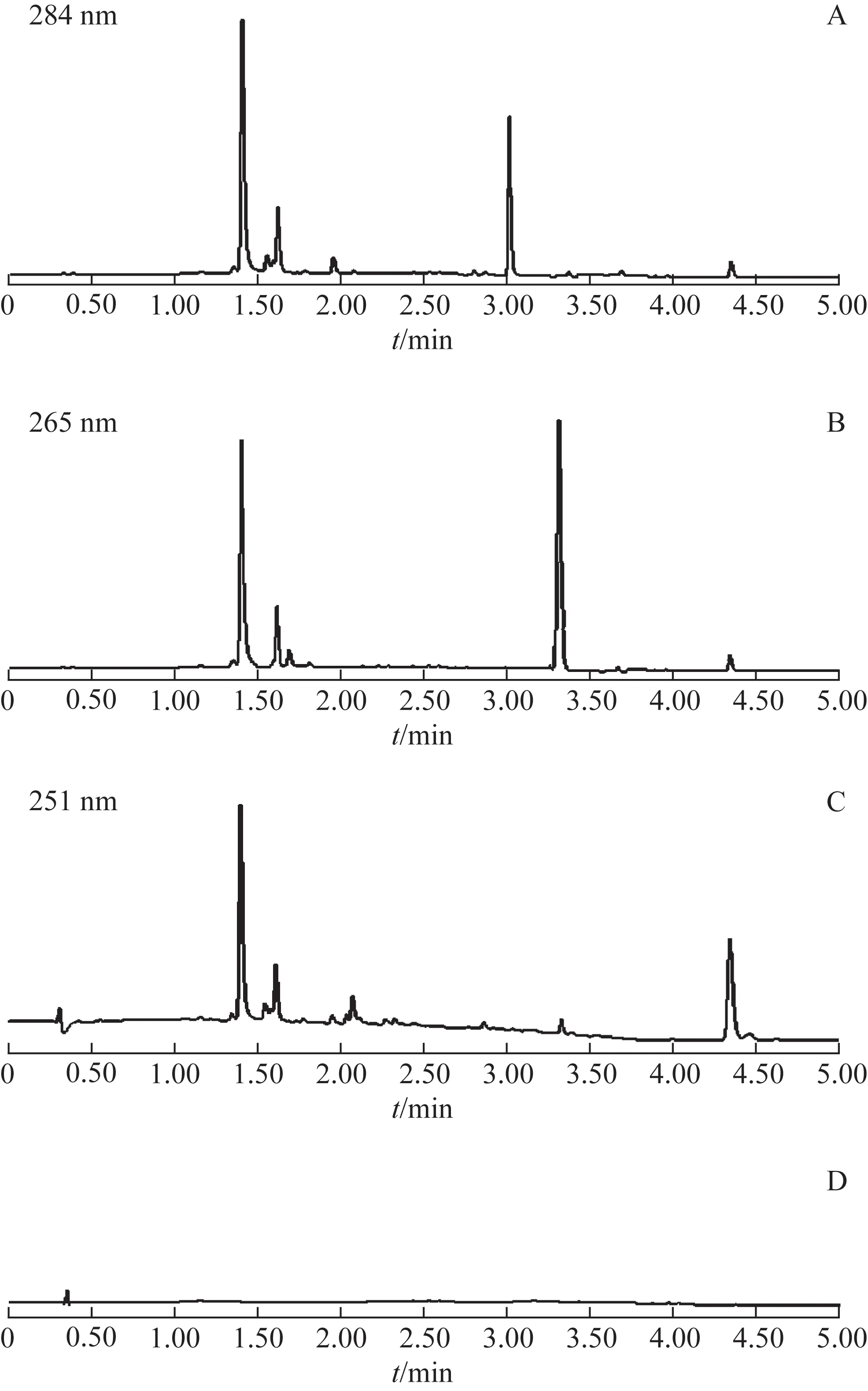
图3 Sal B、TSN和18-GA-Ala的UPLC图
3.3 器官中药物的标准曲线
根据相关研究[4-6],各器官中Sal B和TSN的标准曲线见表2、表3。
表2 小鼠组织中Sal B的标准曲线

表3 小鼠组织中TSN的标准曲线
3.4 组织分布
给药后,不同时间点Sal B 和TSN 在2 组小鼠器官中的分布情况见图4、图5。
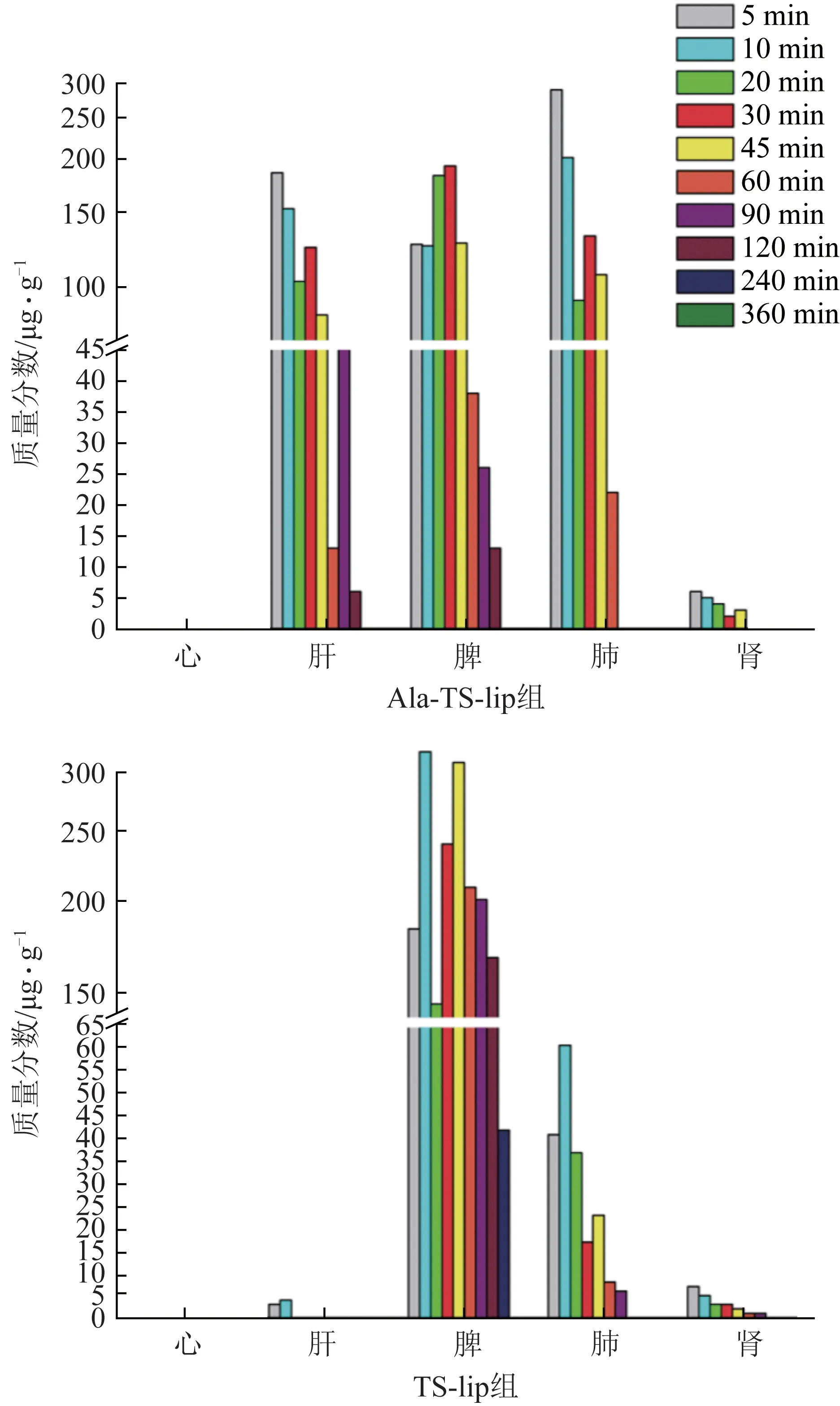
图4 静脉注射Ala-TS-lip和TS-lip后不同时间点Sal B在小鼠器官中的分布
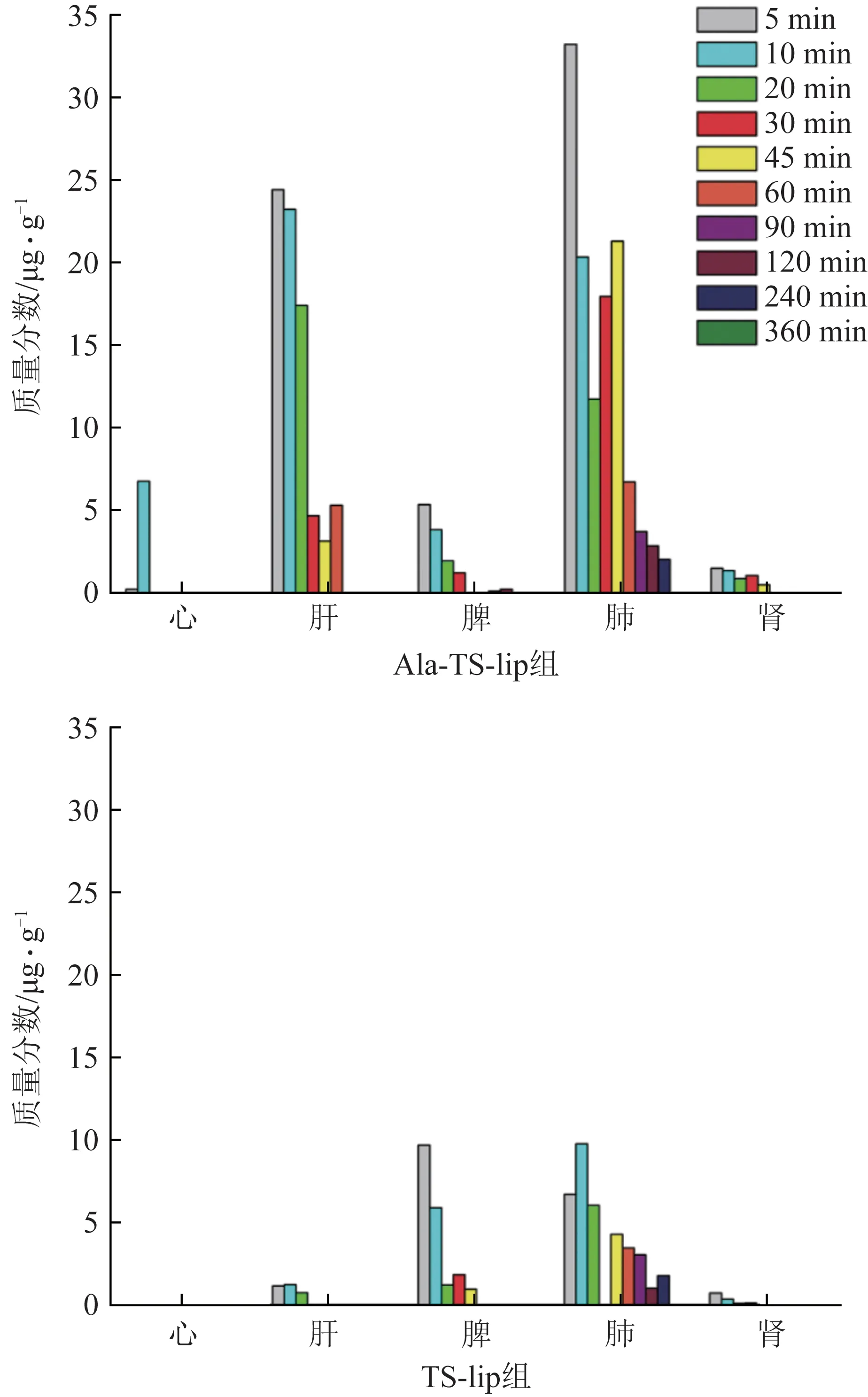
图5 静脉注射Ala-TS-lip和TS-lip后不同时间点TSN在小鼠器官中的分布
如图4 所示,与TS-lip 组相比,给予Ala-TS-lip时,肝脏中Sal B的浓度明显升高,说明肝细胞靶向配体18-GA-Ala 可以将包埋的亲水性药物Sal B 带入肝脏。此外,在2 组小鼠的脾、肺中均检测到丰富的Sal B,这可能和脂质体的被动靶向性相关。
从图5 可以看出,Ala-TS-lip 组与TS-lip 组的TSN 在肝脏中的积累差异有统计学意义,前者的TSN 浓度较高。在给药60 min 后Ala-TS-lip 组可检测到TSN,而TS-lip 组给药30 min 后检测不到TSN。结果表明,配体可以将亲脂性药物TSN 靶向到肝脏,并能提高TSN的稳定性。
3.5 TS-lip和Ala-TS-lip对肝脏靶向性的评价
按公式(4)~公式(6)计算RE、CE 和TE,可评价TS-lip 和Ala-TS-lip 对肝脏的靶向能力[17],结果见表4、表5。
表4 Ala-TS-lip和TS-lip在肝脏中的AUC和Cmax的比较(,n=5)

表4 Ala-TS-lip和TS-lip在肝脏中的AUC和Cmax的比较(,n=5)
注:与TS-lip组比较,**P<0.01。

表5 Ala-TS-lip在肝脏与其他组织的TE的比较(n=5)
式中Cmax为最大峰浓度,AUC 为药时曲线下面积。
由表4可知,比较2组小鼠肝组织中Sal B和TSN的RE,水溶性成分Sal B 在Ala-TS-lip 组和TS-lip 组的肝脏中均无相对增加,差异无统计学意义。而Ala-TS-lip 组肝组织中的TSN 是TS-lip 组的25.25 倍,表明配体18-GA-Ala 修饰后可增强TSN 对肝的靶向,实现对肝组织的靶向作用。Sal B和TSN 对肝靶向的差异推测可能是脂溶性TSN 与磷脂双分子层的连接比水溶性Sal B 更紧密,从而实现肝组织的靶向能力。
2 组小鼠肝组织中Sal B 和TSN 的CE 的比较结果显示,Ala-TS-lip 组在肝组织中的Sal B 和TSN 含量分别为TS-lip组的39.99、16.70倍,Ala-TS-lip组在肝组织中的Sal B 和TSN 多于TS-lip 组,说明配体18-GA-Ala 修饰的脂质体可以提高肝组织中Sal-B 和TSN的峰浓度。
由表5可知,Ala-TS-lip组TE 的结果显示,Ala-TS-lip所含Sal B在肝组织中的AUC分别是脾、肺和肾组织的1.19、1.39、63.67 倍,而TSN 在肝组织中的AUC 分别是脾、肺和肾组织的4.64、0.36、14.12倍,均表现出了较好的肝组织TE。
综上,TSN-Sal B复方脂质体经过甘草次酸衍生物配体18-GA-Ala 的修饰后,Sal B 和TSN 对肝组织的靶向增强,配体18-GA-Ala 表现出一定的肝靶向作用。
4 讨论
肝实质细胞表面存在大量的特异性甘草次酸结合位点,故可以通过修饰脂质体上的介导分子来实现对特定组织的主动靶向作用。例如,张其胜等[18]将甘草次酸标记在经6-甘露糖修饰的白蛋白上,可选择性地靶向分布到HSC 中;吴超等[19]发现甘草次酸修饰的脂质体在肝组织中的分布要高于药物溶液组。本研究也验证了经18-GA-Ala 修饰的脂质体可以提高Sal B和TSN在肝脏中的峰浓度,组织分布也表明,修饰后的脂质体可以促进药物在肝脏中的分布。这说明甘草次酸衍生物也可成为靶向肝的良好配体,结构修饰后满足实验的需要。此外,甘草次酸不仅可实现肝细胞靶向性,还可作为抑制胶原合成、减少肝纤维化的有效药物,与其他抗肝纤维化药物产生协同作用[20]。
此外,肝实质细胞膜上还存在视黄醇蛋白、无唾液酸糖蛋白等受体,非实质细胞存在甘露糖、低密度脂蛋白等受体。通过对脂质体进行一定的结构修饰,如连接甘草次酸及其衍生物等配体,可发挥配体-受体间的特异性结合作用,促进包载药物的脂质体主动靶向肝组织,提高生物利用度。这种利用配体-受体特异性结合的功能可为主动靶向其他组织治疗相关疾病的药物递送研究提供参考。
