DSA联合CT引导下经皮胃造口术在恶性食管梗阻患者营养治疗中的应用
2023-06-06童伦兵范承林
童伦兵,范承林
恶性食管梗阻患者因长期无法经口直接进食而易出现营养不良,影响其后续治疗,甚至危及生命。目前肠内营养是营养支持的首选方式[1,2],笔者充分运用介入微创技术,对32例恶性食管梗阻患者实行数字减影血管造影机(digital subtraction angiography machine,DSA)联合CT引导下经皮胃造口术,为患者提供安全有效的肠内营养治疗,取得了良好的临床效果。
1 临床资料
1.1 一般资料 收集2017-04至2021-03在成都市第七人民医院治疗的32例无法经口进食的恶性食管梗阻患者的临床资料,男28例,女4例,年龄45~79岁,平均63岁。1例舌癌,1例扁桃体癌,1例甲状腺癌并食管侵犯,1例食管癌放疗后支气管瘘、纵隔瘘形成,2例口咽癌放化疗后吞咽功能紊乱,2例鼻咽癌放化疗后吞咽功能障碍,2例面颊部癌,4例下咽部及食管癌,4例食管癌伴气管瘘形成,14例食管癌,术前均有病理证实。仪器:美国GE Discovery CT 750 64排螺旋CT,德国西门子AX10M Artis DTA DSA;材料:经皮胃造瘘套件(PEG 15,库利艾特医疗株式会社),5F单弯导管,2%盐酸利多卡因注射液(5 ml/支)。
1.2 治疗方法 所有患者术前均要求完善血常规、凝血功能、心电图、肝肾功检查,并调控血糖、血压,签署手术同意书,建立静脉通路,术前禁饮、禁食10 h以上。手术方式如下:(1)患者仰卧于DSA检查床上,2%盐酸利多卡因表面麻醉患者口咽部,在X线透视下经口腔插入软导丝,反复试探并顺利通过食管狭窄处进入胃内,经导丝交换置入5F单弯导管至胃内,经导管推注少许造影剂确认导管入胃后退出软导丝,导管尾端接三通,固定导管并将患者快速转移至CT室。(2)患者仰卧于CT扫描床上,将定位格栅(血管介入用的超滑导丝10 cm/节段,多节段间隔1 cm排列)固定于左上腹体表,经导管注入500~1000 ml空气(根据胃扩张程度,后续操作可调整气体注入量),患者自诉有饱胀感后行腹部CT扫描确定造瘘点、胃壁固定点(造口点左右旁开1 cm处,共两点),并测量各点穿刺角度与深度。(3)常规消毒、铺巾、局部麻醉,用20 G的胃壁固定器胃壁固定点穿刺,在CT引导下与皮肤垂直刺向胃腔,CT扫描证实后将蓝色针线把持圆圈推出,退出黄色针芯并引入缝合线,将蓝色的管芯针上提,直至有轻微抵抗感为止。拔出胃壁固定器时用手把住蓝色管芯针,将缝合线诱导至体外在腹壁处结扎,将胃壁固定于腹壁。同法,在另一胃壁固定点穿刺固定胃壁于腹壁。(4)在造口点处充分浸润麻醉,用手术刀片做5 mm的皮肤切口,再次经导管向胃推注空气并CT扫描确认安全穿刺深度,将配置好的T形持撑套的穿刺针(PS针)垂直刺入胃腔,有明显减压感后拔除PS穿刺针,迅速沿T形持撑套引入胃瘘用导管,由气囊注入3 ml生理盐水固定;左右撕去T形持撑套将其分裂,封堵营养袋接口。无菌敷料覆盖穿刺点,固定板固定胃瘘管体外部分,再次CT扫描确认胃造口管位置。
术后禁食24 h方可通过造口管向胃内注入营养液,应取半卧位,少量多次、逐步给予;喂食后用清水冲洗造口管,妥善固定,防止脱落。预防性使用抗生素3~5 d,有研究表明造口及周围皮肤的感染多源于口腔及上消化道,所以胃造口期间要注意患者的口腔清洁[4];保持造口处的清洁,定期消毒。
1.3 结果 32例患者均一次性顺利完成手术,手术成功率为100%,平均用时20 min。随访期间无腹腔大出血、腹膜炎、肠道损伤等严重并发症发生。术后发生并发症2例(6.3%),其中1例造口感染,经伤口清创换药处理后痊愈;1例术后4个月造口管滑脱,随后顺利对其更换造口管。典型病例:患者男,65岁,口咽癌放化疗后吞咽功能紊乱导致无法经口进食,采用DSA联合CT引导,成功经皮胃造口(图1)。
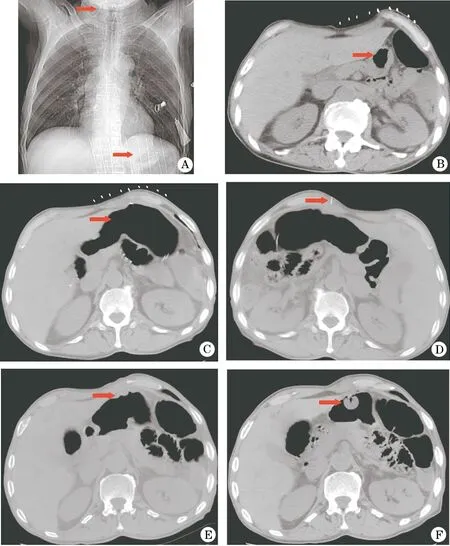
图1 口咽癌患者放化疗后吞咽功能紊乱
2 讨 论
在临床上无法经口进食的恶性食管梗阻患者,对其必须进行营养支持治疗,以期更长的生存期或后续治疗。肠外营养花费较高,普通人无法承受,并且长期的肠外营养容易使肠内菌群失调和消化道功能减退,发生代谢紊乱,反而加重营养不良[3]。同时,长期静脉滴入易引起血管炎。所以,肠内营养是一种相对来说更为科学的方法[4],目前主要包括各种形式的胃造口术和经鼻胃管。通过鼻胃管施行肠内营养引起肺的逆行传导感染风险比胃造口的风险更大[5],并且长期留置鼻胃管的患者会感觉口腔干燥、咽喉部疼痛、异物感,管壁长期受压容易使黏膜缺血从而导致溃疡和出血等并发症的产生[6]。其次经鼻胃管有损患者美观,不便携带及外出,降低了患者的生存质量[7]。所以对于那些长期需要进行肠内营养支持治疗的患者,胃造口的方式优于鼻胃管。常见的胃造口方式分为:传统外科手术胃造口、经皮内镜引导下胃造口(percutaneous endoscopic gastrostomy,PEG)、DSA引导下胃造口、CT引导下胃造口、C形臂CT引导下胃造口等。
传统外科胃造口术是一个开腹手术,腹部创伤大,愈合慢;需在静脉麻醉下施行手术,存在麻醉相关风险。行胃造口手术的患者病情一般较重,全身营养状况较差,年老体弱者较多,常合并高血压、冠心病、糖尿病等基础疾病,较难承受手术强度;且手术费用较高,对于一般家庭来说负担较大[4];有研究表明传统外科胃造口术后疼痛程度更高,住院时长和手术用时均比CT引导下的胃造口长,CT引导下胃造口术并发症发生率为3.57%,传统外科胃造口并发症发生率为21.43%,说明传统外科胃造口术后并发症更多[8]。
经皮内镜引导下PEG术后并发症有感染、出血、穿孔等,但致死率低,总体安全性好。PEG术后可用衣服遮蔽胃瘘管,有效保证了患者的生存质量[9]。有研究表明PEG比传统外科胃造口操作简单、手术用时短、并发症少、手术费用低、通过造口管喂食时间早[10]。但是对于恶性食管梗阻严重的患者,胃镜无法通过狭窄处,而DSA联合CT引导下经皮胃造口所用的经口插入的导管较细更容易通过食管狭窄处,并且操作更为简单。DSA引导下胃造口操作技术相对简单,手术成功率也较高[11];术中虽然能够实时动态观察进针方向、胃扩张充气程度和胃黏膜显影情况,但无法精确确定穿刺深度和角度,并且当左肝肥大置于胃前方和横结肠位于胃前方时,会造成误穿,导致内脏器官损伤、大出血等严重并发症发生[12]。
全程CT引导下胃造口定位穿刺更加精准,临近周围脏器关系明确,可避免误穿,手术难度降低。但需要进行胃造口手术的患者由于长期不能进食,胃萎缩严重,胃前后壁贴合较紧,直接CT引导下21G千叶针穿刺向胃内注入空气,这一步骤实际操作难度较大。术中容易穿通胃壁或者在CT扫描间隙穿刺针从胃腔内脱出进入腹腔,也加大了手术难度,同时该术式患者所受辐射剂量偏大。C形臂CT引导下胃造口兼顾DSA引导下和CT引导下胃造口的优点,既有DSA引导下胃造口的全部优点,还能准确定位穿刺,明确脏器毗邻关系,避免误穿。但是该术式CT扫描图像伪影较大,分辨率较低,只能作为位置参考图像且该设备价格昂贵,许多医院难以拥有,该术式广泛推广受到限制[13]。
综上所述,DSA联合CT引导下经皮胃造口术作为一种改良术式,操作简单、安全可靠,在恶性食管梗阻患者营养治疗中具有重要应用价值。
