基于微卫星标记的中华绒螯蟹遗传多样性分析
2023-06-06田间马行空曾健成王志红葛家春
田间,马行空,曾健成,王志红,葛家春*
(1.江苏省淡水水产研究所,江苏 南京 210017;2.江苏省科技资源统筹服务平台长江系中华绒螯蟹种质资源库,江苏 南京 210017;3.南京师范大学海洋科学与工程学院,江苏 南京 210023)
中华绒螯蟹(Eriocheir sinensis),又名河蟹、大闸蟹,隶属于甲壳纲(Malacostraca),十足目(Decapoda),方蟹科(Grapsidae),绒螯蟹属(Eriocheir)[1],广泛分布于我国长江中下游地区,是我国重要的经济型蟹类之一,其营养丰富,肉质鲜美,市场认可度极高[2]。河蟹地理分布也十分广泛,在我国形成了“长江蟹”“辽河蟹”“瓯江蟹”三大蟹系,其中长江蟹以产量高、味道鲜美而闻名[3]。
20 世纪80 年代后期,由于过度捕捞、水利设施建设、水体污染和栖息地被破坏等因素,天然蟹苗资源急剧衰退[4]。目前,随着河蟹养殖产业规模的壮大,天然苗种已无法满足河蟹生产需求。人工育苗的开展,解决了大部分养殖企业、养殖户的苗种需求,但引进多水系亲本、小规格亲本滥用等,出现了幼蟹培育成活率低、规格参差不齐、性早熟等现象[5-6]。河蟹种质问题已然成为制约河蟹产业发展的主要因素之一。在当前河蟹的群体选育过程中,由于多年连续选育且不引进外来亲本,可能导致有害等位基因和无用性状积累到河蟹种群中,有导致河蟹适应性和遗传多样性降低的风险[7]。因此,开展河蟹群体的遗传多样性研究,对遗传育种极为重要。
微卫星,又名简单串联重复序列(SSR),或短串联重复(STR),是以1~6 bp 的重复单位组成的串联重复序列,具有数量多、多态性丰富和易于检测等特点[8]。微卫星多年来被广泛用作遗传差异的标记,其中包括基因图谱、种群遗传学和法医学[9]。目前,关于微卫星在河蟹遗传多样性方面的研究已有报道。熊良伟等[10]利用37 对微卫星标记,构建了河蟹家系遗传图谱。李晓晖等[11]利用10 对微卫星标记,对长江水系3 个选育群体和野生群体进行了遗传分析。许志强等[12]用6 对微卫星标记对4个水系河蟹天然群体进行了遗传多样性分析。
现于2021 年利用6 个多态性丰富的微卫星分子标记,比较分析了单年系F5 代选育群体、“长江2 号”和长江野生群体的遗传多样性以及群体间的遗传分化,以期为河蟹的良种选育和种质资源保护提供理论依据。
1 材料与方法
1.1 试验材料
于江苏省淡水水产研究所扬中基地和长江通江河道(非禁捕区域),采集3 个河蟹群体同属奇数年群体,共90 个河蟹个体(表1),运输至实验室后,于-20 ℃保存。

表1 3 个群体河蟹样本采集信息
1.2 DNA 提取与检测
剪取河蟹附肢肌肉50~80 mg,于1.5 mL 离心管中,加入裂解液和蛋白酶K 混匀,于55 ℃水浴锅消化1.5 h,直至溶液澄清透明。再向裂解液中加入RNase A,于37 ℃水浴锅消化1 h。按照传统酚、三氯甲烷和异戊醇法提取组织DNA。1%琼脂糖凝胶电泳检测DNA 纯度和完整性,超微量紫外分光光度计(Thermo Scientific,美国)检测其质量浓度,稀释至50 μg/L,于-20 ℃保存备用。
1.3 PCR 反应体系、反应程序及扩增产物的检测
用6 对已报道的具有多态性的微卫星引物,分析3 个河蟹群体的遗传多样性(表2)。PCR 反应体系总体积:2×Taq Plus Master Mix II(Vazyme,南京)12.5 μL,上、下游引物各1 μL,DNA 模板1 μL,ddH2O 9.5 μL。PCR 扩增反应程序:94 ℃预变性5 min;94 ℃变性30 s,退火45 s;72 ℃延伸45 s,34 个循环;72 ℃延伸5 min。PCR 反应结束后,产物于4 ℃保存。

表2 河蟹6 个微卫星位点的引物信息
用8%聚丙烯酰胺凝胶电泳和硝酸银染色,检验PCR 扩增产物多态性。银染后,凝胶由Tanon 凝胶成像仪扫描成像。
1.4 数据统计与分析
等位基因数(Na)、有效等位基因数(Ne)、观测杂合度(Ho)、期望杂合度(He)、Shannon指数(I)、Nei氏遗传距离和遗传相似度,采用Popgen 1.32 软件计算;多态信息含量(PIC)采用Cervus 3.0 软件计算。群体间遗传分化指数(Fst)、群体分子方差分析(AMOVA),采用Arlequin 3.5 软件计算。系统树根据Nei氏遗传距离通过MEGA 5 软件,采用非加权配对算数平均法(UPGMA)构建。
2 结果与分析
2.1 微卫星位点多态性
6 个微卫星位点的遗传多样性参数见表3。6 个微卫星位点共检测出53 个Na,值为7~11,每个位点平均有17 个。Ne为4.539 4~9.529 4,平均值为7.100 3。I为1.668 3~2.312 3,平均值为2.023 3。Ho为0.638 9~0.861 1,平均值为0.745 4。He为0.790 7~0.907 7,平均值为0.862 2。PIC为0.779 7~0.895 1,平均值为0.850 2。根据Botstein等[14]的标准,PIC≥0.5 为高度多态性。本研究中的6 个位点均为高度多态性位点,说明这些位点均可提供丰富的遗传信息,能够有效地进行河蟹群体遗传多样性评估。F检验数据显示,在6 个位点中,有1 个位点的近交系数(Fis)值为负值,其余5 个位点为正值,表明近交程度较高。6 个位点遗传分化指数(Fst)的平均值为0.066 1。根据Wright 建议,4 个位点遗传分化程度中等(0.05 表3 6 个微卫星位点的遗传多样性参数① 3 个河蟹群体的遗传多样性见表4。由表4可见,长江野生群体的Na(7.666 7)、Ne(5.718 3)、I(1.909 9)、Ho(0.780 0)均为最高。所有群体的PIC均>0.5,表明群体的遗传多态性较高,具有较大的选择潜力。 表4 3 个河蟹群体的遗传多样性 群体间的遗传分化指数见表5。由表5 可见,3个河蟹群体间Fst为0.052 69~0.084 82,其中单年系F5 代选育群体与长江野生群体体间遗传分化系数最大(Fst=0.084 82),各群体间均属于中等程度的遗传分化(0.05 表5 群体间的遗传分化指数(Fst) 群体的分子方差分析见表6。由表6 可见,群体间变异占总变异的5.34%,且达到显著水平(P<0.05),94.66%的遗传变异来自种群内个体间,这表明个体间的遗传变异远大于群体间的遗传变异,遗传变异主要存在于个体间。 表6 3 个河蟹群体的分子方差分析① 3 个河蟹群体的遗传相似度和遗传距离见表7(以“****”为界,右上角为遗传相似度,左下角为遗传距离)。由表7 可见,3 个群体的Nei氏遗传距离为0.402 8~0.469 3。单年系F5 代选育群体与长江野生群体间的Nei氏遗传距离最远(0.469 3),遗传相似度最低(0.568 5)。单年系F5 代选育群体与“长江2 号”群体Nei氏遗传距离最近(0.402 8),遗传相似度最高(0.688 5)。 表7 3 个河蟹群体的遗传相似度和遗传距离 基于Nei’s遗传距离构建的3 个河蟹群体的UPGMA 系统进化树见图1。由图1 可见,单年系F5代选育群体首先与“长江2 号”群体聚为一类,再与长江野生群体聚为一类。 图1 基于Nei’s 遗传距离构建的3 个河蟹群体的UPGMA 系统进化树 基因杂合度是反映群体遗传变异的一个最适参数,微卫星位点平均杂合度反映了遗传结构变异程度高低,杂合度越大则变异越大,群体的稳定性越高,选择潜力越大[15]。本研究中,3 个河蟹群体的He介于0.817 6~0.847 8。许志强等[12]于2009 年收集了4 个河蟹群体,平均He为0.714 9 ~0.758 5;李晶晶等[16]于2012—2013 年收集了4 个河蟹群体,平均He为0.720~0.745,其值均低于本研究。Botstein等[14]研究表明,当PIC≥0.5 时为高度多态性,当0.25≤PIC<0.5 时为中度多态性。本研究中,3 个河蟹群体PIC值为0.784 1~0.812 5,均为高度多态性群体,表明其遗传多样性均处于较高水平,种质资源良好,有一定的种群稳定性,其中单年系F5 代选育群体和“长江2 号”2 个选育群体仍具有较大的选择潜力。 Na和Ne的值越接近,等位基因在群体中分布的越均匀[17]。本研究中,3 个群体的平均Ne小于Na,不均匀程度大小依次为单年系F5 代选育群体、野生群体、“长江2 号”群体。主要原因是等位基因在群体中分布不均匀,导致等位基因的频率不够平均[18]。本研究中,长江野生群体等位基因数和有效等位基因数,均高于单年系F5 代选育群体和“长江2 号”群体,其原因可能是近年来的增殖放流,导致长江野生河蟹与其他水系河蟹基因交流增加,在一定程度上提高了长江野生河蟹的遗传多样性。 Fst是用来衡量群体间遗传分化程度的重要参数。Balloux 等[19]认为,Fst值为0~0.05,表明群体间的遗传差异很小;Fst值为0.05~0.15,表明群体间发生了中等水平的遗传分化;为0.15~0.25 时,表明群体间存在较大的遗传差异;当Fst>0.25 时,表明群体间高度遗传分化。本研究中,3 个群体两两比较,遗传分化Fst值为0.052 69~0.084 80,表明群体间均有不同程度的遗传分化。单年系F5 代选育群体与“长江2 号”群体Fst值较小(0.052 69),此结果与实际生产情况相符,单年系F5 代选育群体部分亲本来源于“长江2 号”群体。Karnosky 等[20]认为,异交物种来源于种群之间的遗传变异应>90%,而本研究的分子方差分析(AMOVA)显示,94.66%的遗传变异来自种群内个体间,而来源于种群间的变异只有5.34%。这与刘青等[21]研究结果相似(群体间0.10%,部分变异来源于群体内个体间14.02%,绝大部分变异,来自个体内部85.88%)。表明3 个河蟹群体遗传变异多发生在群体内个体之间,群体内个体差较大,存在杂合子缺失的现象[22]。基于遗传距离的聚类分析,本研究中UPMGA 聚类树结果与各群体间的遗传距离结果一致,单年系F5 代选育群体与“长江2 号”群体遗传距离较小,与长江野生群体的遗传距离较大;聚类分析结果也表明,单年系F5 代选育群体先与“长江2 号”群体聚为一支,再与长江野生群体聚为一支。 本研究以2 个人工选育群体和1 个野生群体为对象,应用微卫星分子标记技术分析各群体的遗传多样性和群体间的遗传分化,结果表明,3 个群体的遗传分化程度均处于较高水平,2 个河蟹人工选育群体具有较大的选育潜力。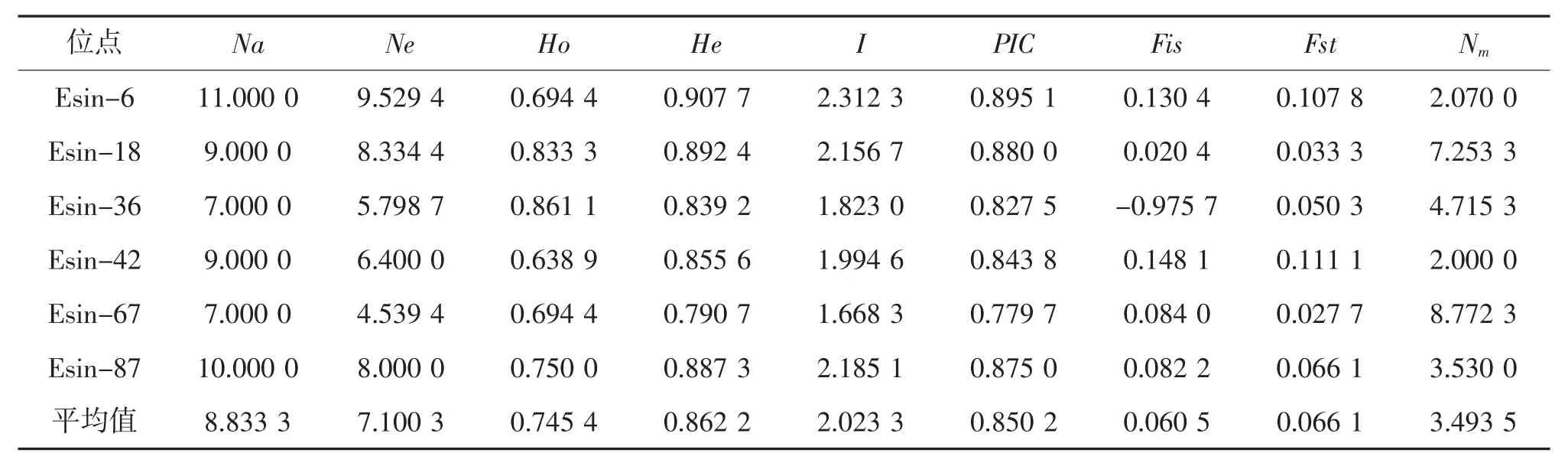
2.2 3 个河蟹群体的遗传多样性

2.3 群体遗传结构




3 讨论
3.1 群体遗传多样性
3.2 群体遗传分化与遗传距离
4 结论
