基于叶绿素合成关键基因构建马蹄莲佛焰苞离体VIGS技术体系
2023-06-05刘红艳刘振林张国君卫尊征
刘红艳 杨 拓 王 壹 孙 轩 王 贤 刘振林张国君 卫尊征,
(1河北科技师范学院园艺科技学院/河北省特色园艺种质挖掘与创新利用重点实验室/河北省高校特色园艺植物生物育种应用技术研发中心,河北 秦皇岛 066000;2北京市农林科学院草业花卉与景观生态研究所,北京 100097; 3中国农业大学园艺学院,北京 100193)
马蹄莲(Calla lily)是天南星科马蹄莲属(Zantedeschia)的球根花卉,作为主要观赏部位的佛焰苞形似燃烧的佛焰、状似弯曲的马蹄,具有极高的观赏价值[1]。然而,马蹄莲盛花期后,佛焰花的基部逐渐出现绿色并向上蔓延,在果实成熟后完全返青[2],这种现象导致其采后观赏品质下降,经济价值降低。因此,有效解决返青问题,有助于维持马蹄莲在运输及销售过程中的观赏价值。
目前国内外对佛焰苞返青现象的研究,主要集中在生理层面,包括色素含量变化、质体发育以及激素调控等方面。前人研究表明,马蹄莲返青过程中,组织内叶绿素含量随着佛焰苞外表皮绿色程度的加深而逐步增多[3],且叶绿体作为积累叶绿素的主要场所,在返青过程中再次形成[2]。植物生长发育受多种激素调控[4],乙烯作用于生长发育后期主要调控衰老,然而研究表明佛焰苞返青的过程不受乙烯调控[5];细胞分裂素和赤霉素主要作用于生长发育前期调控生长,研究表明外源施用赤霉素能有效延缓返青[6],与细胞分裂素有协同作用[7-8]。综上可知,目前有关佛焰苞返青的调控机制尚不明晰,有待进一步探索。
深入探究佛焰苞返青,需要借助分子手段鉴定相关的基因功能,从而为后续基因编辑育种奠定理论基础。但马蹄莲的再生和遗传转化极其困难[9],从实生苗到开花需要3~4 年的时间,对佛焰苞进行相关的表型鉴定比较困难。因此,利用转基因技术验证马蹄莲基因功能的方法仍存在瓶颈。病毒诱导的基因沉默(virus induced gene silencing,VIGS)是近年来发现的一种转录后基因沉默现象,可引起内源mRNA 序列特异性降解[10]。目前VIGS 已成功应用在众多观赏花卉的相关研究中,如蝴蝶兰[11]、长春花[12]、矮牵牛[13]等。从技术、材料等方面考虑,利用VIGS 技术建立马蹄莲属植物基因功能研究的技术体系,可能是克服马蹄莲遗传转化困难的重要手段。且鉴定叶绿素合成的关键基因,将有助于更好地认识马蹄莲佛焰苞的返青过程,为延长观赏期提供有力的科学依据。
因此,本研究以彩色马蹄莲黄色品种Florex Gold为对象,依据北京市农林科学院草业花卉与景观生态研究所马蹄莲课题组(本课题组)前期所构建的佛焰苞返青转录本数据库,鉴定与叶绿素合成途径的两个关键基因ZhGluTR和ZhChlH转录本序列,之后进一步利用Primer 5.0 软件设计上下游引物扩增非结构域的部分编码区并基于同源重组法构建VIGS瞬时沉默载体,以期为解析马蹄莲佛焰苞返青现象的分子机制奠定基础。
1 材料与方法
1.1 试验材料
供试材料为彩色马蹄莲黄色栽培品种Florex Gold,栽植于北京市农林科学院延庆农场[14],试验于2022 年3—5 月进行。依据返青过程中外表皮颜色的差异,选择外表皮呈黄色的盛花期(S1)、外表皮呈浅绿色的返青初期(S2),以及外表皮呈深绿色的返青后期(S3)分别取样作为试验材料。
1.2 试验方法
1.2.1 彩色马蹄莲返青典型时期的植物学性状观察 取佛焰苞S1、S2和S3期的新鲜样本。利用透明胶带将两片重叠且湿润的双面刀片中部粘合,沿佛焰苞中部着色均匀部位的脉络垂直方向快速切下,毛笔蘸取置于滴有清水的载玻片上,盖上盖玻片完成徒手切片制作,在显微镜下观察比较呈色细胞的分布[15]。
1.2.2 色素含量测定 以S1、S2 和S3 期佛焰苞为材料,每个时期选取15朵花作为重复,取样中部着色均匀部位液氮研磨至粉末状。称取0.1 g迅速转移到10 mL离心管中,加入10 mL 提取液,提取液为80%丙酮与95%乙醇的等比混合液。反复颠倒离心管3~5次,4 ℃避光提取10 min,随后用MG-1650 台式高速离心机(美瑞克,深圳)7 340 r·min-1离心15 min 后取上清,用UV2500 紫外分光光度计(天美,上海)测定663、645 和440 nm 波长处的吸光值[16]。计算相应的叶绿素和类胡萝卜素含量[17]。VIGS侵染后的孔片每个试验组分别选取30片,重复上述操作。
1.2.3 色差值测定 以S1、S2和S3期佛焰苞为材料,使用NR60CP 手提式多功能色差仪(三恩驰,深圳)进行色差参数测定。每个时期分别选取15 朵花作为重复,避开主脉,对每朵花测定中部对称的2个位置。将获取的平均值作为该时期的花色参数L*、C和h值(L*值表示亮度,C值表示色饱和度,h值表示色调角)。VIGS 侵染后的孔片每个试验组分别选取30 片,重复上述操作。
1.2.4 基因靶片段克隆与载体构建 利用EASY spin Plus 多糖多酚/复杂植物RNA 快速提取试剂盒(北京艾德莱生物科技有限公司)提取返青初期佛焰苞总RNA。使用HiScript Ⅲ 1st Strand cDNA Synthesis Kit试剂盒(南京诺唯赞生物科技有限公司)反转RNA 为cDNA作为PCR模板。
本课题组在前期研究中,利用Hiseq2500 平台针对黄色品种Florex Gold 的上述三个典型时期的佛焰苞进行了转录组测序,原始数据登录在中国科学院北京基因组研究所(国家生物信息中心)的组学原始数据归档库(Genome Sequence Archive),登录号为CRA000209。本研究利用上述数据构建转录本数据库,并从中查找在佛焰苞返青过程中表达量不断增加的两个叶绿素合成途径关键基因ZhGluTR(OP076741)和ZhChlH(OP076742)的转录本序列。通过ORFfinder网站(https://www.ncbi.nlm.nih.gov/orffinder/)分析转录本的开放阅读框,将完整的编码区输入CD-Search(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)预测蛋白保守结构域,利用Primer 5.0 软件在非保守结构域的编码区设计靶片段的上、下游引物扩增片段,利用限制性内切酶EcoRI 和XhoI 得到烟草脆裂病毒(tobacco rattle virus,TRV2)的线性载体,通过同源重组试剂盒ClonExpress II One Step Cloning Kit(南京诺唯赞生物科技有限公司)将片段分别与线性TRV2 连接,完成VIGS瞬时沉默载体构建。扩增引物见表1。

表1 本研究所用引物序列相关信息Table 1 Primer lists and related information used in this study
1.2.5 佛焰苞离体VIGS体系建立 设计完全随机试验,以佛焰苞中脉为轴,用14 mm打孔器取样中部及上部孔片作为侵染材料(图1),分别以3 和5 min 作为真空抽吸时间,共设4个试验组(5上、5中、3上、3中)进行。将病毒载体以及VIGS 瞬时沉默载体转化进农杆菌感受态GV3101,放置28 ℃摇床,加入终浓度50 mg·L-1卡那霉素与25 mg·L-1利福平的液体LB(Luria-Bertani)培养基,200 r·min-1中过夜震荡培养,6 000 r·min-1离心菌液6 min 后弃上清,加入终浓度10 mmol·L-1氯化镁(MgCl2)、10 mmol·L-12-吗啉乙磺酸(2-morpholinoethanesulfonic acid,MES)与200 μmol·L-1乙酰丁香酮(acetosyringone,AS)的侵染缓冲液重悬菌体[18]。调整菌液在600 nm 波长处的光密度(optical density,OD)浓度为0.8[19]。将TRV1 菌液分别与TRV2、TRV2-ZhGluTR和TRV2-ZhChlH菌液等比混合后暗静置3~4 h[20]。将中部与上部组织分别浸没在混合菌液中,抽真空至0.08 MPa[21],负压分别处理3 和5 min 后缓慢放气,重复3 次。随后用蒸馏水反复冲洗孔片,无菌滤纸吸干水分,将孔片背面向上置于0.4%琼脂培养基内保持湿润[22],4 ℃暗置共培养3 d 后转移至21 ℃正常光照下培养。每个试验组放置30个孔片,重复3次。共培养结束后记为0 dpi,对上述4个试验组在0、3、6、9 dpi 分别取样品放置于液氮中速冻,存于-80 ℃备用。

图1 彩色马蹄莲佛焰苞取样位置示意图Fig.1 Sampling position diagram on sapthe of Zantedeschia hybrida Florex Gold
1.2.6 实时荧光定量PCR 验证 完全随机试验中选取效果最好的试验组进行实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)验证。上述3 种菌液侵染后的孔片各选10 片,利用EASY spin Plus 多糖多酚/复杂植物RNA 快速提取试剂盒提取该组样品总RNA,利用HiScript Ⅲ 1st Strand cDNA Synthesis Kit反转为RNA 为cDNA 作为qRT-PCR 的模板。以ZhActin作为内参基因[23],ZhGluTR和ZhChlH作为目的基因,通过Primer 5.0 软件设计引物(表1),使用Taq Pro Universal SYBR qPCR Master Mix 试剂盒(南京诺唯赞生物科技有限公司)进行试验,试验设置3次技术重复。将得到的数据采用2-ΔΔCT法计算[24]。
1.2.7 数据分析 色差值、色素值以及qRT-PCR 测定数据采用Excel 2010、SPSS 22.0进行数据分析,采用GraphPad Prism 8.0软件进行图片制作。
2 结果与分析
2.1 彩色马蹄莲返青过程中的表型、色差以及相应的色素含量及分布情况
通过徒手切片观察佛焰苞S1、S2和S3时期的色素分布,并测定相应时期的色差值和色素含量。
结果表明,盛花期时表型为黄色,切片观察组织背面含有黄色的类胡萝卜素;返青初期时表型为浅绿色,切片观察组织背面开始出现叶绿素积累;返青后期时表型为绿色,切片观察组织背面叶绿素积累增多(图2)。
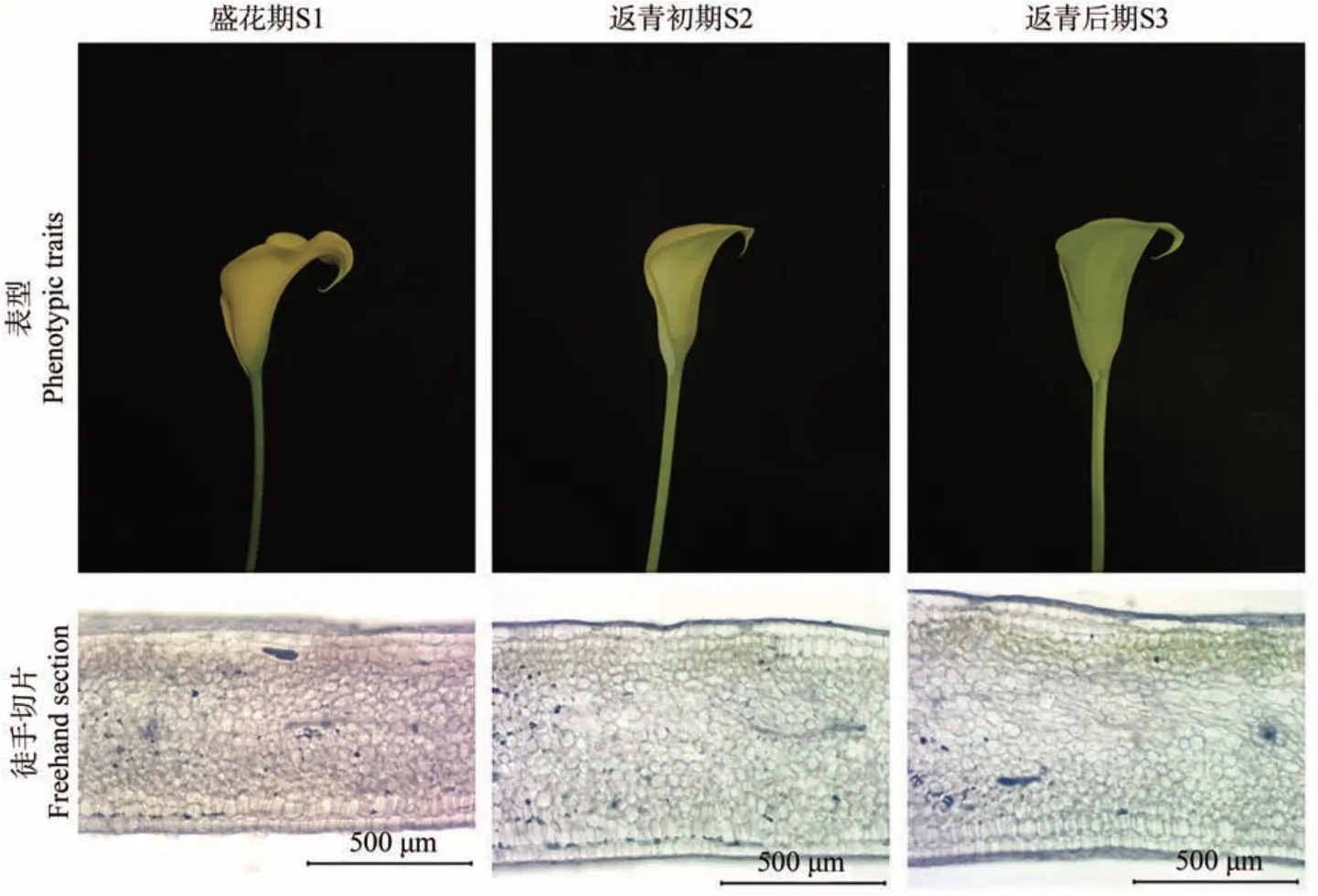
图2 彩色马蹄莲Florex Gold返青过程中的表型与相应色素分布Fig.2 Changes of spathe phenotype and corresponding pigment distribution of Zantedeschia hybrida Florex Gold
在佛焰苞发育过程中,h值与总叶绿素含量持续上升,L*值与C 值持续下降,且各阶段之间差异显著(P<0.05);总类胡萝卜素含量在S1 至S2 时显著下降(P<0.05),S2至S3时有所下降,但差异不显著(图3)。

图3 彩色马蹄莲Florex Gold返青过程中的花色参数(A)以及色素含量(B)变化Fig.3 Changes of spathe flower color parameter(A),and pigment content(B)in Zantedeschia hybrida Florex Gold during regreening
2.2 ZhGluTR 和ZhChlH 的结构域分析以及沉默片段的克隆和VIGS瞬时沉默载体构建
由图4 可知,ZhGluTR 和ZhChlH 的编码区都具有较长的保守结构域,位于编码区非结构域部分的片段被成功克隆,长度分别为412 和400 bp。通过凝胶电泳确定沉默片段大小,并利用Sanger 测序确定序列的准确性。通过同源重组法将TRV2 载体与沉默片段分别相连,通过凝胶电泳确定重组片段大小,并利用Sanger 测序确定序列的准确性,成功构建了VIGS 瞬时沉默载体TRV2-ZhGluTR和TRV2-ZhChlH。

图4 ZhGluTR和ZhChlH结构域分析(A)、沉默片段克隆(B)和VIGS瞬时沉默载体构建(C)Fig.4 Domain analysis of ZhGluTR and ZhChlH (A),silent fragment clones(B)and VIGS transient silencing vector construction(C)
2.3 ZhGluTR 和ZhChlH 基因沉默对彩色马蹄莲佛焰苞的影响
在0、3、6 和9 dpi分别取经上述3 种菌液浸染后的孔片,进行表型、色差值和色素含量测定,结果如图5所示。与对照侵染的佛焰苞孔片相比,TRV2-ZhGluTR和TRV2-ZhChlH侵染的佛焰苞孔片返青现象出现得较晚。TRV 侵染的佛焰苞孔片在3 dpi 时由黄逐渐变绿,出现返青现象,随后在9 dpi 完全返青。TRV2-ZhChlH侵染的佛焰苞孔片在6 dpi 后出现轻微返青,此时4种处理方法的色调角h值与对照相比均显著降低(P<0.05);TRV2-ZhGluTR侵染的佛焰苞孔片在9 dpi后出现轻微返青,此时4种处理方法的h值与对照相比均显著降低(P<0.05)。并且h值的变化趋势与侵染后孔片的颜色变化相符,即孔片表现绿色程度越深,相应的h值越大。

图5 VIGS侵染后各处理组的表型(A)和色调角(B)变化Fig.5 Phenotype(A),hue angle(B)of each treatment group after VIGS infection
本试验中被浸染的所有孔片随时间增长而发生的共同变化为叶绿素含量增多,类胡萝卜素含量降低。相较而言,两个沉默组中叶绿素含量显著增多的时间节点位于对照之后,类胡萝卜素含量显著减少的时间节点位于对照之前。除此以外,4 个处理组中,对中部孔片真空侵染5 min 的处理方法使得返青现象出现得最迟,叶绿素含量积累以及类胡萝卜素减少相对缓慢(图6)。

图6 VIGS侵染后各处理组的色素含量变化Fig.6 Pigment content of each treatment group after VIGS infection
综上所述,沉默ZhGluTR和ZhChlH会延迟返青现象,对中部孔片真空侵染5 min的处理方式延迟返青效果最好,推测ZhGluTR和ZhChlH可能正向调控马蹄莲中叶绿素的合成。
2.4 实时荧光定量PCR验证
选取VIGS 体系中延缓返青效果最好的处理组(5中)进行qRT-PCR 验证,结果如图7 所示。与对照相比,TRV2-ZhGluTR和TRV2-ZhChlH侵染的佛焰苞孔片中,ZhGluTR和ZhChlH基因的相对表达量均显著下降(P<0.05)。表明佛焰苞离体VIGS体系构建成功。

图7 VIGS侵染后ZhGluTR(A)和ZhChlH(B)的相对表达量变化Fig.7 Changes of relative expression levels of ZhGluTR(A)and ZhChlHB(B)after VIGS infection
3 讨论
在自然界中,植物返青现象并不罕见。除马蹄莲外,还出现于夏橙[25]、蝴蝶兰[26]、白掌[27]等植物中。前人研究表明,彩色马蹄莲黄色品种Best Gold 返青过程中,佛焰苞内的质体形态逐步发生变化,即有色体逐步转变为功能叶绿体[6];与此同时,佛焰苞外缘绿色程度加深、叶绿素含量增多以及类胡萝卜素含量降低[3]。这与本研究黄色品种Florex Gold 返青过程中的生理变化一致。究其原因,可能是由于黄色品种Florex Gold在盛花期(S1)时,佛焰苞内的质体以有色体为主,有色体内含有大量类胡萝卜素,使佛焰苞呈现黄色表型;返青初期(S2)时,佛焰苞内的有色体开始向叶绿体转变,此时有色体减少,类胡萝卜素含量降低,叶绿体增加,叶绿素含量升高,使佛焰苞由黄色逐渐转变为绿色;返青后期(S3)时,佛焰苞内的质体以叶绿体为主,叶绿体内含有大量叶绿素,使佛焰苞呈现绿色表型。综上,本研究结果从表型方面阐述了佛焰苞返青现象产生的原因。
前人研究表明,彩色马蹄莲黄色品种Best Gold 佛焰苞的返青现象开始于S1 期后的2~3 d[3],这与本研究中黄色品种Florex Gold 佛焰苞离体孔片的返青过程一致。处于S1 期的马蹄莲佛焰苞外表皮着色均匀,尚未出现绿色,与S2、S3期相比,叶绿素含量最少。由S1向S2转变的时期是叶绿素生物合成的关键时期,以S1期的佛焰苞作为侵染材料,选用叶绿素合成关键基因作为构建马蹄莲佛焰苞VIGS体系的指示基因,最容易观测到沉默后表型颜色的变化情况。理论上沉默后可以暂时抑制叶绿素的合成与积累,达到延缓绿色表型出现的效果[28],本研究所得结果与理论一致。
VIGS 在园艺植物中被广泛应用,侵染材料常选择种球和幼苗等植物组织。例如,利用种球作为侵染材料的唐菖蒲(Gladiolus hybridus)[29],以及利用7 周龄幼苗作为侵染材料的罂粟(California poppy)[30]。除上述植物组织外,还可以采用切花甚至瓣片等离体植物组织作为侵染材料。例如,瓜叶菊(Senecio cruentus)采用切花作为浸染材料,通过花葶注射和真空浸润头状花序成功沉默花青素途径基因ScANS使花色改变[28];玫瑰(Rosa hybrida)采用切花和瓣片作为浸染材料,通过真空法成功沉默与花衰老有关的基因RhWRKY33,使植株延缓衰老[31]。
采用切花或瓣片进行VIGS体系构建,相较于种球或幼苗而言,材料更易获取,并且见效更快,能够有效避免侵染种球或幼苗后成花过程太久导致的病毒失效问题,同时便于发现问题并及时优化体系。前人研究发现,佛焰苞的切花与瓣片在返青过程中外表皮均由黄转绿,变化趋势一致[7],因此本研究选取了体积更小更易操作的佛焰苞瓣片为试验材料,利用14 mm 打孔器保证取材的均一以及规整。在同一时空内,植物叶片尖端的衰老先于基部[32],衰老部位的细胞分裂和代谢能力较差。彩色马蹄莲的佛焰苞本质是变态叶,本研究中对佛焰苞中部孔片的延缓返青效果高于上部孔片,推测可能是由于较上部而言,中部组织更幼嫩,细胞活力更强。在特定范围内,真空条件下侵染植物组织时间越长,沉默效果越好。例如,小麦幼苗和玉米幼苗在无真空条件下侵染的沉默效率低于真空条件下侵染的沉默效率[33]。本研究中佛焰苞孔片在真空5 min条件下的侵染效率高于3 min,与上述结论相符。
本研究验证了彩色马蹄莲叶绿素合成关键基因的功能,成功构建了马蹄莲的离体VIGS 体系,为进一步探索彩色马蹄莲佛焰苞返青基因的功能提供了技术支持。
4 结论
本研究针对彩色马蹄莲现有稳定遗传转化体系不成熟,无法验证基因功能等问题,采用优化的试验体系对叶绿素合成关键基因ZhGluTR和ZhChlH进行沉默,构建彩色马蹄莲佛焰苞离体VIGS 技术体系;测定3 种菌液侵染后各个试验组中孔片的表型、色差值以及色素含量。综合得出最佳处理方式为对佛焰苞中部真空处理5 min,即该方式延迟返青的效果最好。
