与辣椒抗TMVL3基因连锁的分子标记的筛选及种质资源抗TMV鉴定
2023-06-04陈灵芝张茹王兰兰高彦萍
陈灵芝 张茹 王兰兰 高彦萍


摘 要 以含抗辣椒TMV的L3基因的材料L15为基础,利用与L3基因连锁的3个分子标记189D23MF、PMFR11和PMFR21对种质资源进行鉴定。对L15、3份感病材料H8/H9/H11×L15 F1、46份辣椒種质资源进行室内人工TMV接种并对其进行表型抗性鉴定和RT-PCR检测。对筛选出的标记在F1及BC1P1群体中进行验证。结果表明:分子标记189D23MF在L15和12份辣椒种质上均未扩增出条带;SCAR标记PMFR11在L15和46份辣椒种质上呈现共显性分离,SCAR标记PMFR21为显性标记。通过室内人工接种鉴定方式,2份材料L15、H11×L15表现为高抗。H9×L15表现为抗,H8×L15及5份材料A1、A35、A39、A55、L16表现为中抗,11份材料表现为感病,30份材料表现为高感。在F1及BC1P1群体中PCR扩增结果表明SCAR标记PMFR21可用于辣椒抗TMV分子标记辅助选择。
关键词 辣椒;L3基因;分子标记;种质资源;TMV
辣椒(Capsicum annuum L.)为茄科辣椒属一年生或多年生植物,在全国多个省、市、自治区广泛栽培[1]。病毒病一直是威胁辣椒生产的重要因素,常引起辣椒叶片坏死、枯斑、褪绿,植株矮化,落花、落果,对辣椒生产造成严重损失[2-3]。目前,世界各地鉴定出侵染辣椒的病毒有45余种,其中烟草花叶病毒(Tobacco mosaic virus,TMV)是威胁辣椒生产的主要病毒[4-5]。TMV在世界范围内普遍发生,尤其易感染烟草、番茄、辣椒等茄科作物[6-11]。烟草花叶病毒很容易通过机械摩擦和种子传播。在植物上引起系统性的花叶症状,严重危害作物的产量和质量[12-13]。利用人工接种鉴定抗性种质资源和选择抗性单株费时,易受环境因素如温度,植株发育阶段的影响,还依靠于病原的可靠性,而且这种鉴定方式,还可能会把病原散播到邻近地块的作物上。因此,在抗病毒育种中,利用与抗性基因紧密连锁的DNA标记被认为是最经济有效的方法[14]。
种质资源对烟草花叶病毒的侵染反应,受抗性基因存在与否的影响。辣椒中存在抗烟草花叶病毒属(Tobamovirus)的抗性位点L,L位点抗性包括TMV、ToMV(Tomato mosaic virus,番茄花叶病毒)、PaMMoV(Paprika mild mottle virus,甜椒斑驳花叶病毒)和PMMoV(Pepper mild mottle virus,辣椒斑驳花叶病毒)。在这个位点上发现了5个等位基因。L0是敏感型,L1抗TMV的P0生理小种,L2抗PaMMV的P0和P1生理小种,并且战胜了L1的抗性。L3抗PMMoV的P0、P1和P1.2生理小种,并且战胜了L2的抗性。L4抗PMMoV的P0、P1、P1.2和P1.2.3生理小种,并且战胜了L3的抗性。L位点的其他等位基因如L1a、L1c和L2b也被鉴定了,这几个位点具有不同的温度敏感性。近来,PMMoV的生理小种P1.2.3.4被鉴定,这个生理小种刹住了L4的抗性[15-16]。
Tomita等[15]针对辣椒中抗TMV的P1.2生理小种L3基因,开发了189D23MF分子标记。Sugita等[17]和王立浩等[18]开发了PMFR11和PMFR21。
本研究基于多年辣椒育种积累的一批种质资源,开展利用与抗辣椒烟草花叶病毒基因连锁的分子标记进行抗病毒种质资源的鉴定工作及室内人工接种鉴定,旨在为辣椒抗病毒种质资源的创新和新品种的选育提供理论依据。
1 材料与方法
1.1 材 料
L15,从中国农业科学院蔬菜花卉研究所辣椒课题组引进。其特性为:植株矮,长势弱,果实为小尖锥形,长约2 cm,味辣。3个感病材料H8、H9、H11和抗病材料 L15杂交1代(F1)单株33个,甘肃省农业科学院辣椒育种组的种质资源46份。H8(P1)和L15(P2)的回交1代(BC1P1)单株 92 株。
1.2 方法
1.2.1 与抗TMV的L3基因连锁的分子标记鉴定 利用已报道的3对与L3基因连锁的分子标记189D23MF、PMFR11和PMFR21,对辣椒种质资源进行鉴定(表1)。采用CTAB法提取辣椒DNA后,用1%琼脂糖凝胶电泳和紫外分光光度计测定DNA的质量和浓度,并将浓度稀释至100 ng·μL-1。PCR反应体系为:PCR-mix(2×Es Taq Master Mix)10 μL,模板DNA 1.0 μL,引物(10 μmol·L-1)各0.8 μL,ddH2O补齐至25 μL。PCR扩增程序:94 ℃预变性5 min;94 ℃变性50 s,58 ℃退火50 s,72 ℃延伸30 s,共进行35个循环;最后72 ℃延伸10 min,4 ℃保存。
1.2.2 辣椒种质资源的TMV室内人工接种鉴定及分子检测 在辣椒苗4~5片叶时采取苗期接种鉴定方法对供试材料进行抗病性鉴定[19]。采用天根生化科技(北京)有限公司总RNA提取试剂盒提取2个L15接种单株、6个其他材料接种单株、1个接种烟草单株、1个未接种烟草单株病毒病样本总RNA,利用 Thermo Scientific RevertAid First Strand cDNA Synthesis Kit 对提取的总RNA 进行反转录。采用 PCR 扩增相应病毒的序列(表1)。反应体系:Mix( 含 Mg2+,dNTP,buffer,Taq酶 )12.5 μL,TMV上下游引物各1 μL,模板1.5 μL,ddH2O 9 μL。扩增程序:94 ℃,4min;94 ℃,30 s,55 ℃,30 s,72 ℃,1 min,30个循环;72 ℃,5 min。1%琼脂糖凝胶检测目的条带并双向PCR直接测序。采用生物学软件 DNAMAN进行核苷酸序列的多重比对。
1.2.3 SCAR标记PMFR21的验证 对筛选出的SCAR标记PMFR21在H8/H9/H11×L15F1群体(H8×L15F1单株10个、H9×L15F1单株12个、H8×L15F1单株11個)及H8×L15的BC1P1群体中进行PCR扩增验证。扩增体系同“1.2.1”。
2 结果与分析
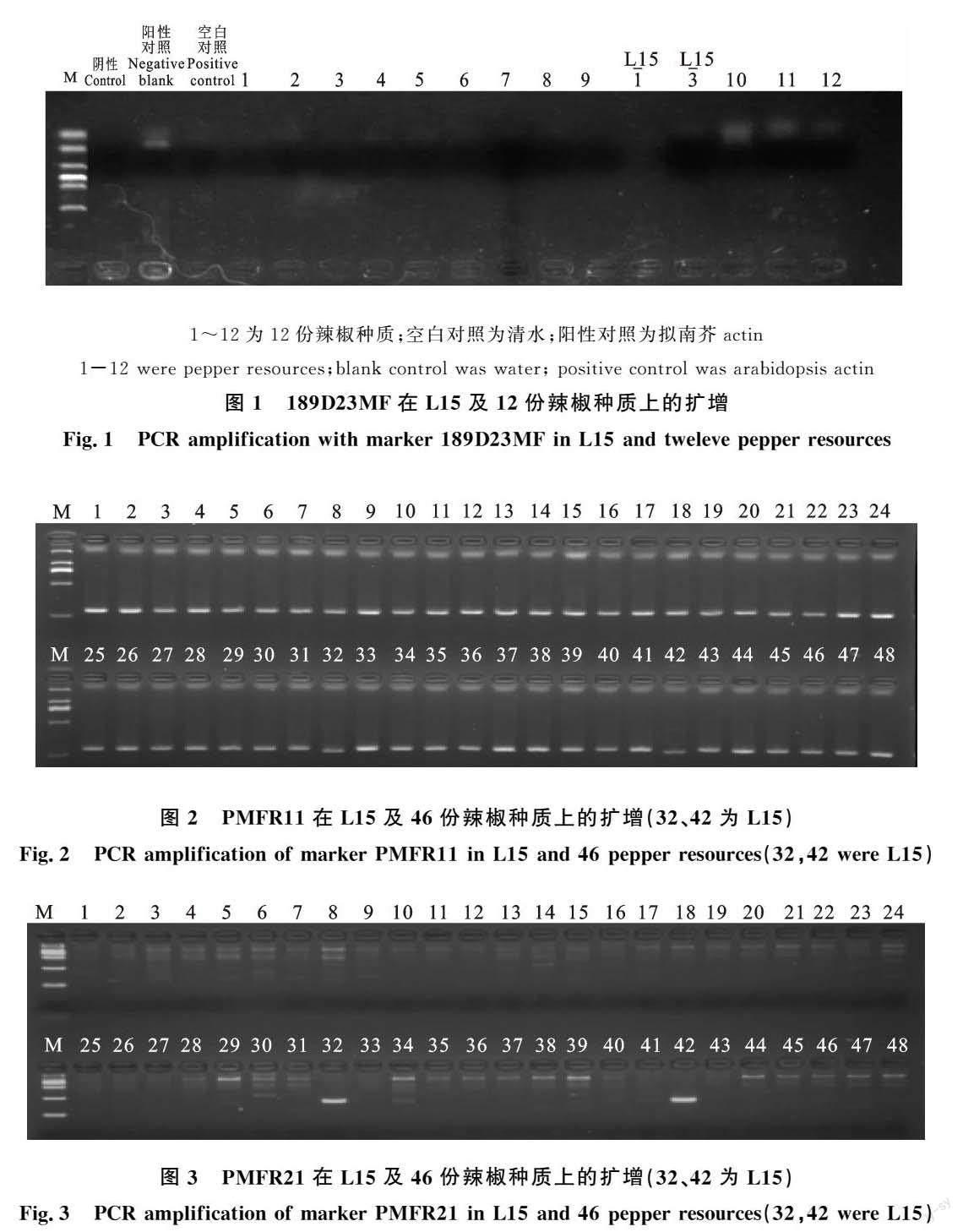
2.1 189D23MF的检测
利用189D23MF在12份辣椒材料和L15上进行检测,结果这12份辣椒材料和L15均未扩增出条带(图1)。
2.2 PMFR11和PMFR21的检测
利用PMFR11在47份材料上(包括L15)进行扩增,PMFR11在L15上扩增出一条约270 bp左右的条带,在其余的46份材料上扩增出约280 bp左右的条带,PMFR11呈现共显性标记特征,扩增出的两条条带大小相近(图2)。
利用PMFR21在47份材料上(包括L15)进行扩增,PMFR21在L15上扩增出一条约200 bp左右的单一条带,而在其余的46份材料上没有扩增(图3),PMFR21呈现显性标记特征(图3)。
2.3 供试材料抗病性鉴定结果及分子检测
2.3.1 供试材料抗病性鉴定结果 利用室内人工接种方式,对50份辣椒材料进行抗病毒鉴定,L15表现为高抗。3个感病材料H8/H9/H11与L15的F1代抗性好,21S6:H11×L15表现为高抗,21S5:H9×L15表现为抗,21S4:H8×L15表现为中抗。表明L15可作为抗TMV抗性资源。46份辣椒种质中,5份种质A1、A35、A39、A55、L16表现为中抗,11份种质表现为感病,30份种质表现为高感,表明辣椒常规种质中缺乏抗TMV抗性资源(表2、图4)。
2.3.2 TMV病毒CP基因的PCR扩增和测序 对10个试验单株采集叶片,提取总RNA,以反转录的cDNA为模板,利用设计的TMV病毒引物进行RT-PCR分子检测。试验结果表明,7个单株上扩增出目的片段,3个单株上无目的片段扩增。7个有目的片段扩增的单株分别为1个接种烟草单株、6个其他材料接种单株,3个无目的片段扩增的单株分别2个L15接种单株、1个未接种烟草单株(图5)。
挑选1、3、8、10扩增出的目的条带进行切胶回收测序,序列结果分析表明这4个扩增片段核苷酸序列相似性为99.8%,与TMV CP基因核苷酸序列同源性均达到98%以上。
2.4 SCAR标记PMFR21在F1及BC1P1群体上的验证
利用PMFR21在96份材料中进行PCR扩增,琼脂糖凝胶检测表明,在33个F1代单株、1个L15单株PMFR21均扩增出目的条带,62份甘肃省农业科学院辣椒育种组的种质资源中均未扩增(图6)。
利用PMFR21在96份材料进行PCR扩增,琼脂糖凝胶检测表明,PMFR21在2个L15单株B2、C6中扩增出目的条带,在2个H8单株H1、F5中未扩增出目的条带,其余92个BC1P1单株中,46个单株中扩增出目的条带,46个单株中未扩增目的条带,目的条带的有和无的扩增结果分离比例为1,符合单基因遗传分离规律(图7)。
3 讨 论
L基因发现于1980年,被广泛应用于抗病毒辣椒的品种选育工作中。L位点的等位基因L1、L2、L3、L4分别在辣椒属的Capsicum annuum L.(e.g.cv.‘Bruinsma Wonder and ‘Verbeterde Glas)、Capsicum frutescens L.(cv.‘Tabasco)、Capsicum chinense Jacq.(PI159236)和Capsicum chacoense Hunz.(PI260429)上被鉴定。通过温室内人工接种TMV株系TMV-U1鉴定,L15表现为抗病,叶片仅有轻微的花叶,表现为高抗。因此,L15是一个可作为TMV抗源的种质资源。
本研究中,189D23MF在L15上未扩增出条带,可能是189D23MF L3基因的来源与L15 L3基因来源不同。
PMFR11在抗病和感病材料上分别扩增的条带大小为269 bp和283 bp,抗性条带和感病条带大小相近。Martina等[20]使用6%的聚丙烯酰胺进行电泳跑胶,抗性条带和感病条带之间的距离较大,分离清楚,这是因为聚丙烯酰胺分辨率高的缘故。本试验使用2%的琼脂糖凝胶电泳进行跑胶时,从图3中可以看出,两个条带分离的比较清楚,而2%的琼脂糖电泳制备和跑胶更容易,操作更简单。
笔者从2020-2021年,利用SCAR标记PMFR21对甘肃省农业科学院辣椒育种组的100多份种质资源进行筛选,但没有1份种质资源中含有L3基因,表明辣椒常规材料中极度缺乏抗TMV的抗性基因。本项研究中,利用F1及BC1P1群体结合室内人工接种鉴定,表明SCAR标记PMFR21可用于辣椒抗TMV分子标记辅助选择。
L3基因抗TMV的P1.2生理小种,但不抗TMV的P1.2.3生理小种,而L4基因可以克服P1.2.3生理小种,Capsicum chacoense Hunz.(PI260429)含有L4基因,Kim等[21]开发出与L4基因连锁的SCAR标记LS430,所以利用Capsicum chacoense Hunz.(PI260429),将它作为TMV的抗源,则可为进一步创新抗TMV种质资源和选育抗TMV品种奠定基础。
4 结 论
筛选出与辣椒抗TMV L3基因连锁的2个SCAR标记PMFR11和PMFR21。PMFR11在L15和46份辣椒种质上呈现共显性分离,SCAR标记PMFR21为显性标记。通过室内人工接种鉴定方式,含辣椒抗TMV L3基因的材料L15表现为高抗,可作为辣椒抗TMV资源利用,感病材料与L15的杂交F1代抗性好。在46份辣椒材料中,5份材料表现为中抗,11份材料表现为感病,30份材料表现为高感,表明辣椒普通材料中缺乏TMV抗性基因。对筛选出的SCAR标记PMFR21在F1群体及BC1P1群体中进行验证,试验结果表明SCAR标记PMFR21可用于辣椒抗TMV分子标记辅助选择。
参考文献 Reference:
[1] 王立浩,张正海,曹亚从,等. “十二五”我国辣椒遗传育种研究进展及其展望[J].中国蔬菜,2016(1):1-7.
WANG L H,ZHANG ZH H,CAO Y C,et al.Research progress on pepper genetic breeding during China ‘Eleventh Five-year Plan[J].China Vegetable,2016(1):1-7.
[2] 姚玉荣,陈国华,冯兰香,等.北运蔬菜基地辣椒病毒病病原种类的分子检测[J].中国蔬菜,2013(10):84-89.
YAO Y R,CHEN G H,FENG L X,et al.Molecular detection of pepper viruses in southern vegetable production bases[J].China Vegetable,2013(10):84-89.
[3] 陈灵芝,张 茹 ,魏兵强,等.辣椒ToMMV的分子鉴定[J].中国蔬菜,2018(6):39-43.
CHEN L ZH,ZHANG R,WEI B Q,et al.Molecular identification of tomato mottle mosaic virus[J].China Vegetable,2018(6):39-43.
[4] 郭思瑶,童 艳,黄 娅 ,等.重庆辣椒病毒病病原初步鉴定和分析[J].园艺学报,2015,42 (2):263-270.
GUO S Y,TONG Y,HUANG Y,et al.Preliminary identification and analyses of viruses causing pepper virus disease in Chongqing China[J].Acta Horticulturae Sinica,2015,42 (2):263-270.
[5] 文朝慧,刘志杰,张丽萍,等.甘肃省河西地区辣(甜)椒病毒病毒原鉴定[J].中国蔬菜,2010(16):74-78.
WEN ZH H,LIU ZH J,ZHANG L P,et al.Identification of viruses infecting Capsicum annuum L. in Hexi area of Gansu province[J].China Vegetables,2010(16):74-78.
[6] 冯兰香,张宝玺,谢丙炎,等.3 种辣椒新病毒病的发生与血清学鉴定[J].中国蔬菜,2005(12):33-34.
FENG L X,ZHANG B X,XIE B Y,et al. Occurrence and serelogic detection of 3 new viruses from pepper[J].China Vegetables,2005(12):33-34.
[7] 刘 靖,王立浩,张正海,等. 北京地区辣椒病毒病发生情况调查[J].辣椒杂志,2016(1):48-50.
LIU J,WANG L H,ZHANG ZH H,et al. Analysis of hot pepper virus diseases in Bejing [J].Journal of China Capsicum,2016(1):48-50.
[8] 郑 敏. 辣椒轻斑驳病毒的鉴定及基因组分析[D]. 哈尔滨:东北林业大学,2013.
ZHENG M. Analysis of genome and identification of pepper mild mottle virus[D]. Harbin:Northeast Forestry University,2013.
[9] 張 强,张春竹,李克梅,等. 辣椒轻斑驳病毒(PMMoV)新疆加工型辣椒分离物的鉴定和致病型分析[J].中国农学通报,2014,30(25):296-302.
ZHANG Q,ZHANG CH ZH,LI K M,et al. Identification and pathotype analysis of pepper mild mottle virus in processing pepper from Xinjiang[J].Chinese Agricultural Science Bulletin,2014,30(25):296-302.
[10] 秦 蕾,梁 燕,默 宁,等.辣椒种质资源TMV抗性的鉴定与评价[J].中国蔬菜,2017(10):44-50.
QIN L,LIANG Y,MO N,et al.Identification and evaluation of resistance to TMV in pepper(Capsicum annuum L.)germplasm resources[J].Chinese Vegetable,2017(10):44-50.
[11] JACOBI V,BACHAND G D,HAMELIN R C,et al. Development of a multiplex immuno capture RT-PCR assay for detection and differentiation of tomatoand tobacco mosaic viruses[J].Journal of Virological Methods,1998,74:167-178.
[12] FILLMER K,ADKINS S,PONGAM P,et al.Complete genome sequence of a tomato mottle mosaic virus isolate from the United States[J].Genome Announcements,2015,3(2):e00167-15.
[13] HUDCOVICOV M,KORBELOV E,LIKOV S,et al.Molecular selection of tomato and pepper breeding lines possessing resistance alleles against tobamoviruses[J].Agriculture (Ponohospodárstvo),2015,61(1):33-37.
[14] YANG H B,LIU W Y,KANG W H,et al. Development of SNP markers linked to the L locus in Capsicum spp.by a comparative genetic analysis[J].Molecular Breeding,2009,24:433-446.
[15] TOMITA R,MURAI J,MIURA Y,et al.Fine mapping and DNA fiber FISH analysis locates the tobamovirus resistance gene L3 of Capsicum chinense in a 400-kb region of R-like genes cluster embedded in highly repetitive sequences[J].Theoretical and Applied Genetics,2008,117:1107-1118.
[16] 张宝玺,王立浩,张正海,等.甜椒 L3应对辣椒轻斑驳病毒及中椒系列新品种的选育[J].园艺学报,2020,53(18):3846-3855.
ZHANG B X,WANG L H,ZHANG ZH H,et al.Development of new varieties of ‘Zhongjiao pepper resistant to pepper mild mottle virus using L3 gene [J].Scientia Agricultura Sinica,2020,53(18):3846-3855.
[17] SUGITA T,YAMAGUCHI K,SUGIMURA Y,et al.Development of SCAR markers linked to L3 gene in Capsicum[J].Breeding Science,2004,54:111-115.
[18] 王立浩,車晋英,毛胜利,等. 辣椒分子育种研究新进展[J].辣椒杂志,2012(4):1-5.
WANG L H,CHE J Y,MAO SH L,et al.Review of molecular breeding research in hot pepper[J].Journal of China Capsicum,2012(4):1-5.
[19] 中华人民共和国农业部.辣椒抗病性鉴定技术规程第3部分:辣椒抗烟草花叶病毒病鉴定技术规程(NY/T 2060.3-2011)[S].北京:中国标准出版社,2011.
Ministry of Agriculture of the PRC.Rules for Evaluation of Pepper for Resistance to Diseases-part 3:Rule for Evaluation of Pepper for Resistance to Tobacco Mosaic Virus(NY/T 2060.3-2011)[S].Beijing:China Standard Press,2011.
[20] MARTINA H,ERIKA K,SVE-TLANA L,et al.molecular selection of tomato anf pepper breeding lines possessing resistance alleles against Tobamoviruses[J].Agriculture (Ponohospodá-rstvo),2015,61(1):33-37.
[21] KIM H J,HAN J H,YOO J H,et al.Development of a sequence characteristic amplified region marker linked to the L4 locus conferring broad spectrum resistance to tobamoviruses in pepper plants[J].Molecules and Cells,2008,25:205-210.
Abstract Based on material L15 which contained peper TMV resistance gene L3 ,and the pepper(Capsicum spp) germplasm resources were identified by three molecular markers associated with genetic linkage L3 ,which included 189D23MF,PMFR11 and PMFR21. L15,three infected materialsH8/H9/H11×L15 F1 ,and 46 accesions of pepper germplasms were artificially indoors inoculated with MTV, and its henotypic resistance was identificed and detected by RT-PCR.The results showed that marker 189D23MF didnt amplified any bands on L15 and 12 collections.PMFR11 amplified a 270 bp band on L15,280 bp on 46 collections,and resistant and susceptiable band differentiated clearly. PMFR21 amplified a single luminous and specific 200 bp band on L15 ,and there were no such band on 46 collections. L15 was highly resistant to TMV,and its F1 was resistant and moderately resistant.The common pepper resources were short of resistant TMV genes.In F1 and BC1P1 population,PMFR21 can be efficiently used for marker-assisted selection(MAS)of pepper breeding for resistance to TMV.
Key words Capsicum spp;L3 gene;Marker;Resources;Tobacco mosaic virus
