纳米胶束中阿霉素和槲皮素含量测定方法的建立
2023-06-04朱姣姣郭秀春陈云龙邓勇彭先飞周丕俊蒲晓辉
朱姣姣,郭秀春,陈云龙,邓勇,彭先飞,周丕俊,蒲晓辉
河南大学 药学院,河南 开封475004
阿霉素(doxorubicin,DOX)是一种广泛应用于肿瘤临床治疗的广谱抗肿瘤药。但是,因其毒副作用大且具有心脏毒性及较高的耐药性,从而限制了DOX 的临床使用[1]。研究表明,通过酰胺键将亲脂性阳离子三苯基膦(triphenylphosphine,TPP)结合到抗肿瘤药物DOX 上形成小分子结合物TPPDOX,不仅具有良好的线粒体靶向功能,而且增强了DOX 的抗肿瘤活性,有效克服肿瘤多药耐药(multidrug resistance,MDR)[2],对乳腺癌、结直肠癌等均有比较好的效果[3]。
槲皮素(quercetin,Que)是一种天然黄酮[4],具有抗炎、抗氧化、抗菌、抗肿瘤[5-7]等药理作用。除此之外,Que还具有免疫调节作用,主要是基于能抑制肿瘤坏死因子TNF-α和白细胞介素IL-1β等促炎因子的分泌,以此来减轻炎症反应,提高机体免疫力。相关研究[8]表明,Que具有良好的逆转多药耐药性的作用,主要是可以降低多药耐药相关蛋白过度表达的肿瘤细胞对肿瘤药物的外排作用。Que也可通过下调肿瘤耐药相关分子P-gp、BCRP、MRP1等的表达,抑制化疗药物的外排而逆转肿瘤MDR[9]。Zieleniecki J L[10]等人通过实验发现,Que能明显的增强KB-MRP 细胞内DOX 的荧光强度,并且Que大大降低了MRP1过度表达所导致的肿瘤多药耐药。Que对四氯化碳诱导的肝损伤具有治疗解毒作用[11]。
TPP-DOX 有线粒体靶向功能,具有良好的抗肿瘤活性,但单一用药治疗肿瘤细胞常常会引起机体耐药性问题,继而对其治疗效果产生影响。Que因为其自身的抗耐药作用,作用于耐药细胞MCF-7/ADR,通过抑制P 糖蛋白的表达,可以剂量依赖性抑制DOX 外排,逆转DOX 的多药耐药性。由此可见,联合用药可以在一定程度上缓解肿瘤细胞多药耐药的问题。近年来,很多学者将Que和DOX联用用于各种癌细胞的耐药性研究,结果均表明将Que和DOX 联用可显著增强抗癌效果[12-14]。DOX和Que通过联合用药,既能提高Que的生物利用度,又能实现药物在肿瘤组织的同时靶向,降低DOX 的毒性,有效逆转药物对肿瘤细胞的耐药性。
本课题组在前期制剂研究中,先设计合成了具有还原敏感性且良好生物相容性的两亲性嵌段共聚物聚乙二醇单甲醚-去氧胆酸-二硫键-聚天冬氨酸苄酯(m PEG-DCA-SS-nps,简称MDSP),以及无还原敏感性的对比聚合物聚乙二醇-去氧胆酸-丁二酸酐-聚天冬氨酸苄酯(m PEG-DCA-CC-nps,简称MDCP),再以MDSP和MDCP为材料,选用TPP-DOX和Que作为模型药物,制备共载TPP-DOX 和Que的纳米胶束MDSP-TD-Que和MDCP-TD-Que,联合应用于肿瘤的治疗。本文目的旨在建立测定纳米胶束中TPP-DOX 和Que的含量测定方法,并应用于纳米胶束的载药量和包封率测定,以便为纳米胶束的质量控制提供有效的分析方法。
1 仪器与试药
1.1 实验仪器
紫外可见光分光光度计(UV-2600,日本岛津公司);高效液相色谱仪(Waters 2695-2489型,,上海沃特世科技有限公司);精密酸度计(PHS-3C 型,杭州美尼特自动化仪表有限公司),超声波清洗仪(AS3120,北京泰元达精密清洗机)。
1.2 实验材料
阿霉素(批号:JZ19122710,上海易恩化学技术有限公司),槲皮素(批号:JZ1706201,陕西晨明生物科技有限公司),色谱甲醇(批号:S00722-081089,苏州欧特化工有限公司),磷酸(批号:20191104,天津市德恩化学试剂有限公司);冰乙酸(批号:20160328,成都瑞芬思科技有限公司),MDSP、MDCP聚合物材料(实验室自制),TPP-DOX(实验室自制),三乙胺(批号:20160805,南京绿点化工有限公司)。
2 方法与结果
2.1 纳米胶束的制备
采用溶剂挥发法制备以MDSP和MDCP 为材料的共载TPP-DOX 和Que的混合纳米胶束MDSP-TD-Que和MDCP-TD-Que。精密称取10 mg聚合物材料和1 mg药物(TPP-DOX 和Que为1∶1),用1m L甲醇+1m L丙酮使其完全溶解,将其缓慢滴加到盛有15 mL 超纯水的小烧杯中,以1 900 r∙min-1的转速搅拌搅拌直至有机溶剂挥发完全,用超声波细胞粉碎机处理,离心后收集上清液,即得胶束溶液。
2.2 检测波长的选择
精密量取40 mg TPP-DOX,10 mg Que,10 mg MDCP,10 mg MDSP溶解于色谱甲醇中,用超声法将其完全溶解后稀释成合适浓度的样品,用微孔无菌滤膜过滤,取续滤液作为供试品溶液。用纯甲醇溶液作为空白对照,在200~600 nm 波长范围内对供试品溶液进行紫外扫描,考察载体材料MDSP、MDCP以及药物TPP-DOX 和Que的紫外吸收情况,扫描图谱如图1所示。

图1 载体材料与游离药物的紫外扫描图谱
由图1可知,在设定的扫描波长200~600 nm之间,TPP-DOX 在480 nm 处有最大吸收峰,Que的最大吸收峰在373 nm,而载体材料MDSP 和MDCP在373 nm 和480 nm 处无吸收峰。因此,本实验选用480nm 作为TPP-DOX 的最佳紫外吸收波长,373 nm 作为Que的最佳紫外吸收波长,同时可避免载体材料的干扰。刘慧娜[2]利用紫外分光光度计在200~800 nm 范围内对TPP-DOX 进行波长扫描,也发现TPP-DOX 在480nm 处有最大吸收。这与本文通过紫外波长扫描所确定的TPP-DOX 的检测波长一致,均为480 nm。
2.2 HPLC的色谱条件
色谱柱:Hypersil C18 色谱柱(250×4.6 mm,5 μm);流动相:以纯甲醇为流动相A,以0.3%磷酸水溶液(p H 3.0)为流动相B,梯度洗脱(0~9 min,60%A,检测波长λ=373 nm;9~10 min,60%A→80%A;10~15 min,80%A,检测波长λ=480 nm);流速:1.0 mL·min-1;柱温:30 ℃;进样量:20μL。
2.3 专属性实验
称取TPP-DOX和Que各50 mg,用色谱甲醇溶解至适宜浓度,0.22μm 有机滤膜过滤,按照2.2项下的色谱条件进样,记录色谱图,结果如图2所示。

图2 TPP-DOX(A)和Que(B)的高效液相色谱图
从图2可知,TPP-DOX 的保留时间t=10.634 min,Que的保留时间t=8.461 min,专属性良好。
2.4 标准曲线的建立
精密称取5 mg TPP-DOX置于25 mL 容 量瓶中,先用少量甲醇溶解,再用甲醇定容至刻度得到0.2 mg∙m L-1的TPP-DOX 储备液。用移液管精密量取10 mL 的储备液,置于25 mL 容量瓶中,甲醇定容至刻度,得到浓度为0.08 mg∙m L-1的TPP-DOX 母液。再用甲醇将母液分别稀释成 浓度为2、4、8、16、32、64μg∙m L-1的溶液,按照2.2 项下的色谱条件进样,记录相应的峰面积。以进样浓度(X)为横坐标,TPPDOX 的峰面积(Y)为纵坐标进行线性回归,得到TPP-DOX 的线性回归方程,结果见图3(a)。

图3 TPP-DOX(a)和Que(b)的标准曲线图
精密称取10 mg Que置于50 mL容量瓶中,先用少量甲醇溶解,再用甲醇定容至刻度得到0.2 mg∙m L-1的Que储备液。用移液管精密量取12.5 mL储备液,置于50 mL 容量瓶中,甲醇定容至刻度,得到浓度为0.05 mg∙m L-1的Que母液。再用甲醇将母液分别稀释成浓度为0.5、1、2、4、5、10、20、40μg∙m L-1的溶液,按照2.2项下的色谱条件进样,记录相应的峰面积。以进样浓度(X)为横坐标,Que的峰面积(Y)为纵坐标进行线性回归,得到Que的线性回归方程,结果见图3(b)。
如图3所示,横坐标X 代表药物浓度,纵坐标Y 代表峰面积,再通过峰面积Y 对浓度X 进行线性回归,最终得到TPP-DOX 的线性回归方程为:Y=4153.3x+8505.2(R2=0.9999),线性范围为2~64 μg∙m L-1。Que的线性回归方程Y=81 230 x-23 677(R2=0.999 9),线性范围为0.5~40 μg∙m L-1。结果表明,结果表明:在线性范围内TPP-DOX 和Que的色谱峰面积与浓度具有良好的线性关系。
2.5 精密度实验
分别配制浓度为16μg∙mL-1的TPP-DOX和20 μg∙mL-1的Que溶液6等份,在2.2条件下分别进样20μL,分别在日内及日间对其重复测定,考察精密度,然后记录所测得的色谱峰面积,并通过2.4项下所得的线性方程计算浓度,最后计算出其日内和日间的相对标准偏差(RSD)值,具体数据见表1。
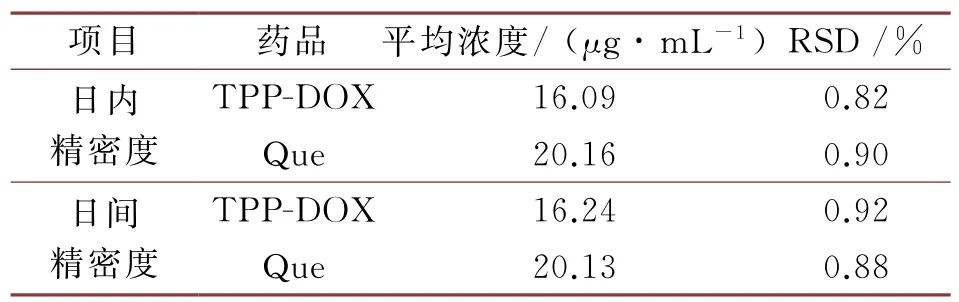
表1 TPP-DOX和Que日内和日间精密度结果(n=6)
经计算得出,TPP-DOX 和Que 溶液的日内RSD 分别为0.82%,0.90%(n=6),日 间RSD 分 别为0.92%,0.88%(n=6),RSD 均小于1%,结果表明高效液相色谱法检测TPP-DOX 和Que浓度的精密度良好,符合《中国药典》2020版的规定。
2.6 稳定性实验
分别取浓度为16 μg∙m L-1的TPP-DOX溶液和20μg∙m L-1的Que溶液,分别在室温下放置2、4、6、8、10、12 h后,在2.2 条件下分别进样20μL,测定其相应的色谱峰面积,将结果带入2.4项下所得的线性回归方程中,计算其RSD 值,具体数据见表2。

表2 不同时间内TPP-DOX和Que稳定性结果(n=3)
通过对中间浓度TPP-DOX 和Que在不同时间段2、4、6、8、10、12 h 内的稳定性进行考察,其RSD 值均小于1%,结果表明该方法具有较好的稳定性。
2.7 方法回收率实验
分别取浓度为2μg∙m L-1、16μg∙m L-1、32 μg∙m L-1的TD溶液和2 μg ∙m L-1、20 μg∙m L-1、40μg∙m L-1的Que溶液,每个浓度平行三份,在2.2条件下分别进样20μL,测定其相应的色谱峰面积,带入2.4项下所得的线性回归方程中,计算TPP-DOX 和Que浓度,最后计算回收率及RSD 值,具体数据见表3。

表3 TPP-DOX和Que不同浓度的方法回收率实验(n=3)
结果如表3所示,TPP-DOX 和Que在低、中、高三个不同浓度的方法回收率在98.21~101.43之间,均符合药典规定,RSD 值均小于0.5%,结果表明回收率良好。
2.8 加样回收率实验
精密称取10 mg载体材料MDCP、MDSP,按照制备的制剂含量的80%、100%、120%加入DOX 原料药和Que原料药,用适量色谱甲醇溶解,在2.2条件下分别进样20μL,测定其相应的色谱峰面积,带入2.4项下所得的线性回归方程中,计算TPP-DOX和Que浓度,最后计算回收率及RSD 值,具体数据见表4。

表4 加样回收率结果(n=3)
如表4所示,TPP-DOX 和Que的加样回收率在98.7%~101.6%之间,RSD 值均小于2%,方法回收率较好,符合规定要求。
2.9 载药量和包封率测定
用移液管精密量取SP-TD-Que、CP-TD-Que纳米胶束溶液置于10 mL容量瓶内,用色谱甲醇定容至刻度,将容量瓶于超声中冰浴处理20 min,经0.45μm 滤膜过滤后,取续滤液20μL,在2.2条件下注入HPLC,记录峰面积,所得峰面积代入2.4项下所得的回归方程,计算各个胶束溶液的浓度,再利用下述公式计算胶束中TPP-DOX 和Que的载药量(LC%)和包封率(EE%)。测得胶束中TPP-DOX和Que载药量与包封率见表5。

表5 两种混合纳米胶束中TPP-DOX和Que载药量和包封率测定结果(n=3)
由表5可知,SP-TD-Que和CP-TD-Que纳米胶束中TPP-DOX 和Que的包封率均在30%以上,载药量均在1.00%以上。
3 讨论
DOX 在临床上具有疗效好、抗瘤谱较广等优点,但是其毒副作用较强,易引起MDR。而Que不仅能抑制促炎因子的分泌,减少炎症反应的发生,提高机体的免疫力;还能抑制肿瘤细胞增殖,逆转MDR 活性。但是Question水溶性差,与DOX 联用还存在体内药物动力学不同步等问题[15]。本课题组制备的MDSP-TD-Que和MDCP-TD-Que混合纳米胶束,通过联合载药,即提高Que的生物利用度,充分发挥其抗耐药作用,而且能抑制细胞药物的外排,促使更多的TPP-DOX 聚集在线粒体内。
目前DOX 和Que的含量测定方法很多,有高效液相色谱法、荧光光谱法、薄层荧光扫描法、紫外分光光度法、放射免疫法、高效毛细管电泳法、气相色谱法等[14-17]。其中,最为广泛和普遍的方法就是高效液相色谱法(HPLC)。在高效液相色谱法检测过程中,影响方法灵敏性和精确性的关键是流动相和检测波长的选择。本文中选择的流动相为甲醇-磷酸水溶液,其中加入磷酸溶液是为了避免色谱峰拖尾。在流动相中加入冰醋酸也可以有效防止DOX 解离,避免色谱峰拖尾,但是冰醋酸不能加入过多,否则会使阿霉素峰形变宽[16]。陈浩等[14]在测定定复方脂质体中阿霉素与槲皮素的含量时采用的流动相是甲醇-乙腈-p H 3.8磷酸缓冲盐(19∶29∶52)等度洗脱,检测波长为254 nm。
本文中选择的检测波长是双波长,即DOX的检测波长为480 nm,而Que的检测波长为373 nm。本文检测波长的确定是通过紫外扫描,发现TPP-DOX在480 nm处有最大吸收峰,Que的最大吸收峰在373 nm。刘慧娜利用紫外分光光度计在200~800nm 范围内对TPP-DOX进行波长扫描,也发现TPP-DOX在480 nm处有最大吸收[2]。这与本文通过紫外波长扫描所确定的TPP-DOX的检测波长一致,均为480 nm。张志坤等利用紫外分光光度计在200~600 nm 范围内对Que进行波长扫描,发现Que在374 nm 处有最大吸收[17]。这与本文通过紫外波长扫描所确定的Que的检测波长极为接近,为373 nm。
本文首先利用紫外分光光度计对载体材料MDSP和MDCP和药物TPP-DOX 和Que进行全波长扫描,确定了TPP-DOX 和Que的最佳吸收波长在480 nm 和373 nm,其材料无干扰。然后,采用HPLC法建立了同时测定混合纳米胶束中TPPDOX 和Que的含量测定方法。通过对色谱条件进行优化,最终确定流动相使用甲醇(A)-0.3%磷酸水溶液(p H 3.0,B)梯度洗脱(0~9 min,60%A,检测波长λ=373 nm;9~10 min,60%A→80%A;10~15 min,80% A,检测波长λ=480 nm)时,可以较好改善拖尾现象。
在线性范围内建立了TPP-DOX 和Que的标准曲线,有较好的线性关系,对其方法的专属性、精密度、回收率进行考察,结果表明,在设定的浓度范围内建立的含量测定方法较简便、专属性较好、准确度较高,可以用作纳米胶束MDSP-TD-Que和MDCP-TD-Que2中TPP-DOX 和Que的含量测定。
