云杉叶枯病新病原的鉴定及其生物学特性测定
2023-06-02李柘柘崔凌霄魏立娟金梦军杨成德
李柘柘,崔凌霄,魏立娟,金梦军,马 婷,杨成德
(甘肃农业大学 植物保护学院/甘肃省农作物病虫害生物防治工程实验室,兰州 730070)
云杉(Piceaasperata)是中国特有的云杉属森林树种[1],为高大常绿乔木,多在山地形成水源涵养林[2],是北方针叶林的特征种。云杉属植物可用作建筑、乐器和造纸等[3-5],也是很受欢迎的绿化和园艺观赏树木[6]。然而,云杉病害降低了云杉的经济和生态价值。云杉育苗期的病害主要有立枯病(Rhizoctoniasolani)、灰霉病(Botrytiscinerea)和雪枯病(Lophophacidiumhyperboreum);成林云杉的病害主要有叶锈病(Chrysomyxaspp.)、叶疫病(Rhizosphaerakalkhoffii)、球果锈病(Thekopsoraareolata)和立木腐朽病(Trametespubescens)。
云杉叶枯病是一种叶部病害,植株被感染后针叶枯萎,造成巨大的经济损失。袁自清[7]报道了一种云杉叶枯病症状,受感染针叶褪绿变枯黄色,枯死后不脱落,枯死的针叶上埋生有黑色小点;在江西省发现针叶上出现褐色病斑的叶枯病[8],病斑周围有半透明环带,老叶上病斑颜色比新叶要深;Janosikova-Heckova等[9]观察到一种云杉叶枯病症状,被侵染的针叶上有红色或棕色条带,针头枯死呈红棕色,针叶上有黑色的子实体。2020年在甘肃省天水市调查时,发现一种症状与已报道略有差别的云杉叶枯病,发病部位呈深黄色,病健交界处呈黑色,病斑逐渐向外扩展,最后整片针叶变黄脱落。枯死针叶表面出现黑点,湿度大时叶基部和枝条被白色菌丝层覆盖(图1-A)。因此,本试验对其进行了病原菌分离、鉴定、致病性和生物学特性测定,以期为云杉叶枯病的诊断和科学防控提供理论依据。

A.从森林中采集的云杉病叶;B.用菌株SJ1接种离体枝条针叶的症状;C.用无菌水接种离体枝条针叶的对照;D.用菌株SJ1接种活体枝条针叶出现症状;E.用无菌水接种活体枝条针叶的对照
1 材料与方法
1.1 云杉叶枯病菌的分离与致病性测定
采用组织分离法对收集自甘肃省天水市林区具有典型叶枯病症状的云杉针叶进行分离,从病健交界处切下长1 cm的针叶组织,用75%的乙醇消毒30 s,用无菌水冲洗3次后在无菌滤纸上干燥,然后将它们置于马铃薯葡萄糖琼脂(PDA)培养基上,25 ℃避光培养3~5 d,经单菌落分离纯化后, 4 ℃储存,备用。
通过柯赫氏法则进行致病性测定。先用接种离体植物的方法进行致病性试验[10]。用75%的乙醇对离体健康的枝条进行消毒,无菌水洗涤,风干后使用。将枝条放置在覆盖有两张无菌滤纸的培养皿中,树枝柄部用无菌棉包裹,滤纸和无菌棉用无菌水保持湿润。每个处理和对照都在单独的树枝上和培养皿中进行,接种前用无菌昆虫针轻轻刺破每个针叶的角质层,将培养5 d的分离物菌丝或孢子悬浮液喷洒在刺破的针叶上,对照喷洒无菌水。所有接种和对照处理在25 ℃的培养箱中12 h光照和12 h黑暗交替培养,观察发病情况,叶枯病出现后重新分离,3次重复。对离体树枝上针叶造成叶枯病的分离物用相同的方法接种于活体云杉上再次进行致病性测定,同样每个处理和对照都在单独的树枝上进行,喷撒悬浮液和无菌水后用塑料袋保湿48 h[11],观察发病情况并进行再分离,重复3次。
1.2 病原菌鉴定
1.2.1 形态学鉴定 将菌株接到PDA培养基中心,25 ℃避光培养,观察菌落形态和色素颜色,然后在光学显微镜下观察分生孢子的形状和大小,至少随机选择50个分生孢子测量大小。
1.2.2 分子生物学鉴定 按公司说明书使用HP真菌DNA试剂盒D3195(Omega Bio-Tek,中国)提取病原菌基因组DNA,DNA样品于 -20 ℃保存,备用。使用核糖体RNA序列(ITS)、β-微管蛋白(TUB2)基因[12]和RNA聚合酶Ⅱ第2大亚基(RPB2)基因[13]进行PCR扩增。PCR在含有1 μL DNA模板、上下游引物各 1 μL、12.5 μL 2×Easy-TaqPCR Super Mix(中国天启基因生物技术有限公司)、9.5 μL ddH2O2的25 μL反应体系中进行。扩增引物如表1所示,引物由天启基因生物技术有限公司合成。
ITS基因序列的扩增程序为95 ℃预变性3 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸 1 min,30个循环,72 ℃延伸10 min。TUB2基因序列的扩增程序为94 ℃预变性5 min,94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min,34个循环,72 ℃延伸7 min。RPB2基因序列的扩增程序为94 ℃预变性2 min,94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸30 s,35个循环,72 ℃延伸 2 min。
PCR扩增产物经1%琼脂糖凝胶电泳检测后,送天启基因生物技术有限公司进行测序。测序结果与NCBI核苷酸数据库中的已知序列进行BLAST比对,并下载已知的同源序列。将测序结果提交至GenBank获取登录号。采用MEGA 7.0中的邻接法构建系统发育树,并进行1 000次bootstrap测试,计算系统发育树中节点的置信度。
1.3 病原菌生物学特性测定
1.3.1 供试培养基 参考董汉松[14]的方法,配制马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基、虎红琼脂(rose bengal agar,RBA)培养基、胡萝卜琼脂(carrot agar,CA)培养基、马铃薯蔗糖琼脂(potato sucrose agar,PSA)培养基、麦芽浸粉琼脂(malt extract agar,MEA)培养基、察氏(Czapek agar,CZA)培养基、水琼脂(water agar,WA)培养基、马铃薯胡萝卜琼脂(potato carrot agar,PCA)培养基和燕麦片琼脂(oatmeal agar,OMA)培养基。
1.3.2 培养基对菌丝生长的影响 配制9种供试培养基。用直径为0.5 cm的无菌打孔器取供试菌株的菌饼,接入到培养基中央,再放入培养箱,25 ℃黑暗培养6 d,重复3次。用十字交叉法测量菌落直径。
1.3.3 温度对菌丝生长的影响 温度条件为5、10、15、20、25、30、35和40 ℃,将菌饼接入最适培养基中央,培养箱中黑暗培养6 d,其他同“1.3.2”。
1.3.4 pH对菌丝生长的影响 用0.1 mol/L的NaOH和HCl调pH,选择4.0、5.0、6.0、7.0、8.0、9.0、10.0和11.0共8个梯度,将菌饼接入不同pH的最适培养基中央,25 ℃黑暗培养6 d,其他同“1.3.2”。
1.3.5 光照对菌丝生长的影响 将病原菌菌饼接入到最适培养基中央,分别在12 h光照和12 h黑暗交替、全光照和全黑暗的培养箱中25 ℃恒温培养6 d,其他同“1.3.2”。
1.3.6 碳、氮源对菌丝生长的影响 以CZA培养基为基础培养基和对照,替换其中的碳、氮源。供试碳源为:蔗糖、葡萄糖、麦芽糖、淀粉、木糖、果糖、阿拉伯糖和乳糖。氮源为:硝酸钠、蛋白胨、甘氨酸、脯氨酸、氯化铵、硫酸铵、尿素、亮氨酸、硝酸铵和苯丙氨酸。制作不同的碳、氮源培养基(对照的碳、氮源为蔗糖和硝酸钠),将病原菌接入到培养基中央,25 ℃黑暗培养6 d,其他同“1.3.2”。
2 结果与分析
2.1 病原菌的分离和致病性测定
根据菌落形态,获得5株真菌分离物,编号为SJ1-SJ5。通过将菌丝体悬浮液(来自培养5 d的分离物SJ1)和分生孢子悬浮液(每毫升含106个分生孢子,来自培养5 d的分离物SJ2-SJ5)喷洒在离体枝条的针叶上来进行接种。在7 d内,只有接种了SJ1的针叶表现出与最初从森林中采集的样本相似的症状,而对照和接种其他分离物的针叶不发病(图1-B,1-C)。接种SJ1的针叶在活体植株上7 d内出现上述典型症状,针叶上出现病斑,之后逐渐扩展,针叶变黄和枯萎,最终从树上脱落,对照不发病(图1-D,1-E)。从接种后发病的针叶中重新分离,得到与菌株SJ1菌落特征相同的分离物,证实SJ1是云杉叶枯病的病原物。
2.2 病原菌鉴定
2.2.1 形态学鉴定 将SJ1在PDA培养基上培养,初期菌丝呈白色絮状,然后由红橙色变为深黄褐色,培养后期出现气生菌丝,菌落表面出现红黑色液滴,背面为红橙色(图2-A,2-B)。分生孢子黑色,扁圆形或近球形,表面有褶皱,未成熟的分生孢子有淡色的柄细胞,大小为12.10 μm~ 28.82 μm×11.58 μm~16.66 μm(n=50)(图2-C)。

A.菌落正面;B.菌落反面;C.分生孢子(标尺=20 μm)
2.2.2 分子生物学鉴定 提取SJ1的基因组DNA,用引物扩增核糖体RNA序列(ITS)、β-微管蛋白(TUB2)和RNA聚合酶Ⅱ第2大亚基 (RPB2)基因,分别得到大小为545、347和939 bp的基因片段,所得序列上传至GenBank中(登录号 MW725153、MW751459 和 MW788323)。
在与GenBank中的序列进行BLAST比较后构建系统发育树,SJ1的ITS、TUB2和RPB2的基因序列与黑附球菌Epicoccumnigrum(GenBank登录号 MW227323、 MW186822和MW186823)的基因序列同源性分别为100%、 98.36%和99.79%,使用MEGA 7.0邻接法对3个基因联合进行系统发育分析,发现菌株SJ1与菌株E.nigrum聚在一起(图3)。根据形态学[15]和分子生物学特征,SJ1被鉴定为黑附球菌(Epicoccumnigrum)。
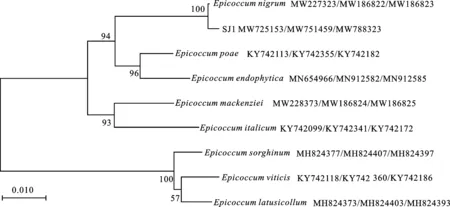
图3 菌株SJ1基于 ITS、 TUB2和 RPB2基因联合构建的多位点系统发育树Fig.3 Multilocus phylogenetic tree constructed with ITS, TUB2 and RPB2 genes of strain SJ1
2.3 生物学特性
2.3.1 培养基对菌丝生长的影响 黑附球菌SJ1在9种供试培养基上均能生长,最适菌丝生长的为MEA培养基,菌落直径达5.78 cm,显著大于其他培养条件(P<0.05),而在CZA培养基上生长最慢,菌落直径仅3.57 cm。在PCA和OMA培养基上气生菌丝较稀疏,在WA培养基上基本不生长,而在其余培养基上气生菌丝生长繁茂(图4)。
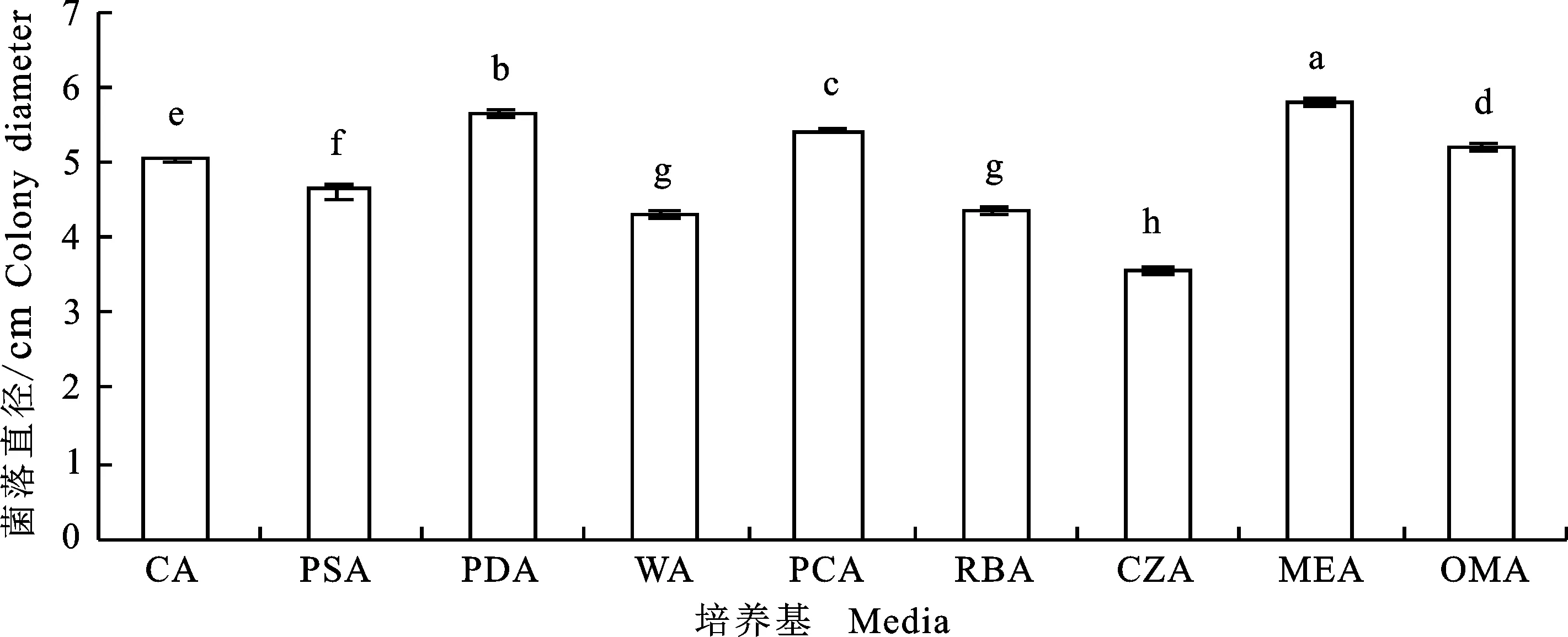
不同小写字母表示差异显著(P<0.05)。下同
2.3.2 温度对菌丝生长的影响 黑附球菌SJ1在10到30 ℃下均能生长且气生菌丝繁茂,在 35 ℃下基本不生长,而在5 ℃和40 ℃时菌落不生长。从10 ℃到25 ℃,菌落直径逐渐增大,在25 ℃时菌落直径显著大于其他温度条件(P< 0.05),从25 ℃到30 ℃,菌落直径减小,说明 25 ℃为菌丝最适生长温度(图5)。
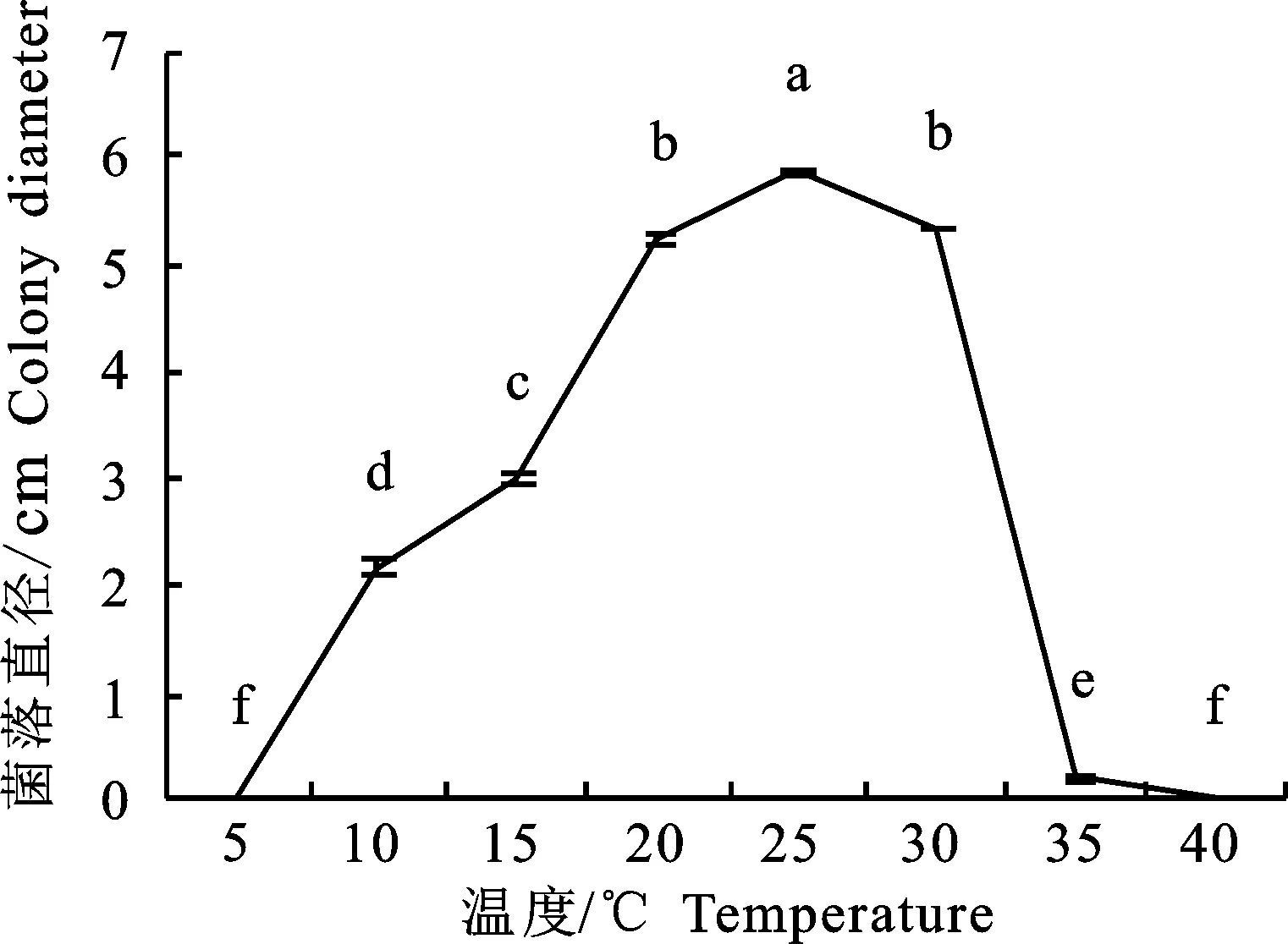
图5 SJ1菌丝在不同温度的生长情况Fig.5 Effect of temperature on mycelial growth of E.nigrum SJ1
2.3.3 pH对菌丝生长的影响 黑附球菌SJ1在pH为4到11范围内均能生长且气生菌丝繁茂。pH为4时生长最慢,菌落直径为5.68 cm。pH由4到7时,菌落直径逐渐变大,在pH为7时菌落直径最大,菌落直径达6.95 cm,pH由7到11时,菌落直径逐渐变小。说明在过酸和过碱条件菌丝生长均会受到抑制(图6)。
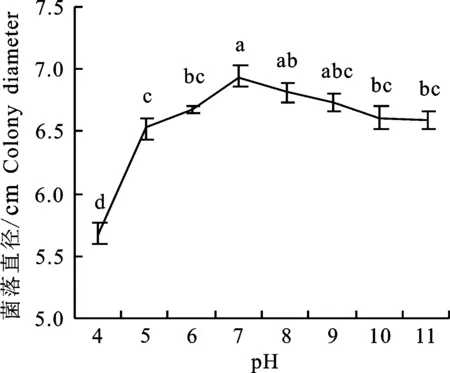
图6 不同pH下SJ1菌丝的生长Fig.6 Effect of pH on mycelial growth of E.nigrum SJ1
2.3.4 光照对菌丝生长的影响 黑附球菌SJ1在不同光照下均能生长且气生菌丝繁茂,12 h光照和12 h黑暗交替培养条件最适菌丝生长,菌落直径达5.63 cm,全黑暗条件下菌丝生长最慢,菌落直径为5.27 cm。各光照条件下差异不显著(图7)。
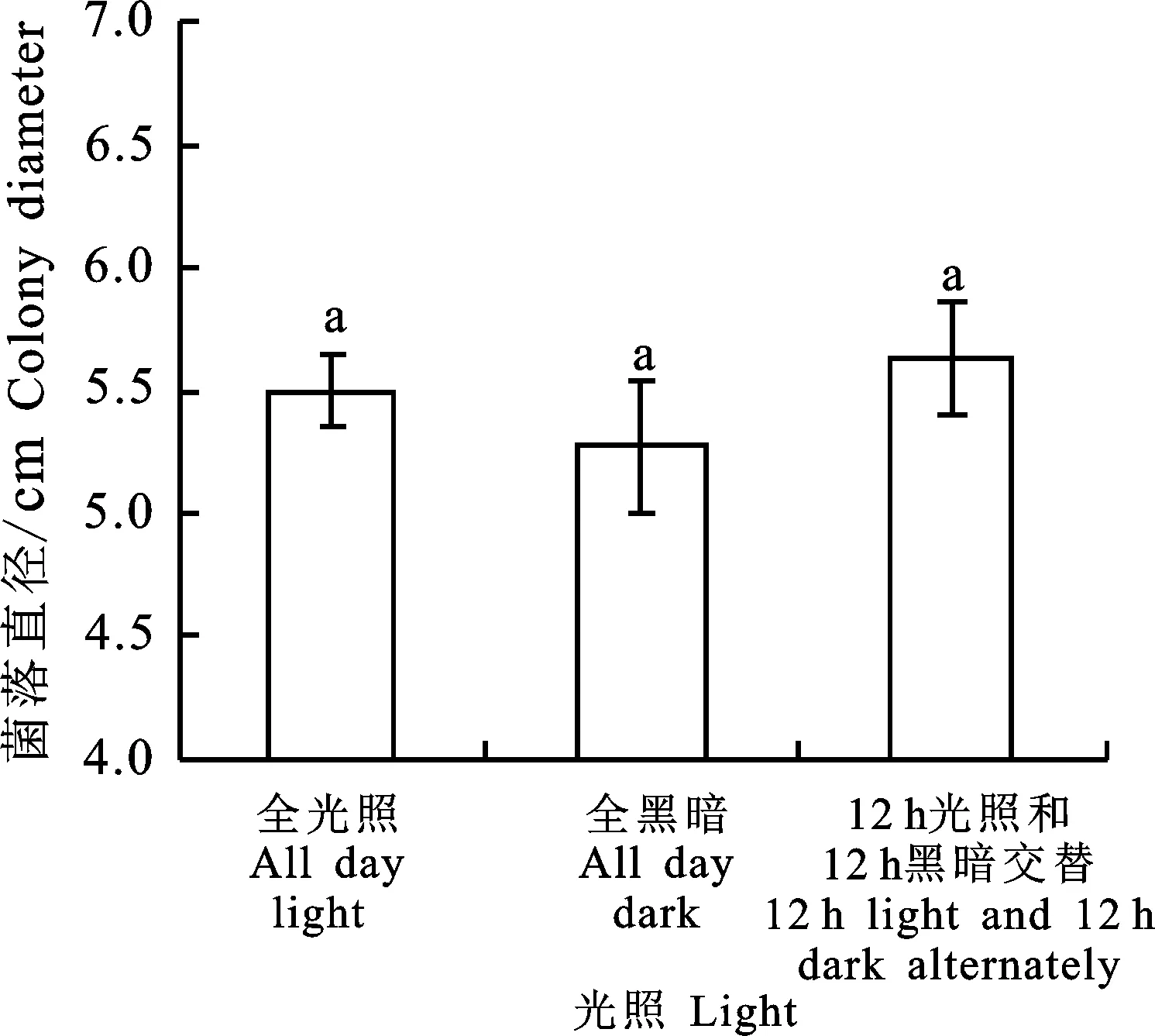
图7 SJ1菌丝在不同光照处理的生长状况Fig.7 Effect of light on mycelial growth of E.nigrum SJ1
2.3.5 碳源对菌丝生长的影响 黑附球菌SJ1在不同碳源下均能生长,但碳源为乳糖和淀粉时气生菌丝较稀疏,为其余碳源时气生菌丝繁茂;碳源为淀粉时菌丝生长最快,菌落直径达 5.12 cm,为麦芽糖时生长最慢,菌落直径仅3.90 cm,除麦芽糖外的其余碳源均对菌丝生长有促进作用 (图8)。
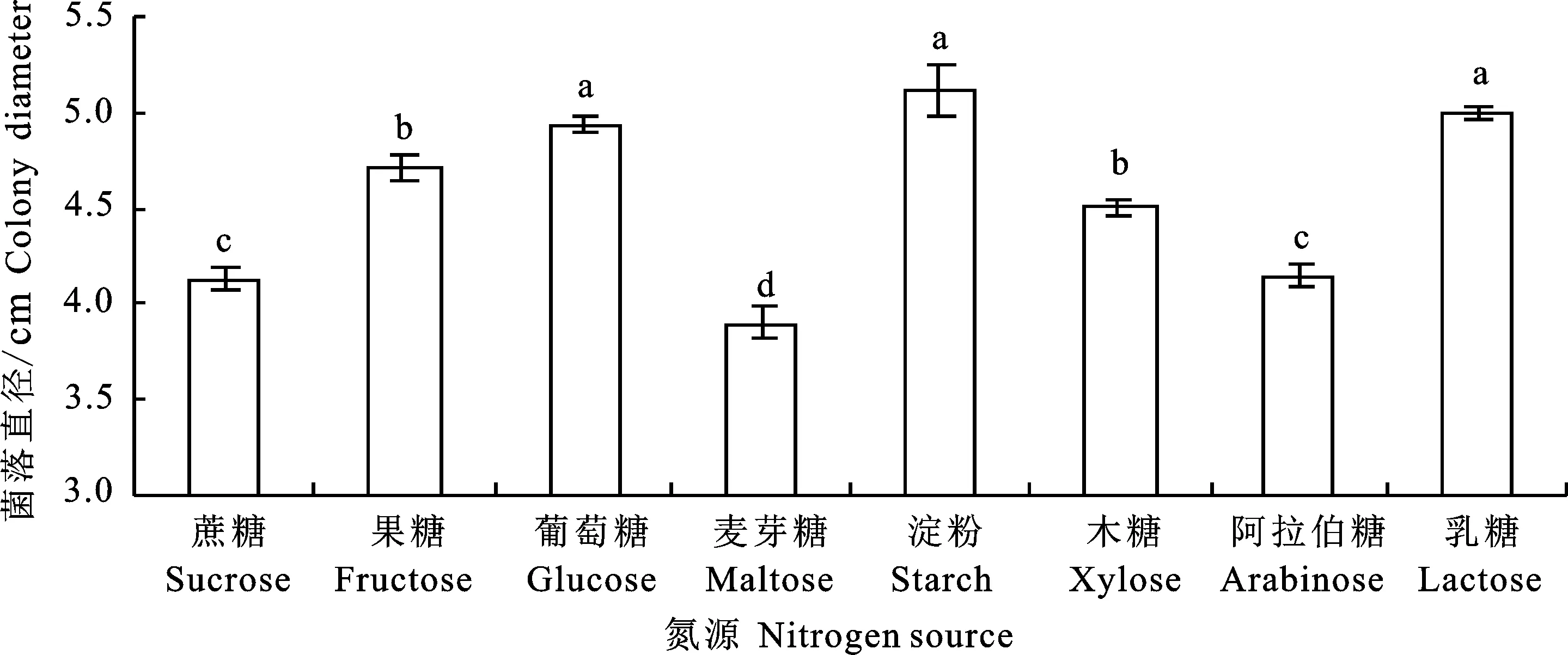
图8 不同碳源下SJ1菌丝的生长Fig.8 Effect of carbon source on mycelial growth of E.nigrum SJ1
2.3.6 氮源对菌丝生长的影响 黑附球菌SJ1在氮源为尿素时不生长,其余氮源条件下均能生长,但氮源为亮氨酸和蛋白胨时气生菌丝较稀疏,为其余氮源时气生菌丝繁茂;氮源为蛋白胨时生长最快,菌落直径达5.15 cm,且与对照差异显著(P<0.05),除氮源为蛋白胨外,其余氮源均对菌丝有抑制作用(图9)。
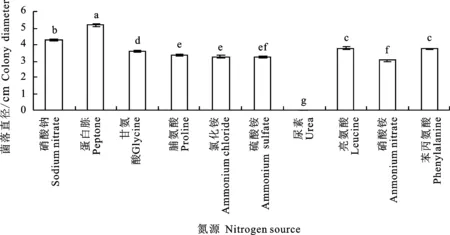
图9 不同氮源下SJ1菌丝的生长Fig.9 Effect of nitrogen source on mycelial growth of E.nigrum SJ1
3 讨论与结论
叶枯病导致云杉针叶的枯萎和病变,在本研究中发现一种新的云杉叶枯病病害,通过形态学和多位点序列分析,结合柯赫氏法则验证,最终确定云杉叶枯病的病原菌为黑附球菌。袁自清[7]发现云杉巴氏腔孢(Barriapiceae)可引起云杉叶枯病,在江西省报道了一种由杉木假单孢杆菌(Pseudomonascunninghamiaesp.nov.)引起的叶枯病[8],Janosikova-Heckova等[9]观察到的云杉叶枯病是由Dothistromaseptosporum引起的,由黑附球菌造成的云杉叶枯病为首次报道。
黑附球菌多分布于空气和土壤中,其代谢产物有抗菌和抗生物膜活性作用[16],但其也可引起茶树褐斑病[17]、水稻穗褐变病[18]和豇豆叶斑病[19]等植物病害,而作为一种危害云杉的新病原,研究其生物学特性对其防治有着重要意义。SJ1在PDA培养基上培养后期菌落中央呈黄褐色,菌落形态与引起水稻穗褐变病的黑附球菌落相似[18],而王俊丽等[20]从火龙果茎中分离得到的黑附球菌落中央呈浅黄白色,这可能与病原菌寄主不同有关。本研究发现黑附球菌菌丝可有效利用多种碳、氮源,最适碳源为淀粉,与Beverly等[21]的研究结果一致,最适氮源为蛋白胨,碳源为麦芽糖时生长最慢,而在氮源为尿素时不生长,这为其防治提供了有益的思路。
本研究对云杉叶枯病病原进行了分离、鉴定和生物学特性测定,为云杉叶枯病的诊断和防治提供技术参考。但作为新病害,其流行规律、致病机制及综合防治方法等还需进一步研究。
