ABC 转运蛋白与类风湿关节炎甲氨蝶呤治疗耐药关系的研究进展
2023-06-02张倩吕天琦黄华闻钦文邬秀娣郑建萍
张倩 吕天琦 黄华 闻钦文 邬秀娣 郑建萍
类风湿关节炎(rheumatoid arthritis,RA)是一种慢性系统性自身免疫疾病,主要特征是手部、足部等小关节的对称性疼痛和肿胀,长期慢性炎症控制不当时,会造成关节结构不可逆转的损伤。目前,RA 患病率占世界总人口数的0.5%~1.0%[1]。RA 患病情况存在明显的性别差异,女性患病概率是男性的2~3 倍[2]。RA 致残率与病程有关,中国类风湿关节炎2019 年年度报告显示,患者病程>15 年,致残率达61.25%[3]。目前治疗RA 的方式可分为西医治疗和传统医学治疗,西医治疗常用药物为非甾体抗炎药、传统抗风湿药物、生物免疫抑制剂和糖皮质激素等[4]。自20 世纪80年代以来,甲氨蝶呤(methotrexate,MTX)一直作为治疗RA 的首选锚定药物。2019 年欧洲抗风湿病联盟(European league against rheumatism,EULAR)推荐早期RA 患者使用MTX 单一疗法,中度或重度疾病活动度患者推荐MTX 联合其他抗风湿药物(disease-modifying antirheumatic drugs,DMARDs)进行治疗[5],但仍有约50%的RA 患者对MTX 治疗效果不佳或复发后再次用药治疗应答不充分,产生耐药现象[6]。研究认为可以从基因多态性、蛋白质功能表达、细胞因子水平、信号通路等多种途径来探究MTX 耐药机制。ATP 结合盒式(ATP-binding cassette,ABC)转运蛋白作为药物转运体,介导了MTX 耐药过程,在体内药物的吸收、分布、代谢和排泄中发挥重要作用。本文就ABC 转运蛋白家族与MTX 治疗RA 过程中产生的耐药关系展开综述,以期找到可预测MTX 应答不佳的标志物,为阐明MTX 耐药机制提供参考。
1 MTX 治疗RA 的作用机制
MTX 是一种叶酸抑制剂,其结构和物理化学性质与叶酸相似,因此可通过竞争抑制二氢叶酸还原酶(dihydrofolate reductase,DHFR),使叶酸不能还原成二氢叶酸及四氢叶酸,从而阻滞核苷酸的合成代谢,最终抑制DNA 合成。可见MTX 在机体中起到抗炎和抗增殖的作用。小剂量服用MTX(5~25 mg/周)治疗RA的临床效果良好[7]。MTX 治疗RA 的作用机制复杂,其确切机制尚不清楚,多种因素共同作用来达到治疗效果是目前被广为认可的观点。研究认为MTX 治疗效果与腺苷(adenosine,ADO)抗炎作用、叶酸拮抗作用、多聚谷氨酸化甲氨蝶呤(MTX polyglutamates,MTXPG)水平和DHFR 活性等多个因素有关[8]。
1.1 MTX 与ADO 腺苷信号转导通路是目前解释MTX 在RA 中疗效机制的主要假说。ADO 是一种遍布人体细胞的内源性嘌呤核苷酸,主要通过细胞膜表面的腺苷受体(adenosine receptors,AR)来调节抗炎作用,是重要的炎症抑制因子。MTX 可阻断5-氨基咪唑-4-羧酰胺核糖核苷酸甲酰基转移酶(5-aminoimidazole-4-carboxamide ribonucleotide transformylase,ATIC),导致细胞内5-氨基-4-咪唑甲酰胺核苷水平增加,腺苷脱氨酶活性降低,进而导致细胞内ADO 浓度增加[9],见图1。当ADO 与胞外AR 结合时,细胞内级联反应被激活,MTX 对机体的抗炎作用得以发挥。目前已在不同组织中克隆并鉴定出4 种AR 亚型:腺苷受体A1(adenosine A1 receptor,ADORA1)、ADORA2A、ADORA2B、ADORA3。Singh 等[10]收集100例符合EULAR 标准的RA 患者样本,相较于疗效良好和中度反应的患者,MTX 治疗无应答患者组中ADORA3 水平较低。对参与ADO 产生和信号转导的基因多态性研究发现,ATP 酶基因rs112734 位点CC 基因型和ATIC 基因rs2372536 位点GG 基因型可能与MTX疗效有关[11]。MTX 通过提高RA 患者细胞外ADO 水平来减轻炎症反应,而AR 的低表达导致RA 患者对MTX 的治疗反应欠佳。
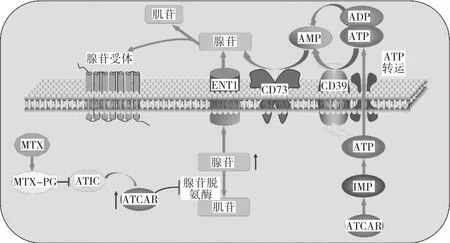
图1 MTX 对RA 患者腺苷的影响机制
1.2 MTX 与活性氧(reactive oxygen species,ROS) RA患者滑膜液中浸润着大量中性粒细胞和巨噬细胞,激活的中性粒细胞和巨噬细胞可释放细胞炎症介质[12],如ROS、氮类物质及其他蛋白酶。此类物质的释放导致机体炎症水平增高,严重损伤患者关节软骨和骨骼。Kaundal 等[13]发现,基线期RA 患者外周血中性粒细胞ROS 的产生显著高于健康对照组,MTX治疗后RA 患者ROS 产生明显减少,由此推测这可能是MTX 治疗RA 的作用机制之一。
2 ABC 转运蛋白结构与转运机制
2.1 ABC 转运蛋白概述 ABC 转运蛋白是一种主要转运体,介导多种ATP 驱动的膜上分子转运过程,使底物分子逆浓度泵出细胞外。ABC 转运蛋白核心结构是两个核苷酸结合区域(nucleotide-binding domains,NBD)和两个跨膜结合区域(transmembrane domains,TMD)[14]。前者位于细胞质内且具有ATP结合位点,通过结合ATP 水解产生的能量改变NBD蛋白的构象。后者一般含12~20 个跨膜α 螺旋,是在细胞膜内形成识别并介导底物穿过细胞膜的机械性通道[15]。
2.2 ABC 转运蛋白的转运机制 有学者认为ABC 转运蛋白是通过“交替开放”“ATP 开关”“顺序结合”和“恒定接触”等几种模型的混合方式来进行底物转运的[16]。ABC 家族的转运功能分为内向转运和外向转运两种方式。内向转运过程中,ABC 转运蛋白为向内构象,此时NBD 在TMD 的带动下处于开放状态。转运蛋白结合底物后再与TMD 结合,NBD 结合ATP 形成NBD 二聚体,从而使TMD 转变为外向开放的构象。随着ATP 水解和NBD 二聚体结构打开,底物释放至细胞质内。外向转运过程中,转运初始NBD 处于开放状态,转运从底物与转运蛋白结合开始。ATP与NBD 结合使其关闭,底物被释放进入TMD 腔内,转运蛋白构象改变并将底物最终释放至细胞外,见图2。人类基因组中的ABC 转运蛋白家族有48 个成员,按照蛋白质的线性序列可分为8 个亚家族,即ABCA~ABCG 和ANSA,其中ABCB、ABCC 和ABCG 等亚家族与耐药密切相关[17]。
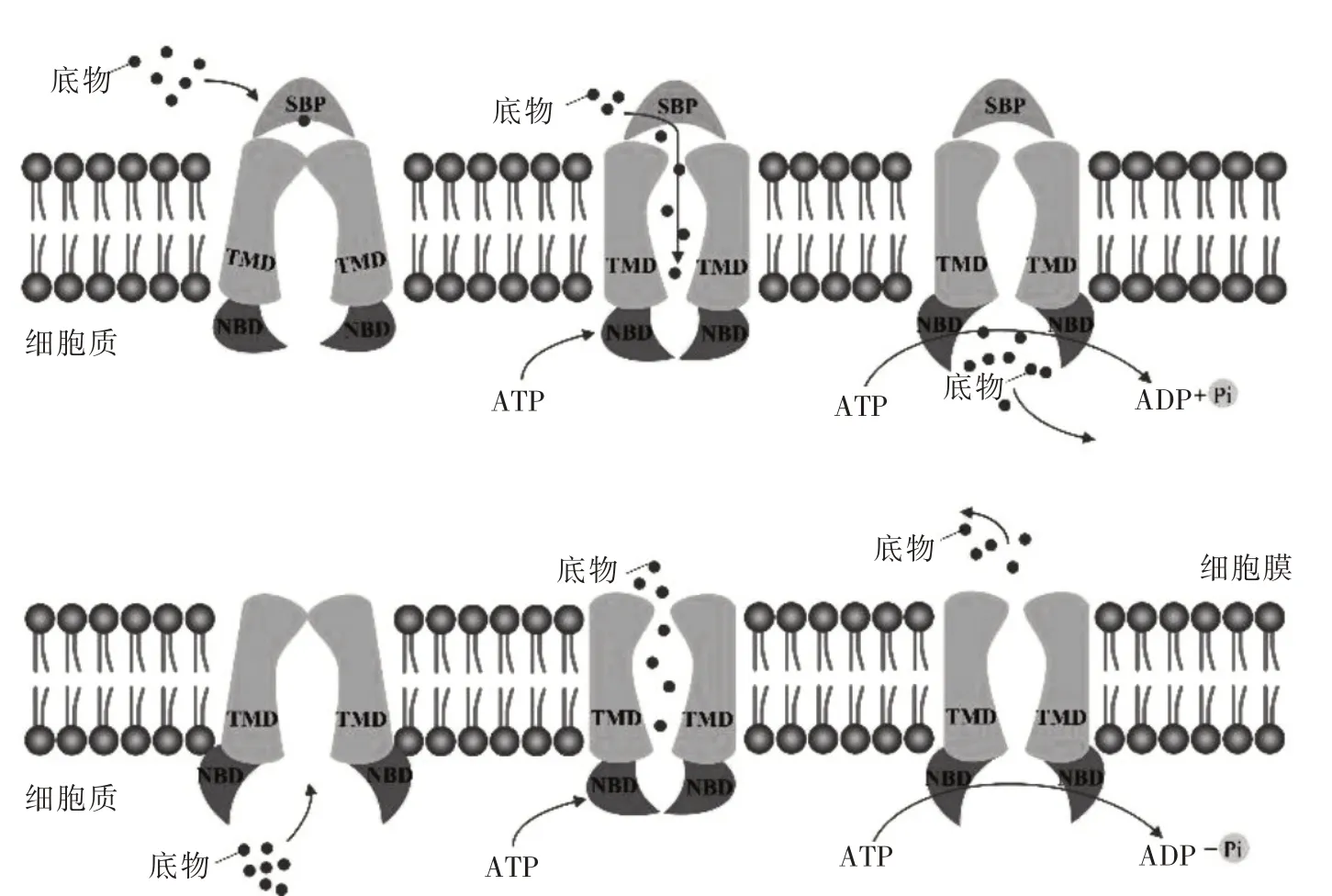
图2 ABC 转运蛋白转运机制模型图
3 ABC 转运蛋白与MTX 耐药的关系
3.1 ABCB 亚家族 ABCB 亚家族中的第1 位成员为ABCB1,是编码一种长度为1 280 个氨基酸的蛋白质,称为P-糖蛋白(P-glycoprotein,P-gp),又称多药耐药蛋白1(multidrug resistance-1,MDR1)。研究发现RA中MTX 耐药与P-gp 表达有关。姚血明等[18]发现MTX耐药患者组外周血单核细胞(peripheral blood mononuclear cells,PBMC)中MDR1 mRNA 水平显著增加,P-gp表达和外排能力均增强。王佳等[19]利用体外携带MDR1 的重组腺病毒感染RA 患者成纤维样滑膜细胞(fibroblast-like synoviocyte,FLS),结果发现MDR1 基因高表达并通过上调P-gp 表达水平来影响FLS 对MTX的外排能力,引起MTX 的耐药性。Liu 等[20]发现难治性RA 患者FLS 中P-gp 表达水平与MTX 治疗持续时间呈正相关,异常的P-gp 水平可能与MTX 耐药性的发展有关。上述分析显示P-gp 表达水平的变化可能预示着MTX 的治疗反应,可作为判断MTX 药物敏感性的指标之一。研究证实MTX 耐药的RA 患者淋巴细胞和FLS 中过度表达P-gp,而Janus 激酶2-信号转导和转录激活因子3(Janus kinase 2/signal transducer and activator of transcription 3,JAK2/STAT3)通路与P-gp 的产生密切相关。Qin 等[21]体外培养RA-FLS,结果显示单用MTX 可显著诱导RA-FLS P-gp 的表达。使用酪氨酸磷酸化抑制剂AG490 抑制JAK2/STAT3,其中MTX+4-氢过氧环磷酰胺(4-hydroperoxy cyclophosphamide,4-HC)组P-gp 表达和mRNA 水平降低,提示JAK2/STAT3 通路参与MTX+4-HC 诱导的P-gp 表达。
RA 疾病中对于MDR1 基因多态性的研究主要集中在C3435T 位点上。Muralidharan 等[22]发现印度南部地区RA 患者中MDR1 的C3435T 位点与MTX 治疗临床效果有关,疾病活动性高的患者中突变型T 等位基因频率明显高于中低度活动度疾病患者。Melikoglu 等[23]的最新研究发现MTX 无应答患者组几乎都表现为C3435T 杂合性,与MTX 应答组有显著差异。C3435T位点突变导致MDR1 编码的P-gp 对某些底物的跨膜转运能力也发生改变,因此与疾病活动程度或MTX 治疗反应相关。
3.2 ABCC 亚家族 ABCC 亚家族有12 个成员,其中ABCC1 编码产物为多药耐药相关蛋白(multidrug resistance protein,MRP)1。MRP1 是ABC 转运蛋白家族中第2 个被发现的成员[24],位于人类第16 号染色体长臂13.1 带,由1 531 个氨基酸组成,分子量为190 kDa,在人结肠黏膜上皮细胞、血管内皮细胞和心肌细胞上均有表达。MRP1 在MTX 作用于RA 的过程中发挥重要作用,MTX 由还原性叶酸载体经主动转运,进入细胞并被MRP1 等转运蛋白泵出细胞外。梁洁等[25]发现在胶原诱导关节炎大鼠模型中MRP1 表达呈阳性且与滑膜病变严重程度相关。Hider 等[26]的纵向检测发现MTX 治疗早期RA 可诱导MRP1 水平下降,相对于反应不佳患者,MTX 治疗良好患者MRP1 的表达水平更低。综上研究表明疾病活动程度可能会影响免疫效应细胞中MRP1 的表达水平。MRP1 过度表达使其外排能力增强,从而降低细胞内MTX 浓度,还可能改变细胞内药物分布,致使药物分布于胞质囊或核周高尔基样区域。
Th17 细胞亚群在RA 发生和发展过程中起介导作用,其分泌的细胞因子如IL-17、IL-22 等,有较强的促炎症作用,会加重患者关节炎症[27]。MTX 主要作用机制之一是能够抑制细胞增殖和组胺等炎症介质的反应,进一步发挥强抗炎作用。Abderrazak 等[27]发现极化Th17 细胞内高表达ABCC1,RA 患者滑膜中丰富的胶原蛋白及其受体整合素α2β1 增强了Th 细胞中ABCC1的表达和功能,通过上调ABCC1 的表达来增强极化Th细胞抵抗MTX 诱导的细胞凋亡,促进Th17 细胞对MTX 的耐药性,推测ABCC1 可能与RA 中观察到的MTX 耐药性相关。
3.3 ABCG 亚家族 ABCG2 又称乳腺癌耐药蛋白(breast cancer resistance protein,BCRP),是继P-gp 和MRP1 之后发现的第3 个外排耐药转运蛋白[28]。BCRP分子量为72 kDa,只有1 个NBD 和1 个6 次TMD,因此BCRP 也被称为半分子转运体。BCRP 转运机制与Pgp 不同,主要通过二硫键组成同源二聚体或同源多聚体的形式发挥转运功能,在胎盘合体滋养细胞、肠上皮、肾近端小管细胞和大脑组织中高度表达[29]。MTX是BCRP 的转运底物,介导MTX 外排泵出细胞。van der Heijden 等[30]在RA 患者滑膜下层内膜层、巨噬细胞和内皮细胞上均检测到BCRP 的表达,且显著高于健康对照组。MTX 治疗无应答患者组BCRP 阳性细胞中位数显著高于应答良好患者。Yu 等[31]发现黄芩可以激活BCRP 介导的外排转运,在人BCRP 基因转染的马丁达比犬肾上皮细胞系模型中,黄芩激活了BCRP 介导MTX 向肠腔的外排,还可能会增加MTX 的全身暴露和平均滞留时间。嘌呤能受体拮抗剂AZD9056 和柳氮磺胺吡啶已被证实是BCRP 的抑制剂,也是MTX和RA 的候选药物,Elsby 等[32]发现采用MTX 联合AZD9056 或柳氮磺胺吡啶治疗RA 时,MTX 临床疗效提高。推测AZD9056 以浓度依赖性的方式抑制了BCRP 转运MTX 的能力,柳氮磺胺吡啶则通过抑制BCRP 对MTX 的吸收,导致治疗靶点内MTX 浓度升高。可见BCRP 通过输出MTX 及其二谷氨酸和三聚氰酸代谢物,导致MTX 疗效降低。
ABCG2 基因多态性与RA 患者对MTX 临床反应之间相关性的研究愈发广泛。Muto 等[33]发现ABCG2 基因表达水平在MTX 反应良好患者中显著降低。ABCG2基因中研究最多的单核苷酸多态性(single nucleotide polymorphism,SNP)是rs2231142 和rs13120400。Lima等[34]研究了233 例RA 患者23 个SNPs 的基因分型后发现,rs2231142 中第421 位的C 核苷酸被A 取代,导致ABCG2 转运功能丧失,是影响MTX 治疗效果的原因。而rs2231142(AC)等位基因突变,则导致了MTX 细胞内活性代谢产物MTX-PG 含量增加[35]。MTX-PG 与MTX 抗炎机制密切相关,MTX 主要通过MTX-PG 发挥作用。Dervieux 等[36]发现MTX-PG 浓度增加与较好的MTX 临床疗效有关。D'Cruz 等[37]检测活动期RA 患者血浆中MTX 和其主要代谢产物7-羟基甲氨蝶呤(7-hydroxy methotrexate,7-OH-MTX)的浓度时发现,rs2231142 GT 基因型受试者WBC 显著偏低,血浆中7-OH-MTX 水平明显降低,而7-OH-MTX 水平降低可能意味着MTX 临床疗效增加。ABCG2 基因相关SNPs 位点的研究进一步表明其与MTX应答反应之间存在关联,为更好地实现MTX个性化治疗提供了新的研究方向。
4 小结
MTX 是治疗RA 的锚定药物,该药物能够缓解大多数RA 患者的临床表现,降低RA 患者炎症水平和疾病活动性,并延缓或阻止患者关节骨质侵蚀发生。MTX 作为ABC 转运蛋白的转运底物,介导了MTX 的吸收、分布、代谢和排泄过程。主要多药耐药蛋白P-gp、MRP 和BCRP 分别通过不同的作用机制介导MTX 耐药的产生,验证并阐明ABC 转运蛋白在RA 患者中MTX 耐药的具体作用,有利于清晰展示MTX 耐药机制。今后可在更大的患者队列中加以验证,以期在临床实践中对RA 患者准确分群,对患者采用更精准的治疗手段并提高治疗效率。
