三元探究式教学:概念深度理解的有效路径
——以“电解质和电离概念”为例
2023-06-01张仿刚山东省莘县第一中学
张仿刚|山东省莘县第一中学
文吉槐|四川省自贡市蜀光中学
杨志义 王 越|山东省聊城市第一实验学校
一、问题的提出
化学概念是化学知识体系的重要组成部分,对它的研究一直受到化学工作者的关注[1]。概念是人类在认识过程中,把所感觉到的事物的共同特征抽出来,加以概括而形成的,它是思维的基本形式之一[2]。化学概念的形成一般要从感知具体的物质和现象开始,经过从已知到未知、由表及里、由感性认识到理性认识的过程,进而把握有关的原理知识,形成概念后还要通过实践活动去运用、发展认知能力[3]。当前,各版本高中化学教材中都有电离和电解质的概念,笔者在教学实践中逐渐产生了如下两个疑惑。
其一,两个概念如何安排呈现顺序?
人教版、苏教版和沪教版普通高中教科书《化学》必修第一册都是先给出电解质的概念,再探究电解质是如何电离的;鲁科版普通高中教科书《化学》必修第一册则先探究电离再给出电解质的概念,即先实验观察NaCl溶于水前后的导电性,再给出电解质的定义。前者易导致某些问题,例如对“CO2溶于水可以导电”的理解,学生会认为CO2是电解质,虽经教师解释“导电的不是CO2而是碳酸”,学生仍会产生疑问“为什么CO2不导电”,最终还是需要用电离的知识去解释导电。此外,很多阶段性测试题会将学生对电离的理解放到对电解质的辨析上去考查,这也使得教师更注重教会学生“机械”地辨析电解质,而忽略了电离的重要地位。但电离概念是发展学生微粒观的重要载体,它不仅本身重要,而且对于电解质概念的理解起着重要作用。因此,从学生认知的角度出发,笔者更倾向于先电离后电解质的呈现方式。
其二,教学设计如何促进概念生成?
概念的形成需要经历由感性认识到理性认识的过程。上述四个版本教材共同的做法是,先让学生在宏观上体验哪些哪类物质能够导电,再从微观上呈现NaCl 在水溶液中的电离过程。这种由表及里、由宏观到微观、由现象到本质的学习方式得到学术界的普遍认同。但是对于教师而言,更应该思考如何创造性地使用教材,以便让学生真正经历由现象到本质的过程。也就是说,现象是教师引导着学生去“看”的,但本质应该由学生自己探究出来。
二、促进概念深度理解的三元探究式教学设计
建构主义理论认为,学生总是以已有的知识经验为基础来建构对新知识的理解。但仅靠记忆概念的定义,学生往往会存在模糊甚至是错误的认识,不可能真正理解概念的本质。因此,要想真正理解概念,教师就应当以相关实验为素材引导学生感知概念,使学生在“看到”概念之后产生探究其原理的兴趣,然后设计原理探究活动,引导学生经历原理的认知和分析过程,达成对概念的进一步认知,最后设计指向概念本质的探究活动,引导学生建构出科学的概念。由此,笔者提出概念形成的“三元探究”路径:实验探究→原理探究→本质探究。实验探究是以实验为素材创设情境,引领学生从宏观层面对实验现象进行分析、比较、概括得出初步的结论,形成感性认知;原理探究是依据思维进阶,引导学生从实验表象探索微观原理,形成理性认知,发展证据推理、科学探究的学科核心素养;本质探究是基于宏微结合,引发学生自主归纳、概括、演绎出合理的结论,挖掘出概念的内涵与外延,并与教材中的概念进行对比,达到深刻理解概念本质的目的。
三元探究式教学要围绕发展学生的化学学科核心素养,创设性地使用教材,并按照如图1所示的基本流程整体推进。
(一)确定教学目标
其一,能系统认识物质导电的原因,知道导电是因为有自由移动的带电粒子。
其二,利用化合价知识推理水合离子的形成过程,能解释电离的两种能量来源,进而深刻认识电离概念,建构电离模型。
其三,能准确描述电离和电解质的概念,准确判断哪些物质属于电解质。
(二)设计教学环节
“电解质和电离概念”三元探究式教学设计详见表1。

表1 “电解质和电离概念”三元探究式教学设计
(三)教学过程
【环节一:实验探究】
[实验]请同学们分小组测量铜片、蒸馏水、NaCl 固体、NaCl 溶液和蔗糖溶液是否导电,探究物质的导电性及原因,填写表2(表中斜体部分为学生所填)。

表2 物质的导电性及原因
[学生活动]通过①回忆初中所学知识,明确金属导电是因为有自由移动的电子;对比③④,明确导电需要有自由移动的带电粒子,分子不可以导电。结合以上分析、比较,归纳概括出导电的根本原因是:有自由移动的带电粒子。(教师尤其要引导学生)对比②③④,思考“NaCl 溶于水前带电粒子无法自由移动,溶于水后为什么就可以自由移动”以及“在微观上水分子是如何与Na+以及Cl-相互作用的”。
设计意图:让学生测量铜片与蒸馏水的导电性,是为了调动学生已有的知识储备:金属导电是因为有自由移动的电子。NaCl 固体由Na+和Cl-构成,但不能自由移动,而溶于水或在熔融状态下离子能够自由移动,说明物质的状态发生了变化。此时学生还无法对导电的原因形成规律性的认知,因此引导学生对比NaCl 溶液和NaCl 固体的导电性,让学生思考“是否粒子只要溶于水后自由移动就能导电”。最后测量蔗糖溶液的导电性,引导学生在归纳总结中发现“自由移动”和“带电粒子”是物质导电的必要条件。根据这一认知,学生再对比蒸馏水、NaCl 固体、NaCl 溶液,就能回答这节课的核心问题“NaCl 为什么能够在水溶液中电离”。学生在自主探究得出初步结论后,其探究的欲望会变得更加强烈,甚至能在一定程度上开始尝试微观分析。
【环节二:原理探究】
问题1:NaCl到底是如何电离的呢?请同学们画出自己的想法。
学生甲的观点是NaCl自发电离为自由移动的Na+和自由移动的Cl-,学生乙的观点是NaCl 在水分子的作用下电离为一种水分子和Na+、Cl-相互作用的“大粒子”。经过小组讨论,学生一致认为NaCl 是在水分子的作用下电离的。此时有学生产生了疑问:“是不是NaCl在所有液体中都可以电离?”
问题2:水分子是如何作用于NaCl使其电离的?
在笔者的引导下,学生做了一组对照实验,将0.5g 的NaCl 分别加入10ml 蒸馏水和10ml液溴中,发现NaCl在水中完全溶解,在液溴中几乎不溶解。学生利用化合价知识解释了原因,然后根据自己画出的相关图示作了具体分析。
氧元素的化合价为-2价,对应的氧原子显负电性,所以氧原子围绕在带正电荷的钠离子周围;氢元素的化合价为+1价,对应的氢原子显正电性,因此氢原子围绕在带负电荷的氯离子周围。氯化钠在水溶液中电离的能量来自于水分子和钠离子以及氯离子之间的作用力。液溴中的溴元素显0价,溴原子不带电,因此无法“簇拥在”Na+和Cl-周围,不能使NaCl电离。
问题3:有其他使NaCl电离的方法吗?
学生已经认识到NaCl 的电离需要能量,而能量来源的最直接方式是加热,因此快速回答出“加热熔化”,并设计实验证明猜想。
设计意图:许多学生对于电离的原始“图像”是NaCl 在水溶液中形成了单独的自由移动的Na+和Cl-,这是因为初中化学教材中配有酸碱盐在水溶液中形成“单独的”自由移动的阴阳离子的插图;也有学生将电离与导电联系在一起,这是因为学生认为电离需要能量,从微观上理解就是破坏Na+与Cl-之间的作用力需要能量。因此,先让学生设计实验,并从实验中体会电离与通电无关,再引入化合价进行推理演绎,最终学生就能从微观上解释电离的原因。在此过程中,学生对电离的理解经历了感性认识和理性认识,这能有效地纠正学生对概念的“迷思”之处,进而发展学生宏观辨识与微观探析核心素养。
【环节三:本质探究】
问题1:电离的概念是什么?
生1:在水分子的作用下或者加热的条件下,不能自由移动的阴阳离子转化为自由移动的阴阳离子的过程叫电离。
该生已经认识到电离的条件,但是没有精确认识到能够电离的物质有哪些。于是笔者在课堂上追加了一个问题。
问题2:HCl能否在水溶液中电离呢?如果可以,请你画出它在水溶液中电离的微观示意图。
学生甲画出氢离子、氯离子,学生乙画出水合氢离子、水合氯离子。结合蔗糖溶液与盐酸的导电性比较,全班学生经充分讨论对比,认为学生乙是正确的。笔者告知学生1个氢离子结合1个水分子,部分学生悟出了另一定义。
生2:在水分子的作用下或者加热融化的条件下,物质电离为自由移动的阴阳离子的过程叫电离。
该生对于电离的定义基本是正确的,但是对能电离的物质依然不甚了解,于是笔者适时提出下一个要研究的问题。
问题3:哪些物质能够电离呢?
经过小组讨论,学生迅速回忆起初中所学知识,酸碱盐都可以在水溶液中形成自由移动的阴阳离子。结合刚才第一个学生的回答,如果原来有阴阳离子,则加热或者在水溶液中都可以电离。学生由此得出答案:酸碱盐以及由阴阳离子构成的物质能够电离。笔者再分析讲解,引导学生最终确定属于电解质的是:常见的酸碱盐,这些物质都是化合物。
问题4:电解质的定义是什么?
生3:在水溶液或者熔融状态下能电离的化合物是电解质。
该生的定义虽然和教材不一样,但是已经能从微观上思考问题。和教材相对照,大家称教材的定义为“宏观定义”,称该生的定义为“微观定义”。
问题5:电解质、电离和导电之间的关系是什么?
经过小组讨论,学生得出以下结论。
从电解质的角度出发,电解质经过电离才能形成自由移动的阴阳离子,最终能导电;电解质不经过电离就无法形成自由移动的离子,也就无法导电。
师:(总结)同学们总结得很到位,如图2所示,电解质是我们研究的主体,那么,如何在宏观上表征导电呢?它必然存在于一定的客观环境中,在微观上发生了变化,主体的存在方式也变成了可以自由移动的微观粒子。也就是说,电解质在水溶液或熔融状态下发生了电离,形成了自由移动的阴阳离子。通电后,我们发现电解质溶液可以导电,但是导电是电解质溶液自身的性质,与是否通电无关。
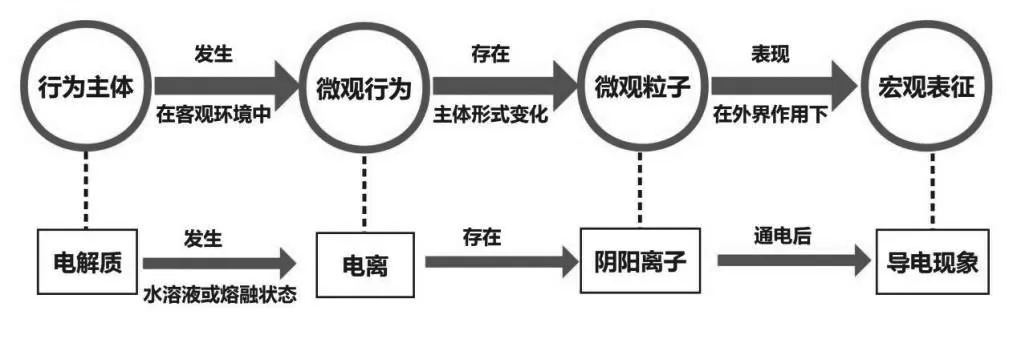
图2 电解质、电离和导电的关系
问题6:下列物质哪些是电解质?哪些电解质能够导电?电解质与导电之间的关系是什么?
①NaCl 固体;②铜丝;③HCl;④CO2;⑤Na2CO3粉末;⑥蔗糖晶体;⑦熔融NaCl。
生4:电解质:①③⑤⑦。能导电的电解质:⑦。电解质和导电之间的关系:电解质只有在电离的情况下才能导电;电解质不电离,也就没有自由移动的阴阳离子,就无法导电。
设计意图:只有对概念进行深度的加工、辨析和整合,才能使不同概念形成联系,进而引导学生将其内化于个人的知识结构中,形成迁移运用的能力。在实验探究中,学生只是经历简单的对比分析并概括出初步的结论,而本质探究是在学生深刻理解原理的基础上,经深度分析、整合而概括出核心内容。它既有利于学生形成知识体系,又是教师培养学生思维能力的很好工具。在概念的反复“雕琢”下,学生可深度理解电解质和电离的概念。
三、三元探究式教学注意事项
在实施三元探究式教学的过程中,教师需要在具体操作中注意如下事项。
(一)实验探究:立足已有认知,激发学习兴趣
简单的实验现象观察不涉及思维品质,学生只会机械地活动,不仅不能达到三元探究式教学的目的,而且会磨灭学生的学习兴趣。因此,实验的设计要立足于学生的已有认知,激发其学习兴趣,引导其通过分析、对比,归纳出新的认知,提升对知识理解的境界,从而推进原理探究。这节课立足于学生对金属导电的理解,设计NaCl 溶于水前后以及蔗糖溶液的导电实验,能较好地激发学生的已有认知,助力学生通过已有认知进行对比分析,归纳出一般物质的导电原因以及水分子可以作用于NaCl 形成自由移动的阴阳离子。学生不仅收获了知识,而且获得了自豪感,因此更愿意进行下一步探究。
(二)原理探究:注重思考深度,引领思维发展
原理探究是三元探究式教学的核心环节。直接给出原理解释实验现象,显然不利于学生思维能力的提高,因此教师要努力挖掘学生的已有知识,巧妙设计层层递进的问题,让学生在小组探讨中触及概念的微观原理。这样不仅有利于概念的进一步探究,也有利于引导学生掌握科学的探究方法,发展证据推理与模型认知、科学探究与创新意识等核心素养。这节课让学生利用化合价知识深度探究“水分子是如何作用于NaCl使其电离的”,学生不仅深刻理解了电离,而且体验了探究过程,对科学探究有了进一步的认识。但是也有部分小组思维混乱,不知从何处着手,这就需要教师在每个小组内都安排思维、交流能力强的学生,以引领小组思考和讨论。
(三)本质探究:修正概念表述,升华知识理解
经过原理探究,学生对概念有了较为深刻的理解,但如何用精练的语言将概念描述出来,对于学生来说是一种挑战。在这个过程中,学生会有多种多样的表述,或没有注意到问题的本质,或表述得不够精练。但在对概念的每一次修正中,学生不仅对概念的本质有了更加深刻的理解,而且提高了逻辑思维和语言表达能力,提升了获得感。这节课,学生经过多次修改后呈现的答案已经触及电离的本质,虽然和教材中给出的概念不一致,但是这极大地丰富了学生对电离概念的认知,为电解质概念的理解和整节课知识体系的建构打下了坚实的基础。
