QuEChERS-UPLC-MS/MS法快速测定水产品中氯霉素
2023-05-30常波
常波
摘 要:建立了一种QuEChERS-固相萃取-液质联用法测定水产品中氯霉素的方法。经测试此方法氯霉素在0.2~10.0 ng·mL-1时,线性关系良好,r2为0.999,3个添加水平的平均回收率在100%~115%,精密度为3.6%~10.0%。该方法具有操作简单、结果准确、灵敏度高等优点,适用于批量水产品中氯霉素残留量的筛查。
关键词:氯霉素;残留量;水产品
Using QuEChERS-UPLC-MS/MS for Rapid Determination of Chloramphenicol in Aquatic Products
CHANG Bo
(Yingkou Agricultural and Rural Comprehensive Development Service Center (Yingkou Agricultural Product Quality Safety Inspection and Monitoring Center), Yingkou 115004, China)
Abstract: In this paper, a method for the determination of chloramphenicol in aquatic products by QuEChERS-solid phase extraction-liquid mass spectrometry was developed. The chloramphenicol had a good linearity in the range of 0.2~10.0 ng·mL-1, r2 was 0.999, the average recovery rates were between 100%~115% at three additive levels, and the precision rates were between 3.6%~10.0%. This method is not complicated, high precision and high sensitivity, and is suitable for rapid screening of chloramphenicol residue in bulk aquatic products.
Keywords: chloramphenicol; residue; aquatic products
氯霉素類(Chloramphenicol,CAP)是一种人工合成的广谱抗生素,价格便宜、抑菌性强、体内吸收良好,被广泛应用于水产动物的疾病防控[1]。这些药物一般较稳定,不易降解,在水产品中残留可通过食物链进入人体,氯霉素能引起人的再生障碍性贫血、粒状白细胞缺乏症、新生儿灰色综合征等疾病,尤其是氯霉素的低浓度药物残留会诱发致病菌的耐药性[2]。氯霉素的残留不但对人体造成危害,还会严重影响我国动物性食品的出口。我国在水产品养殖过程中禁止添加或使用氯霉素,2019年农业农村部发布了动物食品中禁止使用的药品及其他化合物清单,规定在动物食品中不得检出氯霉素[3]。
目前的标准前处理方法需要反复提取和氮吹浓缩吹干,前处理时间长,难以满足批量水产品中氯霉素残留量的快速筛查。QuEChERS是由美国化学家Lehotay和德国的Anastassiadas于2003年提出的一种快速(Quick)、简便(Easy)、便宜(Cheap)、有效(Effective)、可靠(Rugged)及安全(Safe)的样品处理技术[4-6],最早在农药多残留中使用。因此本方法采用Simle-QuEchERS Nano-Ant快速测定水产品中的氯霉素残留量。这样操作既简单快速,又能保证检测的准确性。
1 材料与方法
1.1 材料与仪器
鲤鱼,购买于营口市某农贸市场;氯霉素(CAP,99.8%)、氯霉素氘代物(CAP-D5,100 μg·mL-1),购自MedJen;甲醇、乙腈(色谱纯,德国Meker公司);QuEChERS-SPE抗生素净化小柱含盐包4.0 g无水硫酸镁(MgSO4),1.0 g氯化钠,陶瓷均质子(LUMTECH);试验用水均为超纯水。
Aglient超高效液相色谱-质谱三重四极杆联用仪6460(配有EI离子源);分析天平(感量0.01 g、0.00 001 g,瑞士Mettle Toledo公司);涡旋振荡器(德国Heidolph);1 000 μL移液枪(德国艾本德);冷冻离心机(美国Thermo Fisher Scientific);全自动氮吹浓缩仪N1(上海屹尧Preekem);Milli-Q Advamtage超纯水器(美国Millipore)。
1.2 实验方法
1.2.1 样品前处理
称取匀浆样品5.0 g(准确至±0.02 g),加CAP-D5内标工作液250 μL,于50 mL具塞离心管中;加入4.0 mL超纯水和10 mL乙腈,涡旋5 min,加入4.0 g无水硫酸镁(MgSO4),1.0 g氯化钠(NaCl)及一颗陶瓷均质子,涡旋1 min;4 ℃下离心,10 000 r·min-1,5 min;取一支Simle-QuEchERS Nano-Ant抗生素净化柱垂直塞入50 mL具塞离心管中,缓慢下压净化柱顶部,上层清液随压力,自下而上进入净化柱储液槽内;使用移液枪至净化柱储液槽内,吸取2 mL上清液于40 ℃水浴中氮气吹至近干,1 mL流动相定容;过0.22 μm有机微孔滤膜至进样瓶,LC-MS/MS待测定。
1.2.2 标准曲线制备
用乙腈将氯霉素配制成10 ng·mL-1、50 ng·mL-1的标准中间液和将氘代氯霉素配制成20 ng·mL-1的标准中间作液。分别精确量取10 ng·mL-1 标准液0.050 mL、0.100 mL和50 ng·mL-1标准液0.040 mL、0.100 mL、0.200 mL,再分别加入0.250 mL浓度为20 ng·mL-1的氘代氯霉素内标溶液,用20%的乙腈溶液稀释成氯霉素浓度为0.5 ng·mL-1、1.0 ng·mL-1、2.0 ng·mL-1、5.0 ng·mL-1和 10.0 ng·mL-1、内标CAP-D5浓度为5.0 ng·mL-1的标准溶液,供液相色谱法-串联质谱法测定。以测得特征离子质量色谱峰外标和内标峰面积比为纵坐标、对应的标准溶液浓度为横坐标,绘制标准曲线。求回归方程和相关系数。
1.2.3 仪器条件
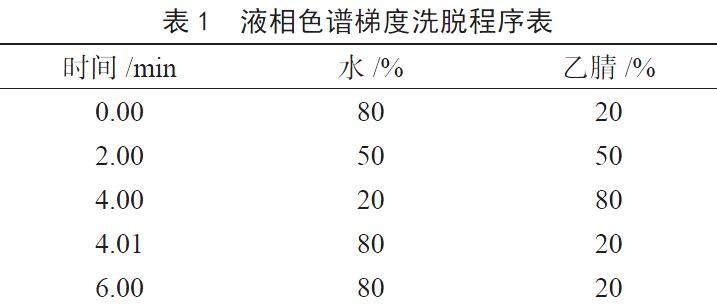
(1)色谱条件。色谱柱:Agilent Poroshell 120 EC-C18柱(100 mm×3.0 mm,2.7 μm);柱温:30 ℃;进样量:20 μL;流速:0.35 mL·min-1;流动相为乙腈-水进行梯度洗脱见表1。
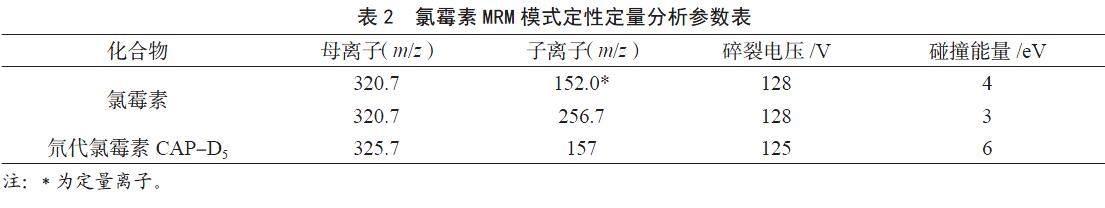
(2)质谱MS条件。负离子电喷雾ESI-多反应监测(MRM)模式;扫描方式:负离子;毛细管电压:4 000 V;雾化气压力(GSI):40 psi;气流温度:350 ℃;鞘气流速:9 L·min-1。氯霉素的MRM模式定性定量分析参数见表2。
2 结果与分析
2.1 样品前处理优化
本方法考察了水产品前处理中加入甲醇、乙腈对氯霉素类药物的提取率的影响[7],乙腈可避免提取脂肪,同时又能沉淀蛋白质,可提高氯霉素提取率,因此本方法采用加入超纯水和乙腈进行提取,再加入盐包(4.0 g无水硫酸镁,1.0 g氯化钠)进行盐析除蛋白和脱水,脱水会减少氮吹时间,提升检测效率,用Simle-QuEchERS Nano-Ant抗生素净化柱进行净化,代替正己烷除脂和通常用的SPE小柱净化,此QuEchERS小柱操作步骤快速简单,免去繁杂的提取步骤,节省前处理时间。
2.2 工作曲线线性范围
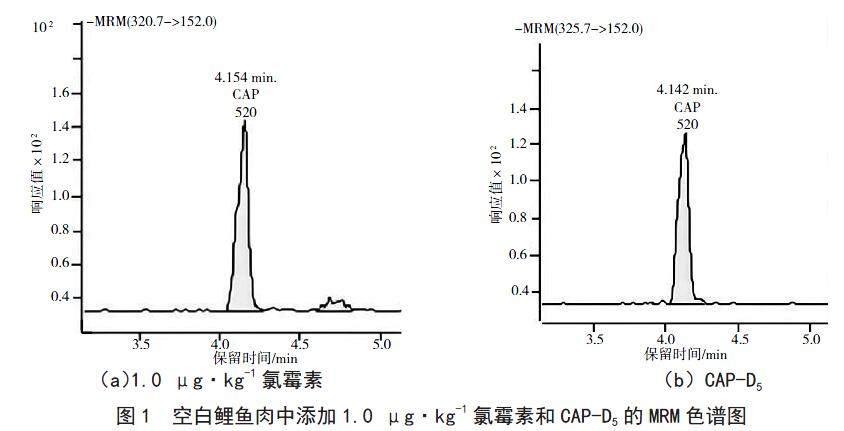
以氯霉素濃度为横坐标,以氯霉素峰面积与CAP-D5峰面积比值为纵坐标,得到其线性方程为y=0.988 640x-0.017 632(R2=0.999),氯霉素在0.5~10 ng·mL-1时,线性关系良好。空白鲤鱼肉中添加1.0 μg·kg-1氯霉素和CAP-D5 MRM色谱图见图1。
2.3 方法回收率和精密度
在5.0 g空白鲤鱼肉中添加3个低、中、高的浓度水平标准溶液,添加浓度分别为10 ng·mL-1氯霉素标准溶液0.1 mL,50 ng·mL-1氯霉素标准溶液0.1 mL,0.5 μg·mL-1氯霉素标准溶液0.1 mL,20 ng·mL-1 CAP-D5标准中间液250 μL,添加浓度水平分别为0.2 μg·kg-1、1.0 μg·kg-1、10.0 μg·kg-1,添加的CAP-D5浓度为5.0 ng·mL-1,每个添加水平做6个平行,按照1.2.1前处理的方法进行处理,测定氯霉素峰响应值的相对标准偏差(Relative Standard Deviation,RSD),计算方法的回收率和精密度。由表3知,3个添加水平的平均回收率为100%~115%,精密度为3.6%~10.0%,满足测定要求。
3 结论
对氯霉素的标准方法进行优化,用水和乙腈进行提取,Simle-QuEchERS Nano-Ant抗生素净化柱进行净化,代替标准中乙腈和乙酸乙酯反复提取和正己烷除脂,减少前处理的时间,提升检测效率。并加入CAP-D5作为内标进行检测,一定程度上消除了操作条件等的变化所引起的误差。此QuEChERS方法操作简单、灵敏度高、结果准确,并且回收率和精密度满足测定要求,适合大批量水产品中氯霉素的残留量筛查。
参考文献
[1]杨洪波,王荻,卢彤岩.氯霉素类药物的药理学在水产动物中的研究现状[J].水产学杂志,2013,26(4):61-64.
[2]孙伟红,刘欢,邢丽红,等.水产品兽药残留检测技术标准解析及能力验证工作探讨[J].中国渔业质量与标准,2017,7(2):11-18.
[3]中华人民共和国农业农村部.中华人民共和国农业农村部公告第250号[EB/OL].(2019-12-27)[2022-08-11].http://www.moa.gov.cn/nybgb/2020/202002/202004/t20200414_6341556.htm.
[4]KLINSUNTHORN N,PETSOM A,NHUJAK T.Determination of steroids adulterated in liquid herbal medicines using QuEChERS sample preparation and high-performance liquid chromatography[J].Journal of Pharmaceutical and Biomedical Analysis: An International Journal on All Drug-Related Topics in Pharmaceutical, Biomedical and Clinical Analysis,2011,55(5):1175-l178.
[5]AGUILERA-LUIZ M M,VIDAL J L,ROMERO-GONZALEZ R,et al.Multi-residue determination of veterinary drugs in milk by ultra-high-pressure liquid chromatography–tandem mass spectrometry[J].Journal of Chromatography A,2008,1205(1-2):10-16.
[6]STUBBINGS G,BIGWOOD T.The development and validation of a multiclass liquid chromatography tandem mass spectrometry (LC–MS/MS) procedure for the determination of veterinary drug residues in animal tissue using a QuEChERS (Quick, Easy, Cheap, Effective, Rugged and Safe) ap[J].Analytica Chimica Acta,2009,637(1-2):68-78.
[7]高何刚.氯霉素残留的液相色谱质谱检测方法的样品前处理研究进展[J].广州化工,2017,44(8):204-205.
