电针颈夹脊穴对神经根型颈椎病神经病理性疼痛模型大鼠脊髓背角CX3CL1、AC3、CGRP和SP物质表达的影响
2023-05-30林伟弟杨松王瑞安孟灵钟青华谢玲瑶段霞霞谭佳旋蒋学余
林伟弟 杨松 王瑞安 孟灵 钟青华 谢玲瑶 段霞霞 谭佳旋 蒋学余

〔摘要〕 目的 觀察电针颈夹脊穴对神经根型颈椎病(cervical spondylotic radiculopathy, CSR)神经病理性疼痛大鼠脊髓背角CX3C趋化因子配体1(C-X3-C motif chemokine ligand 1, CX3CL1)、腺苷酸环化酶3(adenylate cyclase 3, AC3)、降钙素基因相关肽(calcitonin gene-related peptide, CGRP)和P物质(substance P, SP)表达的影响,探讨电针颈夹脊穴治疗CSR引起的神经病理性疼痛的相关镇痛机制。方法 48只雄性SD大鼠随机分为空白组、假手术组、模型组和电针组,每组12只。电针组给予电针双侧C6、C7夹脊穴,模型组和假手术组在电针组干预同时间点进行绑缚处置。观察大鼠在术前第1天、术后第14 天、术后第28天患侧前足热刺激缩足反射潜伏期(paw withdrawal thermal latency, PWTL)的变化,采用Western blot法和Real time PCR法检测患侧脊髓背角CX3CL1蛋白和基因的表达,采用免疫荧光法检测患侧脊髓背角AC3、CGRP和SP的表达。结果 各时间点与空白组比较,假手术组患侧前足PWTL差异均无统计学意义(P>0.05);术后第14天,与假手术组比较,模型组和电针组大鼠患侧前足PWTL均减少(P<0.01);术后第28天,与模型组大鼠比较,电针组大鼠患侧前足PWTL升高(P<0.01);电针组大鼠术后第28天患侧前足PWTL较术后第14天升高(P<0.01)。与空白组比较,假手术组大鼠患侧脊髓背角CX3CL1、AC3、CGRP、SP蛋白和CX3CL1基因的表达差异均无统计学意义(P>0.05);与假手术组比较,模型组大鼠患侧脊髓背角CX3CL1、AC3、CGRP、SP蛋白和CX3CL1基因的表达均明显升高(P<0.01);与模型组相比,电针组大鼠患侧脊髓背角CX3CL1、AC3、CGRP、SP蛋白和CX3CL1基因的表达均明显降低(P<0.05)。结论 电针颈夹脊穴治能够改善CSR神经病理性疼痛模型大鼠的热痛觉过敏,并通过抑制脊髓背角初级感觉神经元的CX3CL1、AC3、CGRP和SP合成表达,减轻了神经炎性反应,降低脊髓背角初级感觉神经元的兴奋性,从而阻碍神经中枢的敏化。
〔关键词〕 神经根型颈椎病;电针;神经病理性疼痛;脊髓背角;CX3C趋化因子配体1;腺苷酸环化酶3;降钙素基因相关肽;P物质
〔中图分类号〕R245 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2023.04.021
Effects of electroacupuncture at cervical points of Jiaji (EX-B2) on the expression levels of CX3CL1, AC3, CGRP and substance P in the spinal dorsal horn of rats with neuropathic
pain due to cervical spondylotic radiculopathy
LIN Weidi1, YANG Song1, WANG Rui'an1, MENG Ling1, ZHONG Qinghua1, XIE Lingyao1,
DUAN Xiaxia1, TAN Jiaxuan1, JIANG Xueyu2*
1. Hunan University of Chinese Medicine, Changsha, Hunan 410208, China;
2. Yueyang Hospital of Chinese Medicine, Yueyang, Hunan 414000, China
〔Abstract〕 Objective To observe the effects of electroacupuncture at cervical points of Jiaji (EX-B2) on the expression levels of C-X3-C motif chemokine ligand 1 (CX3CL1), adenylate cyclase 3 (AC3), calcitonin gene-related peptide (CGRP) and substance P (SP) in the spinal dorsal horn of rats with neuropathic pain caused by cervical spondylotic radiculopathy (CRS), and to investigate its analgesic mechanism in such condition. Methods A total of 48 male SD rats were randomly divided into blank group, sham-operated group model group, and electroacupuncture group, with 12 rats in each group. Electroacupuncture was performed at bilateral C6-C7 Jiaji (EX-B2) points of rats in electroacupuncture group. At the same time, rats in model group and sham-operated group were only bundled, without any other intervention. The changes of paw thermal withdrawal latency (PWTL) of the affected rat forefoot after thermal stimulation were observed 1 d before operation, as well as 14 and 28 d after operation. Western blot and real-time PCR were used to test the expression levels of CX3CL1 protein and gene in the spinal dorsal horn of the affected side, respectively. The expression levels of AC3, CGRP and SP in the same spot were determined by immunofluorescence. Results Compared with the blank group at each time point, there was no statistically significant difference in PWTL of the affected rat forefoot in sham-operated group (P>0.05); on the 14th day after operation, compared with sham-operated group, the PWTL of the affected rat forefoot in model group and electroacupuncture group decreased (P<0.01); on the 28th day after operation, compared with model group, the PWTL of the affected rat forefoot in electroacupuncture group increased (P<0.01), and it was higher than that on the 14th day after operation (P<0.01). Compared with blank group, there was no significant difference in the expression levels of CX3CL1, AC3, CGRP, SP proteins, and CX3CL1 gene in the dorsal horn of the affected rat spinal cord in sham-operated group (P>0.05); compared with sham-operated group, those indices in model group significantly went up (P<0.01); compared with model group, those indices in electroacupuncture group significantly dropped (P<0.05). Conclusion Electroacupuncture at cervical points of Jiaji (EX-B2) can improve the thermal hyperalgesia of rats with CSR neuropathic pain, and reduce the neuroinflammatory response and excitability of the primary sensory neurons in the spinal dorsal horn by inhibiting the synthetic expressions of CX3CL1, AC3, CGRP and SP, thus impeding the sensitization of the nerve center.
〔Keywords〕 ecervical spondylotic radiculopathy; electroacupuncture; neuropathic pain; spinal dorsal horn; C-X3-C motif chemokine ligand 1; adenylate cyclase 3; calcitonin gene-related peptide; substance P
神经根型颈椎病(cervical spondylotic radiculopathy, CSR)是由于颈椎间盘退变或突出及骨质增生等病变使椎间孔变窄,卡压颈神经从而引起各种症状和体征的综合征,以颈部不适和手臂放射性根性神经痛、麻木和肌力减退等为主要临床表现[1-2]。CSR是由于颈神经根被压迫或受刺激等引起的常见神经系统疾病,引起的放射性根性神经痛属于神经病理性疼痛的范围[3-4]。由于现代生活和工作模式的改变,长期低头伏案工作等造成颈椎病的发病率逐年上升,且表现出年轻化的趋势,其中CSR的分型占颈椎病所有分型的60%~70%[5]。治疗上有手术治疗和非手术治疗,最近研究表明首选非手术治疗,如针灸、推拿等均可取得良好疗效,但其作用机制仍未明确[6-7]。本实验通过观察电针夹脊穴对CSR模型大鼠患侧前足热刺激缩足反射潜伏期(paw withdraw thermal latency, PWTL),脊髓背角CX3C趋化因子配体1(C-X3-C motif chemokine ligand 1, CX3CL1)、腺苷酸环化酶3(adenylate cyclase 3, AC3)、降钙素基因相关肽(calcitonin gene-related peptide, CGRP)、P物质(substance P, SP)表达的影响,探讨电针颈夹脊穴治疗CSR引起的神经病理性疼痛的相关镇痛机制。
1 材料与方法
1.1 实验动物
48只雄性SD大鼠,体质量200~220 g,购自上海斯莱克实验动物有限公司。分笼饲养于湖南中医药大学动物中心实验室,饲养湿度为50%~70%,温度为24~26 ℃。本实验通过动物福利伦理会审批(审批号:SLBH-201910140006)。
1.2 主要试剂与仪器
戊巴比妥钠(国药集团化学试剂有限公司,批号:30092436);电子针疗仪(苏州医疗用品厂有限公司,型号:SDZ-V型);Anti-CX3CL1抗体、Anti-CGRP抗体、Anti-AC3抗体、Anti-Substance P抗体(英国Abcam公司,批号:ab235110、ab235031、ab214122、ab223125);荧光标记二抗、RIPA裂解液、缓冲液(碧云天生物工程有限公司,批号:A0208、202105071、D7182L);Trizol试剂(美国Invitrogen公司,批号:JR00532);反转录试剂盒(日本Takara公司,批号:RT0213-01);BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司,批号:ab92742);荧光定量PCR仪(美国Roche公司,批号:11684817923)。
TGL-16B型离心机(上海安亭科学仪器厂);EMFC7冰冻切片机、TCSSP8型激光共聚焦显微镜(德国Leica公司);ZH-200型热刺痛仪(安徽正华生物仪器设备有限公司);D1524R型低温高速离心机(大龙兴创实验仪器有限公司);MULTISKAN MK3型酶标仪(美国Thermo公司);GNP-9050型恒温孵育箱(上海精宏实验设备有限公司);MDF-339型超低温冰箱(日本SANYO公司);SK-1型微量振荡器(金坛市医疗器械厂);VE-680微型垂直电泳槽、ESP-100型电泳仪、VE-186型转移电泳槽(上海天能科技有限公司)。
1.3 实验分组与模型制备
大鼠适应性喂养1周后,随机分为空白组、模型组、假手术组、电针组,每组12只。参照窦夏睿等[8]的方法制备CSR神经病理性疼痛模型。大鼠腹腔注射1%戊巴比妥钠(45 mg/kg),俯卧位姿势固定,标记第2胸椎棘突,以C7为中心,常规备皮,消毒,铺巾,在大鼠后正中线做一长约3.5 cm的切口,暴露并咬掉左侧C6/C7关节突,部分去除左侧C6横突,分离并暴露出左侧C7脊神经,C7背根神经节远端神经根用6-0丝线结扎,结扎松紧度以倒置显微镜观察神经表面动脉受压但仍有血流通过为度,由里到外逐层缝合切口。空白组不做造模处置,假手术组仅暴露神经不结扎,模型组和电针组大鼠进行模型制备。为保证结扎力度一致、组间平衡和可比性,所有手术操作均由一人完成。
1.4 干预方法
空白组正常喂养标准饲料,未给予任何干预。电针组术后第15天开始电针干预,取双侧C6、C7夹脊穴(穴位定位参照中国针灸学会实验针灸委员会制定的动物针灸穴位图谱[9]),选用华佗牌一次性针灸针(0.35 mm×13 mm)直刺进针,进针深度0.3~0.6 cm,行轻捻转提插手法,以单侧腧穴为一组,针柄连接华佗牌SDZ-H型电子针疗仪进行电针干预(波形:密波频率50 Hz、疏波频率10 Hz,电流以局部肌肉出现震颤为度),20 min/次,1次/d,连续干预14 d。模型组和假手术组在电针组干预同时间点进行捆绑处置。
1.5 检测指标及方法
1.5.1 患侧前足PWTL测定 分别在术前第1天、术后第14天、术后第28天对各组大鼠进行患侧前足热刺激诱发痛测定。将大鼠置于透明籠子中,用ZH-200型热刺痛仪照射大鼠左前足底,大鼠若出现快速缩足、扬足或者舔足反应则停止照射,记录照射持续时间。每隔5 min测量1次,重复测量3次,取3次读数的平均值。
1.5.2 Western blot法检测大鼠脊髓背角CX3CL1蛋白表达 大鼠完成热刺激诱发痛测定后,腹腔注射过量1%戊巴比妥钠处死。每组各取3只大鼠,参照杜俊英等[10]所述方法提取脊髓,取左侧C6~C7脊髓背角组织,加入适量RIPA裂解液在4 ℃冰箱放置裂解20 min,4 ℃、11 000 r/min、半径为8.61 cm离心10 min,取上清液(细胞总蛋白),BCA试剂盒蛋白定量。SDS-PAGE电泳,转膜,0.5 mL丽春红染色30 s,观察转印效果,去除染液,封闭,加入CX3CL1抗体(1∶1000),4 ℃过夜。TBST洗膜3次(每次10 min)。加入荧光标记的二抗,室温1 h振荡孵育。TBST洗膜3次(每次10 min)。ECL发光显影,置于自动凝胶成像系统分析各蛋白条带灰度值。
1.5.3 Real-time PCR检测大鼠脊髓背角CX3CL1基因的表达 大鼠完成热刺激诱发痛测定后,腹腔注射过量1%戊巴比妥钠处死。每组各取3只大鼠,提取脊髓,取左侧C6~C7脊髓背角组织,采用Trizol法对样本RNA进行提取,并按照反转录试剂盒要求反转录合成cDNA,在低温下保存,并在PCR管中制备PCR反应混合液,混匀后于PCR机上进行扩增,每个样品重复3个对照,利用2-ΔΔCT法计算CX3CL1基因的相对表达量。
1.5.4 免疫荧光法检测大鼠脊髓背角AC、CGRP、SP表达 大鼠完成热刺激诱发痛测定后,腹腔注射过量1%戊巴比妥钠处死。每组各取5只大鼠,提取脊髓,取左侧C6~C7脊髓背角组织,常规固定、脱水、液氮速冻、切片。取冰冻组织切片,室温放置使其干燥后,组化笔圈好待测组织,PBS浸润10 min,4%多聚甲醛室温下浸泡10 min,PBS漂洗切片3遍,每遍5 min,0.5% Txiton X-100室温通透5 min,PBS漂洗切片3遍,每遍5 min,室温封闭1 h,加入一抗(Anti-AC3抗体、Anti-CGRP抗体、Anti-Substance P抗体,1/100)4 ℃孵育过夜,0.1% BSA/TBST漂洗3遍,每遍5 min,避光加入荧光二抗室温孵育1 h,0.1% BSA/TBST漂洗3遍,每遍5 min,DAPI避光孵育5 min染核,PBS漂洗3遍,每遍5 min,封片剂封片,激光共聚焦显微镜400倍下观察并采图。每只大鼠随机取3张切片,每张切片观察3个视野,运用Image-pro Plus 6.0软件计算免疫荧光平均光密度值(平均光密度值=积分光密度/像素面积),取3张切片免疫荧光光密度的平均值为其密度值。
1.6 统计学处理
数据采用SPSS 26.0软件进行处理。计量资料用“x±s”表示,组间比较若满足正态性且方差齐时采用单因素方差分析,两两比较用LSD检验,方差不齐时选择Tamhane T2和Dunnett T3法进行方差检验和两两比较,若不满足正态性时采用秩和检验,均以P<0.05为差异有统计学意义。
2 结果
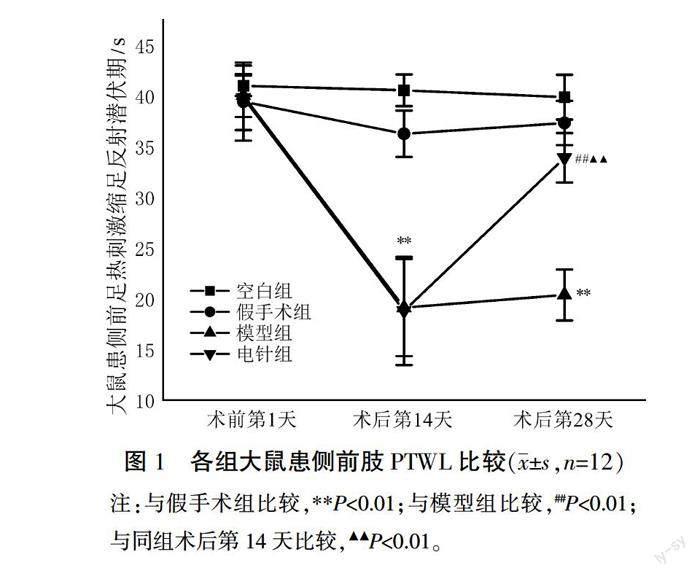
2.1 各组大鼠患侧前足PWTL比较
组间比较:术前第1天,4组大鼠患侧前足PWTL比较,差异无统计学意义(P>0.05)。各时间点与空白组比较,假手术组大鼠患侧前足PWTL差异无统计学意义(P>0.05)。术后第14天,与假手术组比较,模型组和电针组大鼠患侧前足PWTL均减少(P<0.01);模型組和电针组大鼠患侧前足PWTL比较,差异无统计学意义(P>0.05)。术后第28天,与模型组大鼠比较,电针组大鼠患侧前足PWTL升高(P<0.01)。组内比较:空白组、假手术组和模型组术后第14天和术后第28天患侧前足PWTL自身前后比较,差异无统计学意义(P>0.05);电针组术后第28天大鼠患侧前足PWTL较术后第14天升高(P<0.01)。详见图1。
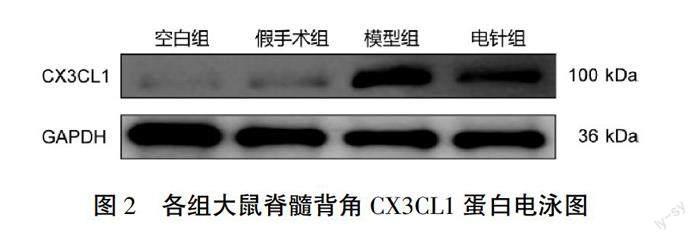
2.2 各组大鼠脊髓背角CX3CL1相对表达水平比较
与空白组比较,假手术组大鼠脊髓背角CX3CL1蛋白和基因表达差异无统计学意义(P>0.05);与假手术组相比,模型组大鼠脊髓背角CX3CL1蛋白和基因表达明显增多(P<0.01);与模型组相比,电针组大鼠脊髓背角CX3CL1蛋白和基因表达明显减少(P<0.01)。详见表1、图2。
2.3 各组大鼠脊髓背角AC、CGRP、SP表达比较
与空白组相比,假手术组大鼠脊髓背角AC、CGRP、SP平均光密度值差异无统计学意义(P>0.05);与假手术组比较,模型组大鼠脊髓背角AC、CGRP、SP平均光密度值明显增多(P<0.01);与模型组相比,电针组大鼠脊髓背角AC、CGRP、SP平均光密度值明显减少(P<0.05)。详见图3—5。
3 讨论
CSR主要表现为颈肩部疼痛,伴有神经根分布一致的放射性根性疼痛,严重者可能伴有功能障碍,影响人们的生活质量[11]。中医学认为,神经根型颈椎病属于“颈痹”“眩晕”范畴。《素问·缪刺论篇》曰:“邪客于太阳之络,令人头项痛……”本研究选取的颈夹脊穴位于膀胱经和督脉之间。督脉总督一身之阳气,有“阳脉之海”之称。《灵枢·经脉》曰“足太阳膀胱经……是主筋所生病者”,且膀胱经挟颈两侧循行于人体阳位腰背部,又为多气多穴之经,“经脉所过,主治所及”,故针刺可以达到祛瘀散结、柔筋养脉、缓解肌肉疼痛的目的。从神经区域分布出发,颈部夹脊穴每穴下都有从相应的椎骨下方发出的脊神经后支及动静脉丛,刺激夹脊穴可通过影响脊神经的传导调节肢体的感觉和运动功能[12]。研究表明,刺激夹脊穴抑制疼痛的机制可能是通过调节疼痛相关蛋白基因的表达[13]。
CSR的发病机制以机械压迫学说[14]、自身免疫学说[15]和化学性神经根炎学说[16]3种学说为主,但神经炎症损伤是其病理的共同基础,属于神经病理性疼痛。DONNELLY等[17]研究表明,电针治疗对神经病理性疼痛有显著镇痛作用。本实验通过电针C6、C7夹脊穴治疗CSR大鼠,实验结果显示,经电针干预后,大鼠PWTL显著升高,表明电针能改善CSR所致神经病理性疼痛的热敏痛,与既往研究相同。
神经病理性疼痛常由多种复杂机制引起,动物实验表明,神经病理性疼痛的产生和维持与外周敏化和中枢敏化的发生关系密切[18]。CGRP为多功能神经肽,可作为促炎神经肽与其他炎性介质相互作用,产生外周敏化的作用;或是与其受体结合,激活第二信使系统促进中枢敏化[19]。研究表明,结扎大鼠坐骨神经,CGRP含量升高,并导致异常性疼痛和痛觉过敏[20]。而α-CGRP基因敲除的小鼠在热刺激下疼痛敏感性降低,表明CGRP与痛觉过敏相关,且疼痛强度与CGRP含量表达呈正相关性[21]。AC是一种膜整合蛋白,为调控细胞内第二信使cAMP的信号中枢[22]。SP是一种速激肽,广泛分布于神经系统中,对神经病理性疼痛的产生起关键作用。ZIEGLG?魧NSBERGER等[23]研究表明,SP作为疼痛递质在多种慢性疼痛中参与疼痛在脊髓中枢的传导和调制。既往研究表明,SP可激活伤害感受神经元完成疼痛信号的传递[24]。而CGRP可通过竞争SP的降解内肽酶增强SP的生物活性[25]。本实验结果显示,模型组大鼠脊髓背角的AC3、CGRP和SP的表达量较假手术组明显增加,表明造模成功后,脊髓背角的AC3、CGRP和SP表达水平较无损状态高,其表达的强度与周围神经的损伤密切相关,说明AC3、CGRP和SP表达的升高与CSR所致的神经病理性疼痛机制密切相关。与模型组比较,电针组的AC3、CGRP和SP的表达量明显降低,而CGRP与相应受体的结合能够激活AC的信号中枢促进中枢敏化,与SP竞争降解酶而增强SP的活性,实验结果提示电针颈夹脊穴可能通过抑制CGRP的表达,从而抑制AC信号中枢的传递,或降低SP的活性和表达,从而抑制神经元的兴奋信号通路的传递,阻碍脊髓背角的中枢敏化,减轻神经被压迫引起的神经病理性疼痛。故电针颈夹脊穴治疗CSR相关机制可能与其抑制AC3、CGRP和SP的表达,从而抑制神经元细胞的兴奋性,降低疼痛信号的传递有关。
趋化因子及其受体介导的信号转导通路是疼痛传导和治疗的重要分子机制[26]。研究表明,趨化因子在神经炎性反应过程中的合成显著升高,从而激活传入感觉神经中的趋化因子受体,活化的趋化因子受体能激发神经元产生强烈的兴奋从而引起疼痛[27-28]。CX3CL1通过传递神经损伤产生的疼痛信息来调控疼痛[29]。神经元释放的CX3CL1介导的信号可刺激促炎细胞因子的释放而促进疼痛的发生[30]。本实验结果显示,与假手术组比较,模型组和电针组的趋化因子CX3CL1蛋白和基因的表达水平均明显上调;与模型组相比,电针组的趋化因子CX3CL1蛋白和基因的表达明显降低。上述结果说明电针颈夹脊穴可以有效抑制趋化因子CX3CL1蛋白和基因的表达,使趋化因子CX3CL1及其相关受体介导的信号转导通路传导降低或中断,因此,抑制了神经炎性的反应从而抑制神经元的兴奋引起的疼痛。
综上所述,电针颈夹脊穴治能够改善CSR神经病理性疼痛模型大鼠的热痛觉过敏,并通过抑制脊髓背角初级感觉神经元的CX3CL1、AC3、CGRP和SP合成表达,减轻神经炎性反应,降低脊髓背角初级感觉神经元的兴奋性,从而抑制神经中枢的敏化。
参考文献
[1] 王和鸣,黄桂成.中医骨伤科学[M].3版.北京:中国中医药出版社,2012:262.
[2] 吴子龙,杨利学.神经根型颈椎病引起根性痛的研究进展[J].中西医结合研究,2013,5(5):269-271.
[3] 魏 戌,高 云,张兴平,等.基于临床科研信息共享系统的神经根型颈椎病发病特征分析[J].中医杂志,2015,56(19):1663-1666.
[4] ONDA A, KIMURA M. Comparisons between the efficacy of limaprost alfadex and pregabalin in cervical spondylotic radiculopathy: Design of a randomized controlled trial[J]. Fukushima Journal of Medical Science, 2018, 64(2): 73-81.
[5] 钟 灵,冉小烽,高 琼.综合康复训练治疗神经根型颈椎病效果及影响预后的相关因素分析[J].解放军医药杂志,2019,31(8):53-56.
[6] 梁 龙,杨克斯,周帅琪,等.穴位埋线治疗神经根型颈椎病系统评价[J].中医药导报,2020,26(12):133-138.
[7] 袁 柯,杨 芳,郭 强.针刺治疗神经根型颈椎病临床疗效与针刺深度的关系[J].上海针灸杂志,2020,39(10):1295-1299.
[8] 窦夏睿,孙建宁,王 威,等.急性期神经根型颈椎病模型的建立[J].北京中医药大学学报,2006,29(5):332-334,343,361.
[9] 华兴邦,周浩良.大鼠穴位图谱的研制[J].实验动物与动物实验,1991(1):1-5.
[10] 杜俊英,方剑乔,梁 宜,等.大鼠脊髓提取改良法[J].中华病理学杂志,2011,40(2):115-116.
[11] 房晓阳,王 楠,谢 林.从筋骨理论探讨神经根型颈椎病治疗机制[J].陕西中医,2022,43(12):1771-1773.
[12] 仉会玉,秦晓光,雒明栋.华佗夹脊穴临床应用研究进展[J].中医药学报,2020,48(1):67-71.
[13] 羊 璞,惠建荣.夹脊穴电针与脊髓电刺激治疗疼痛的异同探析[J].吉林中医药,2021,41(5):680-684.
[14] 朱 巍,贾连顺.神经根型颈椎病根性痛发病机制的研究进展[J].中华骨科杂志,2004(12):761-764.
[15] MURAI K, SAKAI D, NAKAMURA Y, et al. Primary immune system responders to nucleus pulposus cells: Evidence for immune response in disc herniation[J]. European Cells & Materials, 2010, 19: 13-21.
[16] GOUPILLE P, JAYSON M I, VALAT J P, et al. The role of inflammation in disk herniation-associated radiculopathy[J]. Seminars in Arthritis and Rheumatism, 1998, 28(1): 60-71.
[17] DONNELLY C R, ANDRIESSEN A S, CHEN G, et al. Central nervous system targets: Glial cell mechanisms in chronic pain[J]. Neurotherapeutics, 2020, 17(3): 846-860.
[18] 伍 磊,林 洪,沙 漠,等.神经病理性疼痛的发病机制研究进展[J].中国临床神经外科杂志,2014,19(3):186-188.
[19] 龙灿海,王静霞,周小翠,等.降钙素基因相关肽与疼痛相关研究进展[J].中国疼痛医学杂志,2021,27(10):771-775.
[20] REN H, JIN H L, JIA Z P, et al. Pulsed radiofrequency applied to the sciatic nerve improves neuropathic pain by down-regulating the expression of calcitonin gene-related peptide in the dorsal root ganglion[J]. International Journal of Medical Sciences, 2018, 15(2): 153-160.
[21] ISHIDA K, KAWAMATA T, TANAKA S, et al. Calcitonin gene-related peptide is involved in inflammatory pain but not in postoperative pain[J]. Anesthesiology, 2014, 121(5): 1068-1079.
[22] 楊琰茗,杨雅清,宋 杲,等.腺苷酸环化酶的研究进展[J].临床与病理杂志,2019,39(2):390-394.
[23] ZIEGLG?魧NSBERGER W. Substance P and pain chronicity[J]. Cell and Tissue Research, 2019, 375(1): 227-241.
[24] DONNELLY C R, CHEN O Y, JI R R. How do sensory neurons sense danger signals?[J]. Trends in Neurosciences, 2020, 43(10): 822-838.
[25] LE GREVèS P, NYBERG F, H?KFELT T, et al. Calcitonin gene-related peptide is metabolized by an endopeptidase hydrolyzing substance P[J]. Regulatory Peptides, 1989, 25(3): 277-286.
[26] 李鸿雁,李 彤,倪家骧.趋化因子及其受体在疼痛过程中的机制和作用[J].中国全科医学,2017,20(29):3675-3678.
[27] BAO-CHUN, JIANG. Chemokines in chronic pain: Cellular and molecular mechanisms and therapeutic potential[J]. Pharmacology & Therapeutics, 2020, 212: 107581.
[28] LI Y H, FANG Z P, GU N, et al. Inhibition of chemokine CX3CL1 in spinal cord mediates the electroacupuncture-induced suppression of inflammatory pain[J]. Journal of Pain Research, 2019, 12: 2663-2672.
[29] 莫岩君,张羽墨,于天源,等.“三法三穴”推拿手法对坐骨神经损伤大鼠痛觉功能和脊髓背角CX3CL1/CX3CR1表达的调节[J].中国康复理论与实践,2020,26(2):189-196.
[30] MONTAGUE-CARDOSO K, MROZKOVA P, MALCANGIO M. The role of spinal cord CX3CL1/CX3CR1 signalling in chronic pain[J]. Current Tissue Microenvironment Reports, 2020, 1(2): 23-29.
〔收稿日期〕2022-08-09
〔基金项目〕科技部研发计划重点专项(2018YFC1707806);湖南省自然科学基金面上项目(2019JJ40217);湖南省临床医疗技术创新引导项目(S2020SFYLJS0039)。
〔第一作者〕林伟弟,男,硕士研究生,研究方向:针刺作用机制的研究。
〔通信作者〕*蒋学余,男,博士,主任医师,硕士研究生导师,E-mail:346252900@qq.com。
