绿原酸对肾癌A498和769-P细胞增殖、迁移和侵袭的影响
2023-05-30陈海滨王立姣赵建军
陈海滨,王立姣,赵建军,谭 超
(河北工程大学附属医院:1.泌尿外二科,2.呼吸内二科,河北邯郸 056004)
肾细胞癌又称肾腺癌,是一种起源于肾小管上皮细胞的恶性肿瘤,占全身恶性肿瘤的2%~3%,每年导致全球大约140余万人死亡[1]。外科手术一直是治疗肾癌的首选方法,但患者常常出现复发或转移,且肾细胞癌中有多种耐药蛋白过度表达,常规化疗收效甚微。近年来,靶向与免疫联合治疗已成为肾癌领域的研究热点,但治疗后部分患者也将面临着耐药问题[2-3]。因此临床上急需寻求治疗肾细胞癌的新策略。
绿原酸是常见的多酚类化合物,主要存在于金银花、山银花、杜仲叶及咖啡豆等天然植物中[4],已被证明具有广泛的药理活性,如抗氧化、抗凝血、降血糖、抗病毒等作用[5]。此外,多项研究表明,绿原酸具有抗癌特性。REFOLO等[6]报道绿原酸联合瑞戈非尼对人肝细胞癌有明显抑制作用。FENG等[7]报道绿原酸对D-半乳糖引起的肾损伤有保护作用。我们推测绿原酸可能对肾细胞癌也具有抗肿瘤活性。本研究以肾癌细胞株A498、769-P为研究对象,观察绿原酸对肾癌细胞增殖、转移的影响,并探讨其可能的机制。
1 材料与方法
1.1 细胞与试剂人肾癌A498,769-P细胞购自中国科学院上海细胞库;RPMI 1640培养基、胎牛血清(fetal bovine serum,FBS)1640购自美国Gibco公司;四甲基偶氮唑盐(methyl thiazoIyl tetrazolium,MTT)购自北京索莱宝科技有限公司;BCA检测试剂盒购自上海捷瑞生物科技有限公;Transwell板购自美国Corning公司;白介素-1β(Interleukin-1β,IL-1β)ELISA试剂盒购自美国RD公司;缺氧诱导因子-2α(endothelial PAS domain protein-1,EPAS-1/HIF-2α)、蛋白激酶B(AKT)、磷酸化AKT(p-AKT)和核转录因子-κB(P65)、磷酸化核转录因子-κB(p-P65)、小鼠抗-IL-1β抗体(anti-IL-1β)均购自美国CA公司;羊抗兔二抗购自北京中杉金桥生物技术有限公司;电化学(electrochemiluminescence or electrogeneraTED CHEMILUMINESCENCE,ECL)发光试剂盒购自美国Pierce公司;荧光显微镜购自日本Olympus公司;实时荧光定量PCR仪购自美国Biosystems公司。
1.2 细胞培养及分组[8]人肾癌A498和769-P细胞分别用RPMI 1640培养基(含体积分数为10%的 FBS和体积分数为1%的青霉素-链霉素)于37 ℃、体积分数为5%的 CO2及饱和湿度的培养箱中培养。用体积分数为0.25%的胰酶消化传代,待细胞融合至80%后,加入0 μL绿原酸溶液,作为对照组;加入200 μL绿原酸溶液(含绿原酸1 μmol/L),作为绿原酸组;加入0 μL绿原酸溶液和40 μL小鼠IL-1β抗体(1 μg/μL),作为对照+anti-IL-1β组;加入200 μL绿原酸溶液(含绿原酸1 μmol/L)和40 μL人IL-1β抗体(1 μg/μL),作为绿原酸+anti-IL-1β组。各组细胞于恒温培养箱中继续培养72 h。
1.3 MTT法检测细胞增殖能力取细胞采用胰蛋白酶进行消化,接种于96孔培养板(1×105个/mL),置于37 ℃、含体积分数为5%的CO2的培养箱内培养24、48、72 h。每组设6个复孔。实验结束前,加入20 μL MTT培养4 h后弃去培养液,于室温加入DMSO振荡10 min溶解结晶,采用酶标仪检测波长570 nm吸光度值,实验重复3次,以3次的平均值作为该项的结果值。
1.4 Transwell小室法检测细胞侵袭能力取细胞,弃去培养液,PBS洗涤2次。用无血清培养基调整细胞浓度为4×105个/mL,取100 μL细胞悬液于Transwell小室上层,将无血清的RPMI 1640培养基(400 μL)加入Transwell小室上层,而RPMI 1640培养基(含体积分数为10%的FBS)加入下层。在培养箱中继续培养24 h,取出小室,用棉签将上室底部基底膜上的细胞刮除,室温下用40 g/L多聚甲醛固定10 min,结晶紫染色30 min。倒置显微镜下选取5个视野拍照,统计穿膜细胞数,实验重复3次,以3次的平均值作为该项的结果值。
1.5 划痕实验检测细胞迁移能力取细胞,接种于6孔板内(密度4×105个/mL),当细胞单层长满时,用移液器枪头沿孔板底部划一条直线。倒置显微镜下于0 h和24 h拍照记录,并计算细胞迁移率。实验重复3次,以3次的平均值作为该项的结果值。
1.6 ELISA检测细胞上清液中IL-1β水平取细胞,收集细胞上层培养基,离心将上清转入离心管中备用。依据酶联免疫(Enzyme linked immunosorbent assay,ELISA)试剂盒说明书操作,检测细胞上清液中IL-1β水平。
1.7 实时荧光定量PCR(real-time fluorescence quantitative PCR,qRT-PCR)法检测细胞 EPAS-1 mRNA表达收集细胞,用Trizol提取总 RNA,利用逆转录试剂盒进行反转录 cDNA合成,反应条件如下:预变性95 ℃、5 min,95 ℃变性30 s,56 ℃退火30 s,74 ℃延伸7 min,循环40次。实时荧光使用7900HT Fast Real-Time检测。以GAPDH为内参,用2-ΔΔCt法计算目的基因的相对表达量,每组细胞测定3次,以3次的平均值作为该项的结果值。
1.8 Western blot检测细胞EPAS-1及AKT/P65信号通路相关蛋白表达收集细胞,PBS清洗,加RIPA裂解液和蛋白酶抑制剂,离心收集蛋白。用BCA法测定总蛋白量,取25 μg蛋白上样,采用聚丙烯酰胺凝胶(SDS-polyacrylamide gel electrophoresis,SDS-PAGE)电泳分离蛋白,然后转至PVDF膜上,用含25 g/L脱脂奶粉封闭1 h,分别加入EPAS-1(1∶1 000)、AKT(1∶1 000)、p-AKT(1∶2 000)、P65(1∶500)和p-P65(1∶1000)一抗,室温孵育过夜,洗涤,再加入辣根过氧化酶标记的二抗孵育1 h,经ECL显色后曝光显影。

2 结 果
2.1 绿原酸对A498、769-P细胞增殖能力的影响用绿原酸刺激A498、769-P细胞24、48、72 h后,与对照组比较,绿原酸组可显著抑制A498、769-P细胞的增殖,且呈时间依赖性(P<0.05,表1)。
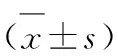
表1 绿原酸对人肾癌A498和769-P细胞增殖能力的影响inparagraph
2.2 绿原酸对A498、769-P细胞侵袭能力的影响在人肾癌A498细胞中,对照组和绿原酸组穿膜细胞数分别为(197.9±12.2)个/视野、(50.4±8.3)个/视野,与对照组比较,绿原酸组穿膜细胞数减少(P<0.01)。
在人肾癌769-P细胞中,对照组和绿原酸组穿膜细胞数分别为(145.7±11.4)个/视野、(59.2±9.7)个/视野,与对照组比较,绿原酸组穿膜细胞数减少(P<0.01,图1)。

A:A498细胞侵袭能力比较;B:769-P细胞侵袭能力比较。图1 A498和769-P细胞侵袭能力比较(Transwell小室,×400)
2.3 绿原酸对A498、769-P细胞迁移能力的影响在人肾癌A498细胞中,对照组和绿原酸组细胞24 h迁移率分别为(67.8±12.4)%、(23.2±4.3)%;在人肾癌769-P细胞中,对照组和绿原酸组细胞24 h迁移率分别为(54.2±10.0)%、(38.6±6.3)%。在人肾癌A498或769-P细胞中,绿原酸组细胞迁移率均低于对照组(P<0.05,图2)。

A:A498细胞迁移情况比较;B:769-P细胞迁移情况比较。图2 A498、769-P细胞迁移情况比较(划痕实验)
2.4 细胞上清液中IL-1β水平的比较在人肾癌A498细胞中,对照组和绿原酸组细胞上清液中IL-1β水平分别为(1.76±0.56)pg/mL、(0.87±0.41)pg/mL;在人肾癌769-P细胞中,对照组和绿原酸组细胞上清液中IL-1β水平分别为(1.89±0.72)pg/mL、(0.92±0.43)pg/mL。在人肾癌A498或769-P细胞中,绿原酸组细胞上清液中IL-1β水平低于对照组(P<0.05)。
2.5 A498和769-P细胞中EPAS-1 mRNA表达水平在人肾癌A498或769-P细胞中,绿原酸组EPAS-1mRNA表达水平低于对照组(P<0.05);加入anti-IL-1β后,与对照组比较,对照+anti-IL-1β组EPAS-1 mRNA表达下降(P<0.05,表2)。

表2 人肾癌A498和769-P细胞中EPAS-1mRNA表达水平
2.6 细胞AKT/P65信号通路蛋白的表达情况在人肾癌A498或769-P细胞中,4组细胞AKT、P65蛋白表达差异无统计学意义(P>0.05)。与对照组比较,绿原酸组p-AKT、p-P65蛋白表达水平降低(P<0.05)。加入anti-IL-1β后,与对照组比较,对照+anti-IL-1β组p-P65表达下降(P<0.05,图3、表3)。

1.绿原酸组;2.对照组;3.绿原酸+anti-IL-1β组;4.对照+anti-IL-1β组。图3 A498和769-P细胞AKT/P65相关蛋白表达水平
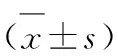
表3 人肾癌A498和769-P细胞中p-AKT、p-P65蛋白相对表达水平
3 讨 论
肿瘤的发生发展涉及多种信号传导通路的失调,是多因素共同作用的结果。挖掘新靶点和新信号通路已成为肾癌新药研发领域的热点。高频VHL基因失调是肾细胞癌典型特征,尤其是亚型肾透明细胞癌高达90%以上。VHL基因的失调,造成大量EPAS-1聚集,引起血管内皮生长因子的过表达,促进肿瘤的发生[9]。已有大量研究证明降低EPAS-1表达可明显抑制恶性细胞的侵袭和迁移,从而抑制肾癌发展[10-11]。因此,寻找靶向EPAS-1抑制剂被看作肾癌治疗的新方向。
划痕实验和Transwell结果显示绿原酸能够抑制A498、769-P细胞的侵袭和迁移;MTT结果显示,绿原酸能抑制A498、769-P肾癌细胞的增殖,且呈时间依赖性,提示绿原酸可能具有治疗肾细胞癌的作用。qRT-PCR检测发现:在人肾癌A498或769-P细胞中,与对照组比较,绿原酸组EPAS-1 mRNA的表达水平降低(P<0.05)。这提示绿原酸可抑制肾癌细胞EPAS-1表达,从而抑制肾癌上皮间充质转化,减少肾癌细胞的侵袭与转移。因此,绿原酸可能成为一种新的EPAS-1抑制剂。
炎性细胞因子在癌细胞转移方面扮演着重要角色,在肾透明细胞癌、肝癌及胰腺癌等众多恶性肿瘤中呈现异常高表达。有研究报道白介素8(IL-8)可促进膀胱癌转移[12],白介素6(IL-6)与食管癌患者的不良预后相关[13],IL-1β与肾癌细胞的转移相关[14]。研究报道,在SW1353细胞和人原代软骨细胞中,IL-1β可通过EPAS-1的表达来调节分解代谢因子的表达[15]。本研究发现,用抗-IL-1β抗体处理肾癌A498或769-P细胞可明显抑制EPAS-1表达,与过往报道一致。ELISA检测发现:绿原酸与A498或769-P细胞共培养72 h后,细胞上清液中IL-1β水平降低(P<0.05)。推测绿原酸可能是通过抑制IL-1β分泌,抑制了EPAS-1表达,进而抑制肾癌细胞的增殖,减少肾癌细胞的侵袭和迁移。
目前炎性因子抑制肾癌细胞中EPAS-1的机制尚不清楚,但有文献报道EPAS-1的表达受AKT/P65信号通路的调控[16]。另一研究证实[17],AKT/P65信号级联可由IL-1β激活,即IL-1β可激活AKT磷酸化,促进P65磷酸化,释放P65转移至细胞核,调控多种基因表达。本研究中,用抗-IL-1β抗体处理肾癌细胞后,可明显抑制p-AKT、p-P65蛋白表达水平,与文献报道一致,说明抑制炎性因子IL-1β可抑制AKT/P65信号通路;Western blot检测发现,在人肾癌A498或769-P细胞中,与对照组比较,绿原酸组p-AKT、p-P65蛋白表达水平降低,推测绿原酸可能通过抑制IL-1β的分泌,抑制AKT/P65通路。
综上所述,绿原酸能够抑制肾癌细胞侵袭转移,该作用可能与抑制IL-1β分泌,从而抑制AKT/P65信号通路,进而调控EPAS-1的表达相关。本研究发现绿原酸对肾癌细胞的影响,特别对EPAS-1有抑制作用,为绿原酸进一步开发利用提供实验依据。但本研究并未深入探讨药物对肾癌细胞增殖凋亡存在的影响,以及体内实验的情况,因此绿原酸是否能有效治疗肾细胞癌值得进一步研究。下一步我们将进行绿原酸对肾癌细胞增殖凋亡的研究,并考察其相关作用机制。
