PN与RN治疗T1b和T2a期肾细胞癌疗效及安全性比较的分析
2023-05-30邓继意吴思承林粮文陈卫民胡政邦
邓继意,吴思承,林粮文,陈卫民,胡政邦
(1.南昌大学第一附属医院泌尿外科,江西南昌 330000;2.南昌大学第一附属医院急诊科,江西南昌 330000)
目前,肾癌的外科治疗方式主要包括肾部分切除术(partial nephrectomy,PN)和根治性肾切除术(radical nephrectomy,RN),PN已经成为T1a期肾癌的“金标准”[1-2],与RN相比,具有相似的肿瘤学结果以及更好的肾功能保护作用,并且能降低与慢性肾脏病(chronic kidney diseases,CKD)相关的心脏病发病风险而获得生存获益,而对于体积较大的T1b和T2a期局限性肾癌,RN仍被视为参考标准[2-3]。目前,随着腔镜技术的发展及机器人辅助技术的不断创新,PN的适应证范围也在不断发生着变化并呈现逐渐扩大的趋势,关于PN治疗T1b和T2a期(肿瘤直径>4 cm)肾癌的研究越来越多。PN在治疗T1a期肾癌时所具备的优势能否在治疗T1b和T2a期肾癌时得以延续,这一问题仍有待进一步研究与探讨。目前,各学者对于临床T1b期及T2a期肾癌行PN还是RN尚存争议,本文回顾性分析南昌大学第一附属医院收治的115例T1b和T2a期肾癌患者的临床资料,通过对比PN与RN治疗临床T1b和T2a期肾癌的疗效、手术安全性及两者长期生存结果,为临床工作中术式的选择提供有力的理论指导依据。
1 资料与方法
1.1 一般资料回顾性分析2014年4月-2017年7月于南昌大学第一附属医院泌尿外科收治的115例T1b和T2a期肾癌患者资料,根据手术方式不同分为PN组(n=55)和RN组(n=60),一般临床资料详见表1。
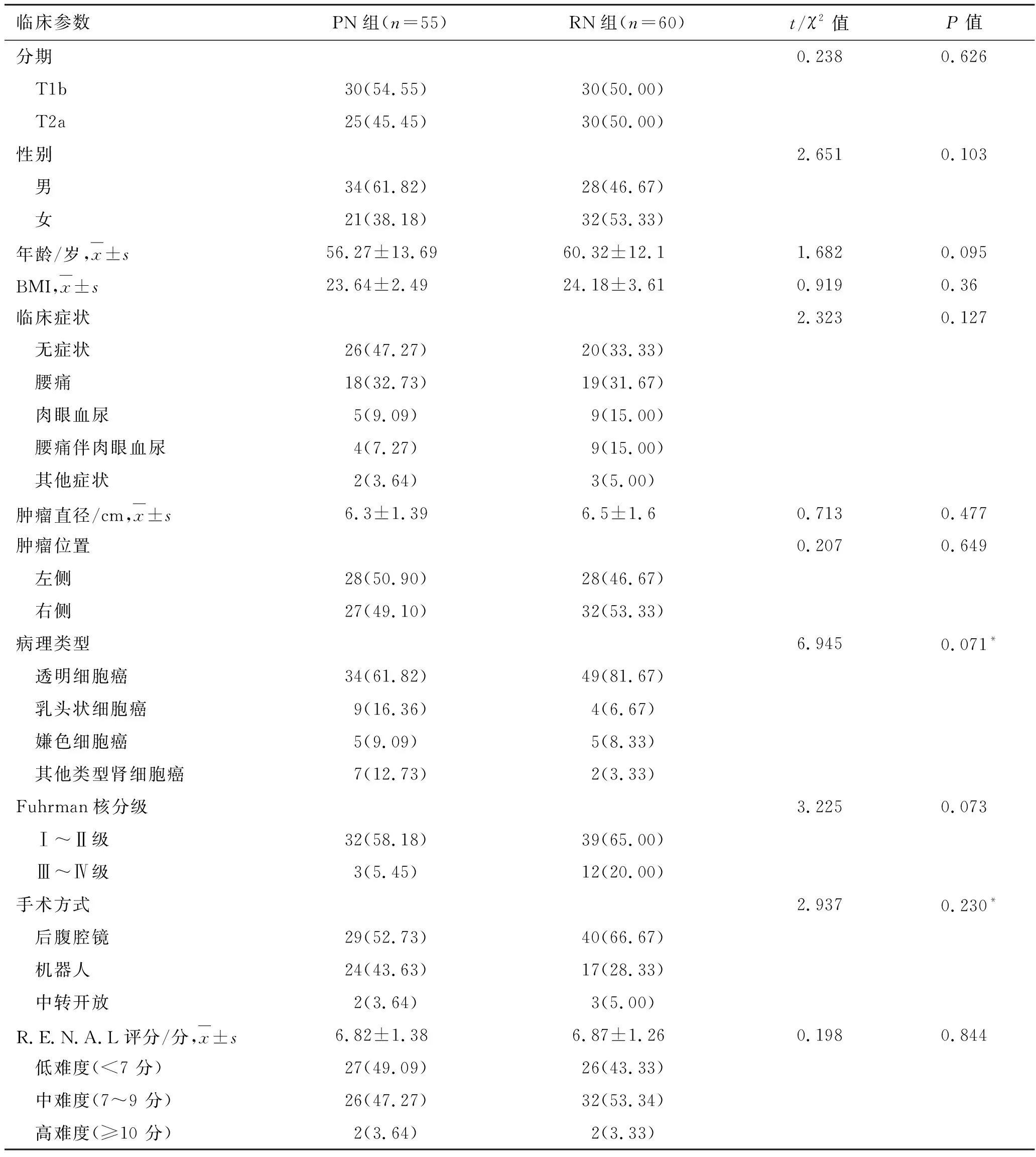
表1 不同手术方式治疗T1b、T2a期肾癌患者的一般及临床资料比较 [例(%)]
纳入标准:①所有病例均为单发瘤体,病灶呈局限性;②术前根据计算机断层扫描(computed tomography,CT)(平扫+增强)、计算机断层扫描静脉造影/成像(computed tomography venography/angiography,CTV/A)、计算机断层扫描泌尿系造影(computed tomography urography,CTU)、泌尿系彩超等证实符合T1b~2aN0M0期,且无其他恶性肿瘤病史及远处转移的患者;③术后病理证实为肾癌,且与术前TNM分期一致;④干预措施为PN及RN,不限定手术方式是否为开放手术、机器人辅助或后腹腔镜手术;⑤病例和病理结果完整。排除标准:①1年内无法联系的病例;②孤立肾或者双肾多发肾癌;③合并其他恶性肿瘤的病例;④术后病理证实为非肾细胞癌,如肾错构瘤;⑤伴有远处转移和淋巴结转移的肾癌;⑥非T1b~2aN0M0期肾癌;⑦有手术禁忌证的患者。
1.2 手术方法PN组:全身麻醉后,行后腹腔镜肾部分切除术手术时,于腋后线12肋下2 cm处腰大肌前沿尖刀做一3 cm长切口,大弯钳分离至腹膜后,插入球囊扩张器注气600 mL,扩张腹膜后隙,分别在髂嵴上2 cm、肋下腋前线穿入10、5 mm Trocar并留置套管,腋后线处留置12 mm Trocar套管。机器人辅助PN建立后腹膜操作空间同后腹腔镜PN,随后在髂嵴上2 cm穿入12 mm加长Trocar,用于放置da Vinci腹腔镜专用Trocar。腋后线放置da Vinci 8 mm Trocar用丝线固定,用于da Vinci专用双极电凝钳,插入da Vinci腹腔镜,在da Vinci腹腔镜直视下分别放置如下Trocar:肋下腋前线穿入da Vinci 8 mm Trocar用于da Vinci专用单极电凝,在此Trocar外下方约8 cm处放置助手12 mm Trocar,与腹腔镜加长Trocar形成等边三角形,将三个机械臂连接Trocar,并置入机器人腹腔镜、单极电剪及双极电凝钳。后续操作两者相似,分离腹膜外脂肪后,切开Gerota筋膜与肾周脂肪,游离肾脏,找到肾脏肿瘤。在肾中部腰大肌表面找到肾动脉,用哈巴狗夹钳闭。用剪刀距肿瘤边缘0.5 cm剪开正常肾实质直至将肾肿瘤完整切除,用倒刺线缝合创面,记录肾缺血时间,缝合完毕后将哈巴狗夹取掉,未见活动性出血。经腋后线穿刺孔处取出标本,放置引流管,缝合切口。若术中发现肾周粘连严重,无法分离出肾脏周围正常组织及肾动、静脉,遂中转开放手术。
RN组:前期建立后腹膜操作空间和Trocar处理方式同PN组,后续机器人和后腹腔行RN操作两者相似,分离腹膜外脂肪后,在Gerota筋膜与腹膜之间分离后,于肾中部腰大肌表面找到肾动脉及静脉,Hem-o-lok及切割闭合器夹闭切断,在Gerota筋膜外充分游离肾脏后,游离并切断输尿管,切下患肾,取患侧下腹切口长约7 cm,取出标本,放置引流管,缝合切口。若术中发现肾周粘连严重,无法分离出肾脏周围正常组织及肾动、静脉,遂中转开放手术。
1.3 纳入分析的指标查阅和收集患者术前临床资料[姓名、年龄、性别、主诉、临床症状、体质量指数(body mass index,BMI)、肿瘤大小、Fuhrman分级、肿瘤位置、肿瘤病理类型、手术方式、R.E.N.A.L评分]、围手术相关因素[手术时间、术中出血量、引流管留置时间、术后住院时间、PN组热缺血时间、术后血红蛋白(hemoglobin,Hb)变化值、术中术后输血情况、二次手术、手术切缘阳性],手术并发症及术后严重并发症(Clavien分级≥3级),肾功能恢复效果[术后第1天及第3、6、12个月血清肌酐(serum creatinine,Scr)],所有患者随访5年以上,并通过查阅影像复查资料和电话随访了解两组患者的肿瘤学指标,统计患者的5年生存率、总生存率、复发转移率和肿瘤特异性生存率。
1.4 术后随访根据指南推荐,随访包括:病史询问、体格检查、血常规、血生化检查、胸片、泌尿系彩超、胸部CT以及腹部CT检查视具体情况而定,骨转移症状如骨痛或者碱性磷酸酶异常升高可进行骨扫描检查。肾癌的随访时限:对于T1~2期患者每3~6个月检查1次连续3年,以后每年检查1次,对于未按时复诊的患者进行电话随访,获取其生存信息。
2 结 果
2.1 不同手术方式组肾癌患者围手术期相关因素比较PN组与RN组在手术时间、术中出血量、引流管留置时间、术后住院时间、术后Hb变化值、切缘阳性数、二次手术等方面比较差异均无统计学意义(P>0.05),PN组有4例(7.27%)术后输血,其中2例为继发性出血,考虑切除肿瘤后创口未缝合完全,创面出血引起贫血,1例后腹腔渗血,形成血肿引起贫血,还有1例术中出血较多术后导致贫血。RN组有3例(5.00%)术中、术后输血,其中术中1例为分离肾动脉时血管破裂,出血量达1 100 mL,遂行紧急输血,术后2例考虑术区渗血、术中出血较多引起术后贫血,均予以输血、止血药物等保守治疗,两组比较差异无统计学意义(P>0.05,表2)。
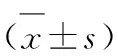
表2 不同手术组治疗T1b、T2a期肾癌患者围手术期相关因素比较
2.2 不同手术方式肾癌患者手术并发症发生情况的比较PN组手术并发症明显高于RN组,两组差异有统计学意义(P=0.024),而在术后严重并发症(Clavien分级≥3级)发生情况方面,PN组有4例(7.27%),其中2例为继发性出血,术后行肾动脉栓塞治疗,1例后腹腔渗血,术后第3天行腹腔探查加后腹腔止血术,还有1例术后出现输尿管梗阻、尿瘘,分别于术后进行经皮肾穿刺造瘘和后腹腔肾盂离段成形术;RN组有2例(3.33%)患者发生严重并发症,1例术区渗血,术后第3天行腹腔探查加后腹腔止血术,还有1例术后监护提示患者间断出现心脏骤停,考虑患者心脏功能差,遂送往重症监护室(intensive care unit,ICU)进行治疗,两组术后严重并发症(Clavien分级≥3级)发生情况比较差异无统计学意义(P>0.05,表3)。
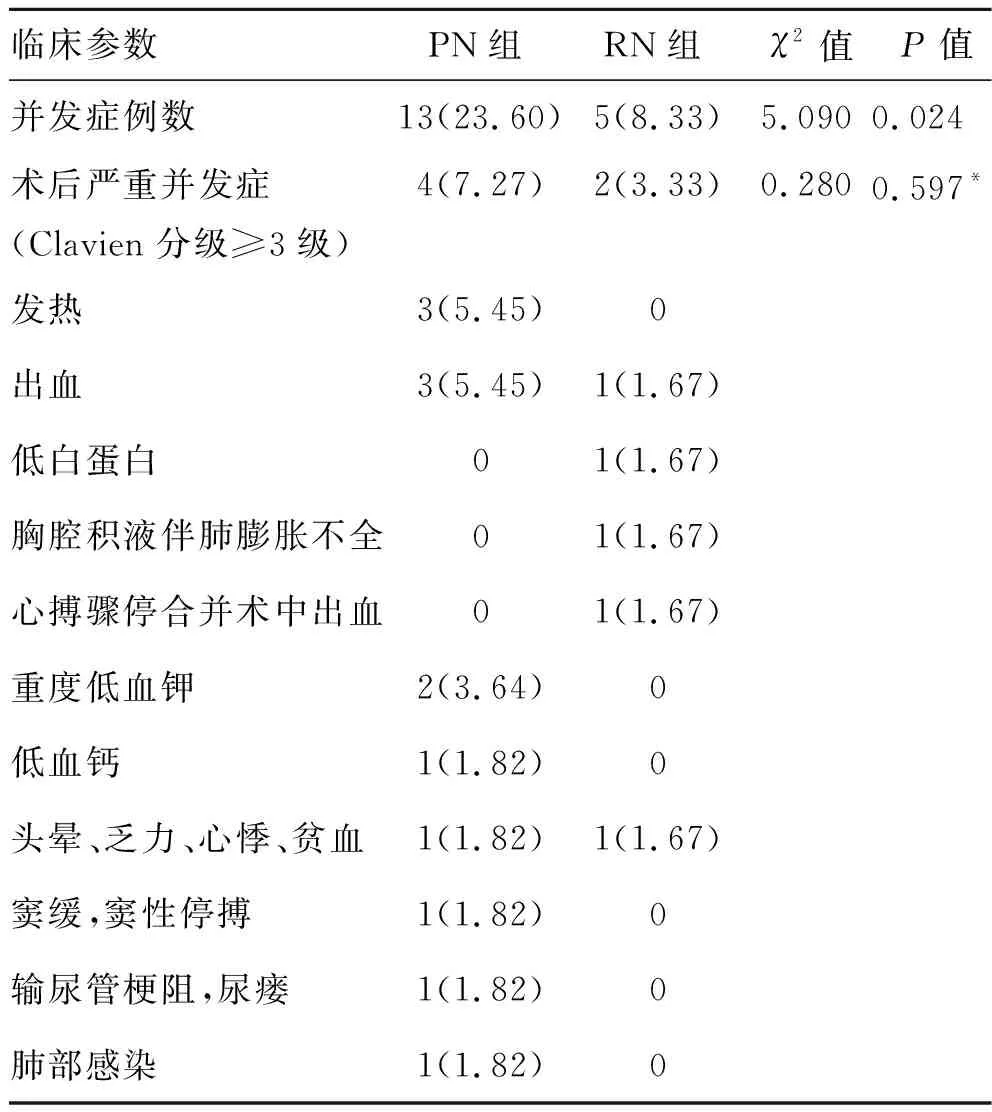
表3 两组肾癌患者手术并发症发生情况的比较 [例(%)]
2.3 不同手术方式肾癌患者肾功能恢复效果的比较两组患者术前血肌酐差异无统计学意义(P>0.05),而PN组术后第1天,第3、6、12个月血肌酐明显低于RN组,相比较差异有统计学意义(P<0.05,表4)。
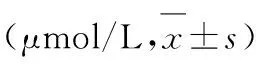
表4 两组患者术前术后Scr值比较
2.4 两组患者肿瘤学指标比较患者术后随访5年以上,PN组总死亡6例(10.91%),2例死亡原因未知,1例因心血管事件而死亡,另外3例因出现肿瘤复发转移而死亡。RN组总死亡8例(13.34%),1例因术后出现尿毒症,合并肺部感染、呼吸衰竭、胸腔积液等疾病而死亡,2例因心血管事件而死亡,1例死亡原因未知,另外4例因出现肿瘤复发转移而死亡。两组在5年生存率以及总生存率方面比较差异无统计学意义(P>0.05)。PN组有4例(7.27%)出现复发转移,包括颈淋巴结,肝、肾周淋巴结,肺以及骨转移,RN组有6例(10%),包括肺、纵隔淋巴结、腹膜后淋巴结、脾、肝、骨以及胸膜转移,转移后均口服靶向药物治疗,两组比较差异无统计学意义(P>0.05)。PN组肿瘤特异性死亡病例3例(5.45%),RN组4例(6.67%),两组比较差异无统计学意义(P>0.05,图1)。
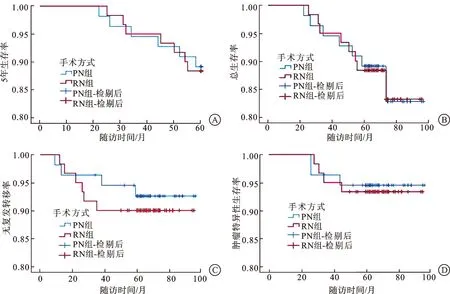
A:两组患者5年生存率的比较;B:两组患者总生存率的比较;C:两组患者无复发转移率的比较;D:两组患者肿瘤特异性生存率的比较。图1 PN与RN治疗T1b和T2a期肾细胞癌患者的生存曲线
3 讨 论
肾细胞癌(renal cell carcinoma,RCC)是最常见的泌尿系恶性肿瘤之一,在西方国家发病率最高,在泌尿系统肿瘤中发病率排第2位,根据2021年最新癌症数据统计,肾癌约占所有恶性肿瘤的4%,因肾癌死亡的患者约占所有恶性肿瘤死亡患者的2.26%,男性的肾癌发病率高于女性(1.5∶1),且在60~70岁的年龄段肾癌发病率最高[4-6]。
尽管治疗肾癌的方法在不断更新,比如冷冻消融术、肾动脉栓塞术、射频消融术、立体定向放疗术[7-9],但相对于手术治疗,这些手段对于肾癌的控制尚未达到满意的效果,考虑到肾癌对传统放化疗治疗不敏感,目前公认的局限性肾癌的首选方法是外科手术治疗[10]。目前,PN已经成为T1a期肾癌治疗的“金标准”[1-2],因其可以降低手术后肾功能不全的风险,并降低与CKD相关的心脏病的发病率、住院时间和死亡风险,具有潜在的生存优势[11-12],而对于临床T1b期及T2期肾癌行PN还是RN仍尚存争议。2017年MIR等[13]对T1b和T2期肾癌进行了荟萃分析,结果发现相较RN,PN有较好的术后肾功能,较低的CKD发生率(RR=0.36,P<0.001),较低的肿瘤复发率(OR=0.6,P<0.001)、肿瘤特异性死亡率(OR=0.58,P=0.001)和全因死亡率(OR=0.67,P=0.005),而对T2期肾癌进行保肾手术时,应考虑到围手术期较高的并发症风险。2017年LUO等[14]对SEER数据库的55 947例T1和T2期肾癌患者进行分析时,发现PN仅在T1a期而非T1b或T2期为局限性肾癌患者提供了更好的总生存期和肿瘤特异性生存期。此外,当我们对T1b和T2期肾癌进行单独研究时,多项研究表明T1b期肾癌患者中PN与RN两者在治疗效果、肿瘤控制、肿瘤预后上相当,T2期肾癌患者中PN在总生存期、肿瘤复发和肾功能保护方面更有益,但也与更高的手术并发症(如出血、尿瘘、急性肾衰、胸膜损伤等)相关[15-17]。因此,关于PN在治疗T1b和T2期肾癌的疗效这一问题上仍有待进一步地研究与探讨。
PN治疗肾癌的目的包括降低手术并发症的风险,保护患者术后肾功能以及达到肿瘤学控制的效果。首先,本研究中,PN组与RN组相比,在一般资料及围手术期相关因素方面差异无统计学意义,而PN组手术总体并发症明显高于RN组(23.6%vs.8.3%),差异有统计学意义,而在术后严重并发症(Clavien分级≥3级)发生情况(7.27%vs.3.33%)方面的差异无统计学意义,表明PN和RN在治疗T1b和T2a期肾癌时总体是安全有效的。LEE等[18]回顾性分析了2 373例接受PN和RN治疗的临床T1b和T2期肾癌患者的数据,研究发现PN组和RN组具有相似的肿瘤学结果,但PN组的并发症发生率显著高于RN组(9.8%vs.6.5%,P<0.001)。考虑到我院开展机器人手术时间较短,术者经验不足,故PN组手术总体并发症明显高于LEE等[18]研究中的手术并发症发生率。与RN组相比,PN术后严重并发症主要体现在缝合伤口继发性出血、术区渗血、尿瘘以及输尿管梗阻等方面,考虑到在行PN手术时患者肿瘤较大,操作空间有限,手术创面较大,术中缝合时间较长等因素,间接增加了手术的操作难度,而肿瘤大小、位置以及医生的临床经验也是影响术后严重并发症发生情况的重要因素[19-20]。
其次,对比两组肾功能的恢复效果,术前Scr值对比差异无统计学意义,而术后Scr值在第1天及第3、6、12个月对比差异有统计学意义,说明PN更能充分有效地保护患者术后肾功能。BREWER等[21]比较微创肾部分切除术(minimally invasive partial nephrectomy,MPN)和微创根治性肾切除术(minimally invasive radical nephrectomy,MRN)治疗T1b和T2a期肾肿瘤的手术情况和术后功能,在术前肾功能参数相似的情况下,MRN组术后新发Ⅲ~Ⅴ期CKD的发展程度更高(58%vs.31%,P=0.011),倾向性分析显示,MRN组新发CKD的可能性比MPN组高出2.8倍(P=0.048),MPN组肾功能结果更好,该研究与我们在保护肾功能方面结果相似。相比较肾小球滤过率(glomerular filtration rate,GFR),Scr值在评估肾功能时存在一定局限性,GFR更能准确地评价早期肾脏损害的情况,但GFR的测定在实施时相对较困难,而门诊复查Scr值较为方便,且反映人体总肾功能,所以能较好代表术后肾功能恢复的效果。随着创面缝合材料[22-23]、3D打印[24-25]、术中超声[26]、节段性肾动脉阻断[27]、“冷缺血”[28]等技术在PN中的应用,其不仅能降低术后严重并发症(例如出血和尿瘘)的发生,还能明显缩短热缺血时间,最大程度保护患者肾功能,从而有助于PN在T1a期以上的局限性肾癌中广泛应用。最后,在5年以上的随访过程中,对比两组的肿瘤学指标,5年生存率(90.91%vs.88.33%)、总生存率(89.09%vs.86.66%)、复发转移率(7.27%vs.10%)和肿瘤特异性生存率(94.55%vs.93.33%)等方面比较差异均无统计学意义,证明了PN也能达到良好的肿瘤控制效果,其临床疗效确切。有研究表明早期肾癌的术后5年生存率为90%~100%,且对于T1b和T2期肾癌患者,PN组和RN组具有相似的肿瘤学结果,与我们的研究结果接近[18,29]。
综上,PN和RN治疗T1b和T2a期肾癌总体安全有效,两种术式都能达到良好的肿瘤学控制效果,相比较于RN,PN更能充分有效地保护患者术后肾功能,但同时伴随更高的手术并发症发生率,而在术后严重并发症(Clavien分级≥3级)发生情况方面差异不明显。本研究存在一定的局限性,病例数量较少,且为回顾性研究,存在选择偏倚的问题,一些临床数据在随访过程中记录不完整,因此还需要大样本的前瞻性随机对照研究以及更长的随访时间观察手术的疗效。
