茼蒿水浸液和挥发物对三七根腐病菌的抑制活性及其抑菌物质分析
2023-05-30刘海娇徐杰左登鸿苏应威朱书生杨敏
刘海娇 徐杰 左登鸿 苏应威 朱书生 杨敏


摘要 为明确茼蒿水浸液和挥发物对三七根腐病菌的抑制活性及主要的抑菌物质,采用菌丝生长速率法测定其对腐皮镰刀菌Fusarium solani F-3和锈腐病菌Ilyonectria destructans RS006的抑制活性,利用气相色谱-质谱联用仪分析水浸液和挥发物的成分,进一步验证化合物的抑菌活性。结果表明,茼蒿茎、叶水浸液对F-3的抑制效果强于RS006,叶水浸液比茎水浸液抑菌效果更好。叶水浸液浓度为15.0%时,对F-3的抑制率为55.1%。挥发物对RS006的抑制活性存在明显的浓度效应,茎叶用量为2.0 g/皿时,茎和叶挥发物对RS006的抑制率均高于85.0%。茼蒿茎挥发物对F-3的抑制率较低且不同浓度间差异不显著,叶挥发物在叶用量为1.0 g/皿时对F-3抑制效果最好,抑制率为35.3%。茼蒿茎水浸液的主要成分为糖类和有机酸类,叶水浸液的主要成分为有机酸类。茼蒿茎叶挥发物的主要成分为萜烯类。挥发物中芳樟醇对两种病原菌的抑制效果较好。利用茼蒿或其化感物质可为三七根腐病的绿色防控提供思路。
关键词 茼蒿; 三七; 挥发物; 水浸液; 根腐病
中图分类号: S432.1
文献标识码: A
DOI: 10.16688/j.zwbh.2022019
Abstract This study aimed to determine the inhibition activity and the main antifungal substances of water extracts and volatiles from Glebionis coronaria on Panax notoginseng root rot pathogens. The inhibitory activities against Fusarium solani F-3 and Ilyonectria destructans RS006 were determined by mycelium growth rate method, and the substances of the aqueous extracts and volatiles were analyzed by gas chromatography-mass spectrometry, and the antifungal activity of the compounds were further verified. The results showed that the inhibitory effect of water extracts from stems and leaves on F-3 was stronger than that of RS006, and the inhibitory effect of leaf extracts was better than that of stems extracts. When the concentration of leaf water extracts was 15.0%, the inhibition rate on F-3 was 55.1%. The inhibition rate of volatiles on RS006 was significantly concentration-dependent, and the inhibition rate were higher than 85.0% at 2.0 g stems or leaves per dish. The inhibition rates of volatiles from stems on F-3 were low and there was no significant difference among different concentrations. The inhibition rate on F-3 was 35.3% when the leaf was 1.0 g per dish. The main components of stem water extracts of G.coronaria were sugars and organic acids, while the main components of leaf water extracts were organic acids. The volatiles of G.coronaria were mainly composed of terpenes. Linalool in volatiles had obvious inhibitory effect on the two pathogens. G.coronaria or its allelopathic substances could be used for prevention and ecological control of P.notoginseng root rot disease.
Key words Glebionis coronaria; Panax notoginseng; volatiles; water extracts; root rot
三七Panax notoginseng是我國特有的名贵中药材[1],具有散淤止血、消肿止痛、抗炎、止血、补血、抗血栓等作用[2],是云南省重要的生物资源[3]。三七性喜温暖阴湿的生长环境,病害问题十分突出,尤其根腐病危害常年造成的损失达10%~40%,严重的损失达70%以上,甚至绝收,已经成为制约三七产业健康发展的主要障碍[4]。根腐病是由腐皮镰刀菌Fusarium solani、锈腐病菌Ilyonectria destructans等致病真菌为主,细菌和线虫等参与造成的复合侵染性土传病害[5]。生产上主要利用化学农药、药剂熏蒸土壤等防治三七根腐病,但防治效果一般,还易造成农残和重金属超标等问题[6]。轮作是最常用的消减土传病害的方式,但常规轮作玉米等作物至少10年以上才可再种植三七[7]。
植物生长过程中通过挥发、淋溶、残体腐解和根系分泌等途径释放化感物质到环境中,影响自身或其他植物、微生物、昆虫的生长发育,这一现象被称为化感作用[8]。挥发物和水浸液是植物化感物质的重要来源,部分可直接抑制病原菌孢子萌发、菌丝生长或诱导植株的抗性增强以减轻病害的发生[9-10]。例如苦芥、韭菜、大蒜等释放的含硫化合物可以抑制三七根腐病菌F.solani、辣椒疫霉Phytophthora capsici、香蕉枯萎病菌F.oxysporum f.sp. cubense的生长、传播和侵染[11-13]。大蒜、洋葱、葱、韭菜、生姜、鱼腥草、薄荷、紫茎泽兰、苍耳、黄瑞香、丁香、大黄、花椒等的水浸液对农作物病原菌均有一定的抑菌活性[4,14-16]。因此,筛选挥发物和水浸液对三七根腐病菌有抑制活性的植物,对利用其与三七进行间作或轮作建立生态友好型的病害控制方式同时缩短轮作年限具有重要意义。
茼蒿Glebionis coronaria (L.) Cassini ex Spach为菊科Asteraceae茼蒿属Glebionis草本植物,具有药食两用功效[17]。研究表明,茼蒿中含有黄酮、酚酸、倍半萜内酯、单萜烯、二萜、甘油二酯糖苷、生物碱、植物甾醇和挥发油等多种化合物[18]。已有研究表明,前茬种植茼蒿的地块再种西瓜,西瓜长势良好且未发生枯萎病,进一步研究表明,茼蒿的挥发物和水浸液对西瓜枯萎病菌F.oxysporum f.sp. niveum有良好的抑制作用[17]。然而,能否利用茼蒿及其化感物质的抑菌作用减轻三七根腐病未见报道。因此,本研究測定茼蒿水浸液和挥发物对三七根腐病菌的抑制活性并利用GC-MS鉴定其单体成分,筛选主要化合物测定抑菌活性,明确茼蒿关键的抑菌物质,为利用茼蒿与三七间作或轮作防控三七根腐病提供依据。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株
供试三七根腐病菌:腐皮镰刀菌F.solani F-3和锈腐病菌I.destructans RS006,由云南农业大学农业生物多样性与病虫害控制教育部重点实验室提供,分离自患根腐病的三七根部并经过形态和致病性鉴定。
1.1.2 供试培养基
供试培养基:马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)。
1.1.3 供试植株材料
供试茼蒿G.coronaria,品种为‘光杆茼蒿(南京绿领种业有限公司)。4月将茼蒿种子直播于育苗盆中(65 cm×40 cm×18 cm),盆中装满品氏泥炭土和自然土按体积1∶1比例混合后的土壤。每盆播种约200粒种子,出苗后适时浇水。于开花前采集茼蒿地上部分,采收时间为播种后45 d,茼蒿株高约30 cm。本部分试验于云南农业大学温室中进行。
1.1.4 供试试剂
99.0%壬二酸,上海麦克林生化科技有限公司;99.5%丁二酸、99.0%尿嘧啶,上海易恩化学技术有限公司;90.0% β-石竹烯、99.0%(+)-柠檬烯、96.0%芳樟醇、95.0%N-甲基-N-(三甲基硅烷基)三氟乙酰胺,梯希爱(上海)化成工业发展有限公司;10.0%次氯酸钠,天津市风船化学试剂科技有限公司;99.9%正己烷,Fisher Chemical;99.9%甲醇、99.9%吡啶,上海阿拉丁生化科技股份有限公司。
1.2 试验方法
1.2.1 茼蒿水浸液和挥发物抑菌活性测定
采用菌丝生长速率法测定。茼蒿先用3.0%次氯酸钠表面消毒3 min,随后用无菌水冲洗5次。将茎和叶分开,分别称取50.0 g植物组织加入等量灭菌水,用组织破碎机研碎,以4层灭菌纱布过滤,滤液在12 000 r/min、4℃条件下离心8 min,上清液过0.2 μm滤膜后4℃冷藏备用。分别取1.8、4.5、9.0 mL水浸液加入58.2、55.5 mL和51 mL灭菌培养基中,制成含水浸液3.0%、7.5%、15.0%的PDA平板,以不加水浸液的培养基为对照,在平板中央接种直径5.0 mm的病原菌菌饼,每处理设置3次重复,平板倒置放于28℃恒温培养箱中黑暗培养。挥发物抑菌活性测定时,将茎和叶分开,分别切成约5.0 mm长的小段置于灭菌培养皿中备用。在PDA平板中央接种直径为5.0 mm的病原菌菌饼,在天平上称取植物组织放入培养皿皿盖上并均匀铺开(皿盖上提前放置一片灭菌纸用于放置茎叶组织)。茎和叶分别设置0.5、1.0 g/皿和2.0 g/皿3个水平,以不放植物组织的平板作为空白对照,每处理3次重复。将培养皿用封口膜密封,倒置放于28℃恒温培养箱中黑暗培养。待对照菌落长到培养皿直径的2/3时,采用十字交叉法测量菌落直径,并按以下公式计算水浸液和挥发物的抑制率。
抑制率=(对照菌落平均直径-处理菌落平均直径)/对照菌落平均直径×100%。
1.2.2 茼蒿水浸液收集及成分鉴定
分别收集茼蒿茎和叶的水浸液进行成分鉴定。水浸液的制备方法同上。取制备好的水浸液倒入分液漏斗中,加入等量的乙酸乙酯萃取3次,合并萃取液。旋转蒸发仪设置温度40℃使乙酸乙酯挥发,待剩余少量溶剂时,将溶液全部转移至2.0 mL离心管中,于真空干燥仪中彻底挥干溶剂。衍生化处理:在离心管中加入80.0 μL 20.0 mg/mL的盐酸甲氧胺吡啶溶液,完全溶解后转移至2.0 mL离心管中,在400 r/min,30℃条件下反应90 min;加入40 μL N-甲基-N-(三甲基硅烷基)三氟乙酰胺(MSTFA)试剂,置于400 r/min,37℃条件下反应30 min;然后14 000 r/min,4℃离心3 min,小心吸取上清液放入装有内衬管的棕色进样品瓶中,上机检测。GC条件:SH-Rxi-5Sil MS 色谱柱(30.0 m×0.25 mm×0.25 μm)。起始柱温为100℃,保持4 min后,以4℃/min升温至320℃,保持8 min。载气为氦气,进样口温度280℃,进样量0.8 μL,进样方式为分流进样,分流比为10∶1。MS条件:EI电离源,离子源温度200℃,接口温度280℃,扫描范围45~600 m/z,采集方式Scan,扫描间隔0.3 s。水浸液成分鉴定通过NIST14s和OA_TMS_DB5_67min_V3谱图库检索保留时间,并通过峰面积的百分比确定化合物的相对含量。
1.2.3 茼蒿挥发物收集及成分鉴定
合并收集茼蒿茎叶的挥发物。将3.0 kg茼蒿茎叶切成5.0 mm左右小段,置于挥发物收集装置,参照Ye等的方法收集挥发物[19]。收集装置主要利用空气泵将挥发物带入装有吸附树脂的吸附柱中,连续收集24 h后,将吸附柱取下用正己烷洗脱3次,合并洗脱液,利用旋转蒸发仪减压浓缩后氮吹浓缩至干,再用甲醇溶解后过0.2 μm有机滤膜,避光保存备用。收集到的挥发物用GC-MS进行分析。GC分析条件:SH-Rxi-5Sil MS色谱柱(30.0 m×0.25 mm×0.25 μm),起始柱温为40℃,以3℃/min升温至80℃后,以5℃/min升温至260℃,保持30.0 min;载气为氦气,进样口温度250℃,进样量2.0 μL,不分流进样。MS分析条件:EI电离源,离子源温度230℃,接口温度250℃,扫描范围35~500 m/z,采集方式Scan,扫描间隔0.3 s。根据 NIST14s数据库中的保留时间检索鉴定挥发物的成分,并通过不同化合物峰面积的百分比确定相对含量。
1.2.4 茼蒿水浸液和挥发物中主要成分抑菌活性测定
挑选茼蒿茎和叶水浸液中相对含量较高的有机酸(壬二酸、丁二酸)和嘧啶类物质(尿嘧啶)进行抑菌活性测定。在灭菌的99 mL PDA中加入1 mL不同浓度的壬二酸、丁二酸和尿嘧啶标准品(甲醇溶解)制成带药平板,使药剂终浓度依次为0.01,0.1,1,10,100 μg/mL,以加1 mL纯甲醇(终浓度1.0%)为对照,每处理设置4次重复。在平板中央接种直径5.0 mm的F.solani F-3和I.destructans RS006菌饼,接种后的平板培养条件和抑制率计算方法同1.2.1。
挥发物选择相对含量较高且易得的(+)-柠檬烯、β-石竹烯和芳樟醇进行抑菌活性测定。参照Ye等的方法[19],将1.5 mL离心管的盖子剪下灭菌,在PDA平板中央先接种直径5.0 mm的菌饼,再分别加入浓度为40、80、120、160 mL/m3(标准品体积/培养皿容积,下同)的芳樟醇和200、300、400、500 mL/m3的(+)-柠檬烯和β-石竹烯标准品到离心管盖子中,并置于培养皿皿盖上,以不加标准品为对照,每处理4次重复。培养条件及抑制率计算方法同1.2.1。
对于抑菌效果较好的挥发物或水浸液中的单体物质,通过SPSS软件中的Probit模块算出毒力回归方程的斜率和标准误,进一步计算单体物质对两种病原菌生长的有效抑制中浓度(EC50)和95%置信限。
1.3 统计分析
利用Excel 2010和SPSS 18.0对试验数据进行统计分析,采用Origin 2019b 32Bit进行绘图,采用独立样本t测验和Duncan氏新复极差法进行差异显著性分析。
2 结果与分析
2.1 茼蒿水浸液和挥发物对三七根腐病菌菌丝生长的抑菌活性
茼蒿叶的水浸液对三七两种根腐病菌菌丝生长均有一定的抑制活性,且随着浓度的增加抑制率显著提高。在最高浓度15%时,对F.solani F-3的抑制率为55.1%,对I.destructans RS006的抑制率为25.3%。茼蒿茎的水浸提液对F.solani F-3菌丝生长的作用表现为低浓度促进高浓度抑制,但最高浓度的抑制率仍较低;不同浓度茎浸提液对I.destructans RS006的抑制率差异不显著,均在10.0%左右(圖1a~b)。茼蒿茎和叶的挥发物对F.solani F-3的抑制率没有明显的浓度效应,茼蒿叶挥发物在1.0 g/皿时对F.solani F-3的抑制率最高,为35.3%(图1c);对I.destructans RS006的抑制率随茎、叶用量的提高显著增加,茎和叶挥发物在最高用量2.0 g/皿时对I.destructans RS006的抑制率均高于85.0%(图1d)。对茼蒿茎和叶的水浸液和挥发物进行一般线性分析发现,茼蒿茎和叶的水浸液对两种病原菌的抑菌活性存在显著差异(P<0.05),但茎和叶的挥发物的抑菌活性差异不显著(P>0.05)(表1)。
2.2 茼蒿水浸液和挥发物中主要物质分析
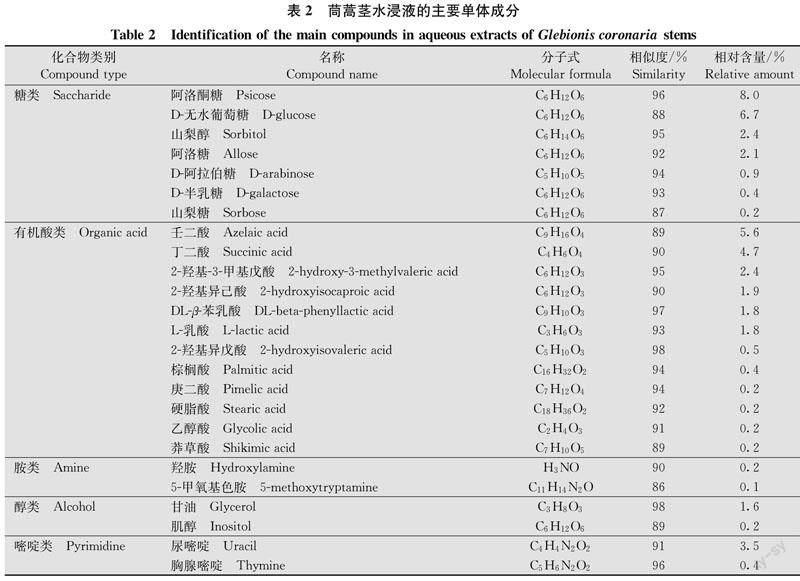
由于茼蒿茎和叶水浸液对两种病原菌的抑制活性有显著差异,所以分别测定茎和叶水浸液中的物质。茼蒿茎水浸液中检测到相似度≥85.0%且相对含量≥0.1%的物质共25种,主要分为糖类(7种)、有机酸类(12种)、胺类(2种)、醇类(2种)和嘧啶类(2种)。其中,相对含量较高的糖类为阿洛酮糖(8.0%)和D-无水葡萄糖(6.7%),有机酸为壬二酸(5.6%)和丁二酸(4.7%),嘧啶类为尿嘧啶(3.5%),胺类和醇类的相对含量较低(表2)。
茼蒿叶水浸液中检测到相似度≥85.0%且相对含量≥0.1%的物质共27种,主要包括有机酸类(20种)、糖类衍生物(3种)、嘧啶类(2种)、醇类(1种)和胺类(1种)。其中,相对含量较高的有机酸为丁二酸(4.7%)和壬二酸(4.2%),嘧啶类为尿嘧啶(3.2%),醇类为甘油(1.8%),糖类和胺类的相对含量较低(表3)。
茼蒿茎叶挥发物中相似度≥85.0%且相对含量≥0.1%的物质共25种,主要是萜烯类化合物(18种),还含有少量的酮类(2种)、烯烃类(2种)、醇类(1种)、氨基酸(1种)和烷烃类(1种)。萜烯类化合物中相对含量最高的是β-月桂烯,高达46.6%,其次是(E)-β-罗勒烯(16.8%)和(Z)-3,7-二甲基-1,3,6-辛三烯(16.6%)。相对含量高于0.5%的挥发物单体还有(+)-柠檬烯(3.8%)、大根香叶烯D(3.6%)、(E)-β-金合欢烯(3.3%)、β-石竹烯(1.5%)、α-金合欢烯(0.7%)和芳樟醇(0.6%)(表4)。
2.3 茼蒿水浸液和挥发物中相对含量较高的单体成分抑菌活性分析
茼蒿水浸液中主要单体成分丁二酸在浓度0.1 μg/mL 和1.0 μg/mL时对F.solani F-3的抑制率最高,分别为16.5%和16.1%;在浓度10.0 μg/mL时对I.destructans RS006的抑制率最高,为8.8%。壬二酸对两种病原菌的抑制率均较低。尿嘧啶对F.solani F-3的抑制率也较低,甚至有微弱的促进生长的效果;但在0.01~10.0 μg/mL范围内,尿嘧啶对I.destructans RS006的抑制率随浓度提高显著增加,最高为13.1%。
茼蒿挥发物中主要单体成分(+)-柠檬烯和β-石竹烯在200~500 mL/m3范围内对F.solani F-3的抑制率均较低,对I.destructans RS006的抑制效果随浓度的增加逐渐增加,抑制率最高分别为11.5%和15.9%。芳樟醇对两种病原菌的抑菌效果最好,且抑制率随浓度增加显著提高。在浓度为160 mL/m3时对F.solani F-3和I.destructans RS006抑制率分别达到57.0%和70.2%(图2)。进一步计算得出,芳樟醇对F.solani F-3和I.destructans RS006 EC50分别为135.7 mL/m3和116.7 mL/m3(表5)。
3 结论与讨论
根腐病是以真菌为主的病原菌在根际土壤中异常积累导致的一类极难防治的土传病害,严重制约着三七的健康生长[6,20]。有目的地筛选能抑制根腐病菌的化感植物可为三七根腐病的绿色防控提供新的可行途径。
水浸液相当于淋溶途径释放的化感物质[21]。本研究发现,茼蒿茎和叶对三七根腐病两种病原菌均有一定的抑菌活性,且叶的抑菌活性强于茎,对F.solani F-3的抑菌活性强于I.destructans RS006。本试验利用GC-MS进一步检测发现茼蒿茎中主要为糖类和有机酸类物质,叶中主要为有机酸类物质。有机酸类物质可以降低作物病害发病率和病情指数[22],而糖类物质一般可作为碳源供给或促进病原菌菌丝生长[23];因此,茼蒿叶的抑菌活性强于茎可能与叶中有机酸种类更多而茎中糖类物质种类更多有关。茼蒿茎和叶水浸液中相对含量较高的单体物质为丁二酸、壬二酸以及尿嘧啶等。单体的抑菌结果表明,丁二酸和壬二酸对F.solani F-3的抑菌活性略强于I.destructans RS006,与水浸液对两种病原菌的抑制效果一致。尿嘧啶与之相反,对I.destructans RS006的抑制能力强于F.solani F-3,甚至可微弱地促进F.solani F-3的生长。从总体上看,这3种物质对三七根腐病菌的抑制率均不高,且不及水浸液整体的抑菌活性高。因此推测,茼蒿水浸液的抑菌活性可能是多种物质共同作用的结果。其他文献报道显示,茼蒿水浸液中绿原酸对西瓜枯萎病菌F.oxysporum f.sp. niveum有较好的抑制活性[17]。本试验未检测到绿原酸,这可能与绿原酸分子遇光、热不稳定的性质有关[24-25]。本研究水浸液制备过程中未进行避光处理,且GC-MS检测时温度高,绿原酸可能发生分解或降解,因此未检测到。
挥发物是化感物质的重要来源,利用作物释放的具有多种生态功能的挥发物来防控病虫害发生是农业生产中常用的策略之一,如(Z)-3-乙酸叶醇酯对七星瓢虫等天敌有显著引诱作用,拟南芥释放的(Z)-3-己烯醇能提高拟南芥对灰霉病菌Botrytis cinerea的抗性[26-28]。本研究發现,茼蒿挥发物对三七根腐病菌尤其是锈腐病菌I.destructans RS006有较好的抑菌效果。在2.0 g/皿时,茼蒿茎和叶挥发物对I.destructans RS006的抑制率均超过85.0%。GC-MS分析结果表明,茼蒿茎叶挥发物中主要单体成分为β-月桂烯(46.6%)、(E)-β-罗勒烯(16.8%)、罗勒烯异构体混合物(16.6%)、(+)-柠檬烯(3.8%)、大根香叶烯D(3.6%)、(E)-β-金合欢烯(3.3%)、β-石竹烯(1.5%)、α-金合欢烯(0.7%)和芳樟醇(0.6%)等。前期研究已表明,月桂烯对三七根腐病菌抑制效果较弱[29]。本试验进一步发现,(+)-柠檬烯和β-石竹烯对F.solani F-3的抑菌效果差,甚至有微弱促进菌丝生长的作用;对I.destructans RS006的抑制效果稍强且表现为浓度依赖效应,在最高500 mL/m3时对I.destructans RS006的抑制率分别为11.5%和15.9%。芳樟醇对两种病原菌的抑菌效果最好,在160 mL/m3时对F.solani F-3和I.destructans RS006的抑制率达57.0%和70.2%。其他研究也表明,芳樟醇对棉花枯萎病菌F.oxysporum f.sp. vasinfectum、小麦赤霉病菌F.graminearum、烟草赤星病菌Alternaria alternata、番茄早疫病菌A.solani、水稻稻瘟病菌Magnaporthe oryzae和纹枯病菌Rhizoctonia solani、柑橘炭疽病菌Colletotrichum gloeosporioides等菌丝生长有较好的抑制作用[30-32]。因此,利用芳樟醇制备植物源杀菌剂防治三七根腐病等多种作物病害具有一定的潜力。此外,本研究发现茼蒿茎叶挥发物中主要为萜烯类物质,与文献报道[33-35]的主要化学成分基本一致,但个别物质也存在一定的差异,这可能是因为不同的产地、气候等因素对茼蒿的挥发性化学成分有一定的影响,或不同的提取、检测方法引起挥发物种类和含量有所变化。
综上,茼蒿水浸液和挥发物对三七根腐病菌具有较好的抑菌活性,水浸液中有机酸类物质以及挥发物中芳樟醇可能为主要的抑菌成分,利用茼蒿或其化感物质可为三七根腐病的绿色防控或生态种植提供思路。
參考文献
[1] 林景超, 张永煜, 崔健, 等. 我国三七产业的发展现状及前景[J]. 中国药业, 2005(2): 18.
[2] 吴贵林. 中药三七药理作用及真伪鉴别探讨[J]. 现代养生, 2015(22): 221.
[3] 刘立红, 刘英, 王芬, 等. 云南三七产业发展现状及发展建议[J]. 中国现代中药, 2017, 19(9): 1331-1335.
[4] 张伟, 廖静静, 朱贵李, 等. 8种植物挥发物和浸提液对三七根腐病菌的抑制活性研究[J]. 中国农学通报, 2013, 29(30): 197-201.
[5] LIU Haijiao, YANG Min, ZHU Shusheng. Strategies to solve the problem of soil sickness of Panax notoginseng (Family: Araliaceae) [J]. Allelopathy Journal, 2019, 47(1): 37-56.
[6] 毛忠顺, 龙月娟, 朱书生, 等. 三七根腐病研究进展[J]. 中药材, 2013, 36(12): 2051-2054.
[7] 孙雪婷, 李磊, 龙光强, 等. 三七连作障碍研究进展[J]. 生态学杂志, 2015, 34(3): 885-893.
[8] SCHANDRY N, BECKER C. Allelopathic plants: models for studying plant-interkingdom interactions [J]. Trends in Plant Science, 2020, 25(2): 176-185.
[9] 闫文静, 刘子凡, 张婷婷, 等. 木薯器官及其腐解物水浸液对橡胶树白根病病菌的化感作用[J]. 热带作物学报, 2019, 40(1): 123-129.
[10]SCALA A, MIRABELLA R, MUGO C, et al. E-2-hexenal promotes susceptibility to Pseudomonas syringae by activating jasmonic acid pathways in Arabidopsis [J/OL]. Frontiers in Plant Science, 2013(4): 74. DOI: 10.3389/fpls.2013.00074.
[11]ZHANG Hui, MALLIK A, ZENG Rensen. Control of panama disease of banana by rotating and intercropping with Chinese chive (Allium tuberosum Rottler): role of plant volatiles [J]. Journal of Chemical Ecology, 2013, 39(2): 243-252.
[12]廖静静, 刘屹湘, 杨敏, 等.大蒜挥发物和浸提液对辣椒疫霉菌的抑菌活性分析[J]. 云南农业大学学报(自然科学), 2014, 29(3): 337-346.
[13]LIU Haijiao, WU Jiaqing, SU Yingwei, et al. Allyl isothiocyanate in the volatiles of Brassica juncea inhibits the growth of root rot pathogens of Panax notoginseng by inducing the accumulation of ROS [J]. Journal of Agricultural and Food Chemistry, 2021, 69(46): 13713-13723.
[14]蒋继志, 梁宁. 植物提取物对草莓根腐病病原真菌的抑制作用[J]. 河北大学学报(自然科学版), 2005, 25(4): 399-404.
[15]叶文斌, 张和平, 樊亮. 中草药苍耳、黄瑞香水浸液对小麦条锈病菌的抑制作用[J]. 中国农业科技导报, 2013, 15(1): 102-108.
[16]李纪潮, 杨天梅, 杨绍兵, 等. 植物源提取物对三七根腐病病原菌的抑菌效应及对三七的化感作用[J]. 生态学杂志, 2021,40(10): 3167-3174.
[17]李珊珊, 刘琳, 李猛, 等.茼蒿中绿原酸抑制西瓜枯萎病菌活性研究[J]. 核农学报, 2018, 32(1): 104-111.
[18]李铁纯, 侯冬岩, 康晓红, 等. 茼蒿挥发性成分的分析[J]. 鞍山师范学院学报, 2003(2): 64-66.
[19]YE Chen, LIU Yixiang, ZHANG Junxing, et al. α-terpineol fumigation alleviates negative plant-soil feedbacks of Panax notoginseng via suppressing Ascomycota and enriching antagonistic bacteria [J/OL]. Phytopathology Research, 2021(3): 13. DOI: 10.1186/s42483-021-00090-1.
[20]LUO Lifen, GUO Cunwu, WANG Luotao, et al. Negative plant-soil feedback driven by re-assemblage of the rhizosphere microbiome with the growth of Panax notoginseng [J/OL]. Frontiers in Microbiology, 2019(10): 1597. DOI: 10.3389/fmicb.2019.01597.
[21]张泰劼, 田兴山, 张纯, 等. 阔叶丰花草与2种菊科植物之间的化感作用[J]. 应用生态学报, 2020, 31(7): 2211-2218.
[22]张宁, 张如, 吴萍, 等.根系分泌物在西瓜/旱作水稻间作减轻西瓜枯萎病中的响应[J]. 土壤学报, 2014, 51(3): 585-593.
[23]罗丽芬, 江冰冰, 邓琳梅, 等. 三七根系分泌物中几种成分对根腐病原菌生长的影响[J]. 南方农业学报, 2020, 51(12): 2952-2961.
[24]石艳宾, 李文静.响应面优化金银花绿原酸提取工艺及抗氧化作用研究[J]. 食品研究与开发, 2019, 40(21): 152-158.
[25]崔灵芝, 管延鹏, 张晓蓉, 等. 金银花及山银花产业技术研究进展[J]. 轻工科技, 2021, 37(12): 22-26.
[26]BALDWIN I T, HALITSCHKE R, PASCHOLD A, et al. Volatile signaling in plant-plant interactions: “talking trees” in the genomics era [J]. Science, 2006, 311(5762): 812-815.
[27]KISHIMOTO K, MATSUI K, OZAWA R, et al. Volatile C6-aldehydes and Allo-ocimene activate defense genes and induce resistance against Botrytis cinerea in Arabidopsis thaliana [J]. Plant & Cell Physiology, 2005, 46(7): 1093-1102.
[28]YU Huilin, ZHANG Yongjun, WU Kongming, et al. Field-testing of synthetic herbivore-induced plant volatiles as attractants for beneficial insects [J]. Environmental Entomology, 2008, 37(6): 1410-1415.
[29]刘海娇, 方岚, 苏应威, 等. 茴香挥发物对三七根腐病菌的抑制活性及抑菌物质鉴定[J]. 南方农业学报, 2020, 51(9): 2128-2134.
[30]WAN Chuanxing, ZHU Lili, LIU Wenjie. Study on chemical composition and antifungal activity of lavender essential oil [J]. 塔里木大学学报, 2008(2): 40-43.
[31]卢凯, 李欣, 周嘉良, 等. 虫害诱导的水稻挥发物抑制水稻病原菌的生长[J]. 科学通报, 2010, 55(30): 2927-2932.
[32]杨滢滢, 陈明, 万春鹏, 等. 天然芳樟醇和柠檬醛对4种果蔬采后致病菌抑菌活性研究[J]. 生物灾害科学, 2016, 39(2): 80-83.
[33]翁雪香, 邓春晖, 宋国新, 等.茼蒿挥发性成分的固相微萃取气相色谱-质谱分析[J]. 分析测试学报, 2003, 22(3): 87-89.
[34]FLAMINI G, CIONI P L, MORELLI I. Differences in the fragrances of pollen, leaves, and floral parts of garland (Chrysanthemum coronarium) and composition of the essential oils from flowerheads and leaves [J]. Journal of Agricultural and Food Chemistry, 2003, 51(8): 2267-2271.
[35]TAWAHA K, HUDAIB M. Volatile oil profiles of the aerial parts of Jordanian garland, Chrysanthemum coronarium [J]. Pharmaceutical Biology, 2010, 48(10): 1108-1114.
(責任编辑:杨明丽)
