百香果果皮主要有效成分连续提取工艺
2023-05-30陈雪梅刘夏蕾林标声陈小红黎英
陈雪梅 刘夏蕾 林标声 陈小红 黎英

关键词:百香果皮;果胶;花色苷;膳食纤维;连续提取
中图分类号:S667.9 文献标识码:A
百香果(Passiflora edulis Sims.)为一种多年生常绿草质或半木质藤本攀缘植物,属于西番莲科,主产于我国福建、广东、海南、台湾等亚热带及热带地区,因其独特浓郁的风味与香气而深受消费者喜爱。其果实不仅富含果胶、多酚类、膳食纤维、维生素、微量元素等160 多种有益成份,還含有具有生津止咳、养颜抗衰、抑菌抗炎、安神抗焦虑作用的活性成分,因而被广泛应用于医药、餐饮和保健领域[1-5]。
龙岩市由于特殊的土壤、气候条件,逐渐成为中国最大、最优的百香果基地,目前全市百香果种植面积约0.14 万hm2,年产值过亿元。由于百香果一年陆续挂果、多次成熟,采收期长达9个月,单产收益高,且当年种植当年受益,是一项投资少、见效快、效益高的扶贫攻坚项目。百香果产业已成为福建省的新兴特色产业。
由于百香果栽培面积已迅速扩增,而市场上还主要以百香果鲜果进行流通销售,百香果果皮水分含量高,导致其易腐烂变质,贮藏困难。目前,百香果产品存在品种类型较为单一,开发利用不足,加工技术含量低,附加值不高的情况,如对于百香果果肉的开发主要集中在果汁饮料加工,百香果果皮主要生产果脯、果酱及蜜饯类等初加工产品[6-7]。近年来,有关百香果果皮中有效成分提取工艺方面的相关研究已有不少报道,但是众多提取方法均存在一些不足,例如,用石油醚、无水乙醇等有机溶剂分别浸提油溶性色素、水溶性色素的工艺存在耗时长、操作工艺繁杂、部分溶剂不能回收循环利用、能耗大等问题[8-10]。而有关果胶提取工业化生产大部分采用酸解沉淀法,在强酸高温或长时间加热过程中,原料中的果胶不可避免地发生分解或变性,其粘度、凝胶性等理化性能下降;且经酸法处理后果皮中的多价金属离子、低分子物质等杂质仍会残留于果胶中,造成提取的果胶数量和质量也不理想[11-14]。而从百香果果皮中提取膳食纤维一般采用浸泡或热提取法,浸提率均不理想,存在生产率低和产品纯度不高等问题[15-18]。此外,目前国内外对百香果果皮中有效成分的研究大多是单提研究,成本较高,往往是提取出了产品得不到效益,鲜有2 种或2 种以上提取物产品的联产研究,更未见一次性连续提取百香果果皮中果胶、花色苷和膳食纤维3 种有效成分的文献报道。
因此,本研究将建立一次性连续从百香果果皮中提取果胶、花色苷和膳食纤维3 种有效成分的联产工艺,通过单因素实验和响应面分析对果胶、花色苷和膳食纤维的提取工艺关键环节进行优化,使工艺更加接近实际生产应用。以减少资源浪费、环境污染、提取剂消耗及降低生产成本,同时为百香果果皮的精深加工和高值化利用提供示范。
1 材料与方法
1.1 材料
百香果果皮由龙岩道心农业发展有限公司提供,果皮为紫红色,清洗、干燥、烘干、粉碎过筛后备用;咔唑(P),D-(+)-半乳糖醛酸:北京博奥拓科技有限公司;矢车菊素-3-O-葡萄糖苷:成都曼斯特生物科技有限公司;MRS 培养基:北京奥博星;嗜热链球菌(S. thermophilus)、保加利亚乳杆菌(L. bulgaricus):中国微生物菌种保藏中心。
真空冷冻干燥机(FD-1-50 型,北京博医康实验仪器有限公司);真空干燥箱(DZF-6050 型,上海一恒科学仪器有限公司);实验室微波炉(JOYN-HIC1 型上海乔跃电子有限公司);旋转蒸发仪(EYELA N-1300,日本东京理化公司)。
1.2 方法
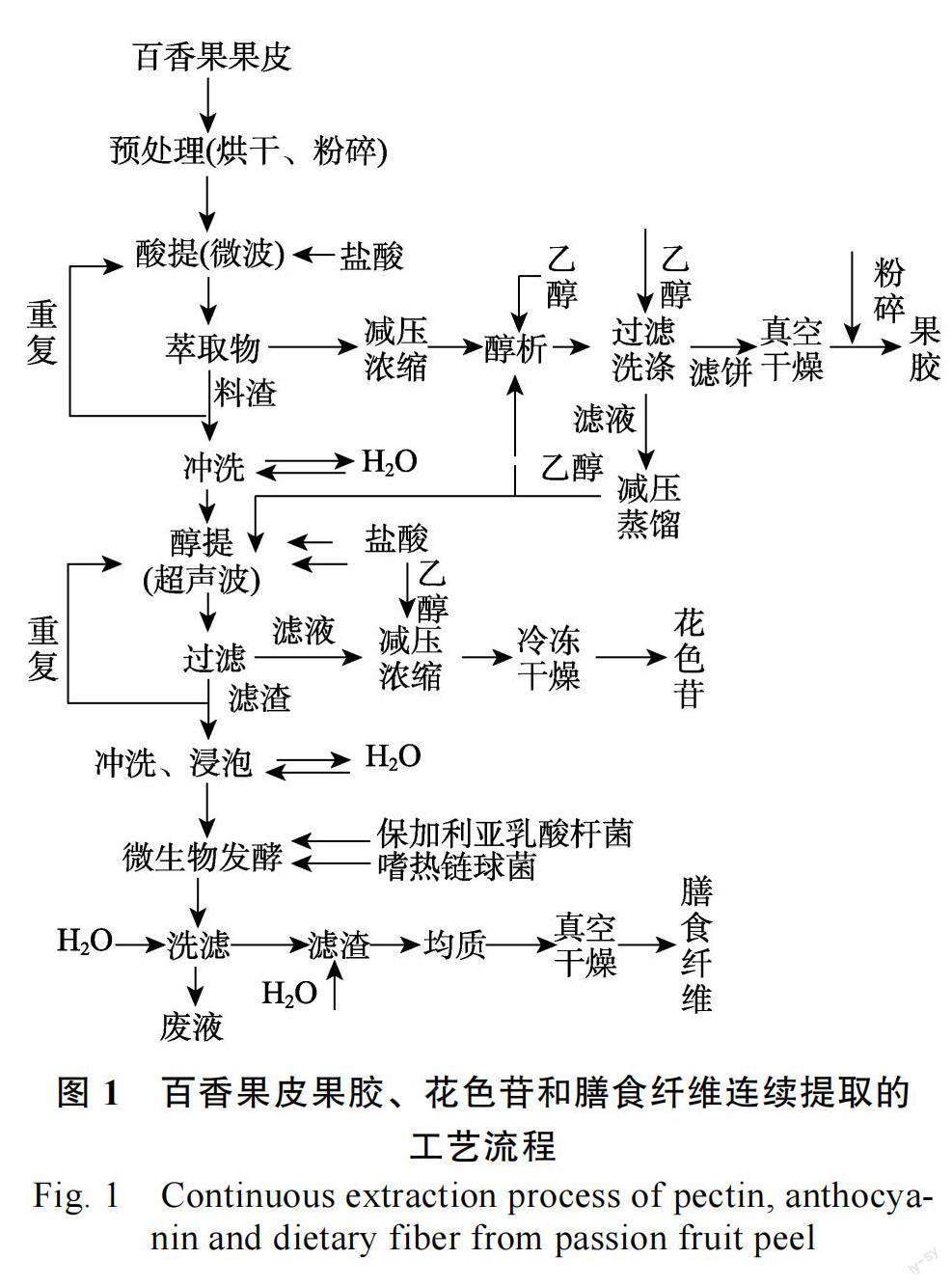
1.2.1 联产工艺技术路线图设计 连续从百香果果皮中提取果胶、花色苷和膳食纤维3 种有效成分的联产工艺流程图见图1。该工艺流程图主要包括三部分:(1)将百香果果皮粉碎,过100 目筛,取10.0 g 粉末,加入蒸馏水,50℃水浴60 min后调节pH,采用微波处理,真空抽滤,滤渣重复操作2 次,合并3 次滤液,浓缩,加入4 倍95%乙醇静置过夜,离心,沉淀用无水乙醇洗涤数次,真空干燥得百香果皮果胶;(2)用蒸馏水反复冲洗提取果胶后的料渣,按比例加入50%浓度的乙醇,调节pH,超声波处理,分离,料渣重复提取2 次,合并3 次提取液,浓缩,冷冻干燥,即得百香果皮花色苷;(3)将多次提取花色苷后的料渣,加入适量的水和脱脂奶粉混匀后灭菌,冷却、接种、发酵,过滤洗涤2 次,均质,真空干燥后即得膳食纤维。
1.2.2 百香果皮果胶提取 采用微波辅助提取,按1.2.1 步骤操作,采用硫酸咔唑法测定其半乳糖醛酸含量[19],测528 nm 处吸光度。果胶得率=[(C×V×N)/106×W]×100%,式中,C 为半乳糖醛酸浓度,μg/mL;Ⅴ为果胶原液体积,mL;N 为果胶提取液稀释倍数;W 为百香果皮粉质量,g。
(1)单因素试验。称取10.0 g 百香果皮粉末,60℃水浴1.0 h 后,预设液料比50∶1(mL/g),pH 2.0,微波时间5.0 min,微波功率450 W 为提取工艺参数中的常规量,以百香果皮果胶得率为评价指标,分别选取液料比为30∶1、40∶1、50∶1、60∶1、70∶1、80∶1(mL/g),pH 为1.0、1.5、2.0、2.5、3.0、3.5,微波功率为200、300、400、500、600、700 W,微波时间为2.0、4.0、6.0、8.0、10.0、12.0 min,这4 个因素中的6 个单因素变量替换工艺参数中相应的常规量进行单因素试验。
(2)响应面法优化试验。依据上述单因素试验优化果胶得率的测定结果,借助Design Expert8.0.6 软件,选用Box-Behnken 设计原理,以百香果皮果胶得率(Y)为响应值,采用A:液料比50∶1、60∶1、70∶1(mL/g),B:pH 为2.0、2.5、3.0,C:微波功率400、500、600 W,D:微波时间4.0、6.0、8.0 min,进行4 因素3 水平试验设计。
1.2.3 百香果皮花色苷提取 对微波提取果胶后的百香果果皮料渣采用超声辅助乙醇法提取花色苷,按1.2.1 步骤操作。利用矢车菊素-3-O-葡萄糖苷标准品绘制标准曲线,精密称取1.00 mg 矢车菊素-3-O-葡萄糖苷标准品于10 mL 容量瓶中,50%乙醇定容,稀释成浓度为0.0~80.0 μg/mL,测510 nm 处吸光度, 得标准曲线方程为:A=0.0106C+0.0062(R2=0.9993)。花色苷得率=[(C×V×N)/106×W]×100%,式中,C 为花色苷浓度,μg/mL;V 为花色苷原液体积,mL;N 为花色苷提取液稀释倍数;W 为百香果皮粉质量,g。
(1)单因素试验。在乙醇质量浓度为50%条件下,预设提取工艺参数中的常规量为液料比60∶1(mL/g),pH 3.0,超声功率500 W,超声时间30 min,分别考察液料比为40∶1~80∶1(mL/g),pH 为2.0~4.0,超声功率为400~600 W,超声时间为20~60 min,这4 个因素中5 个单因素变量对百香果皮花色苷得率的影响。
(2)响应面试验优化。依据单因素试验优化花色苷得率的测定结果,选取A:液料比50∶1、60∶1、70∶1(mL/g),B:pH 为3.0、3.5、4.0,C:超声功率500、550、600 W,D:超声时间20、30、40 min 为自变量,以测得的百香果皮花色苷得率(Y)为参考指标,在响应面设计分析中采用4 因素3 水平进行设计。
1.2.4 百香果皮膳食纤维提取 保加利亚乳杆菌和嗜热链球菌按1∶1 体积混合,经乳酸细菌培养基(MRS)平板活化、液体摇床150 r/min 培养,扩培20 h,待用。将多次超声提取花色苷后的料渣按1.2.1 步骤进行接种发酵。其中膳食纤维得率=(m/W)×100%,式中,m 为膳食纤维质量(g);W 为百香果皮粉质量(g)。
(1)单因素试验。把料渣置于250 mL 锥形瓶中,加入8.0%的脱脂奶粉后,预设液料比15∶1(mL/g),接种量8.0%,发酵温度36℃,发酵时间25 h 为工艺参数中的常规量,以膳食纤维得率为评价指标,考察液料比5∶1、7.5∶1、10∶1、12.5∶1、15∶1(mL/g),接种量2.0、4.0、6.0、8.0、10.0,发酵温度28、32、36、40、44℃,发酵时间15、20、25、30、35 h,这4 个因素中5个单因素对百香果皮膳食纤维提取效果的影响。
(2)优化试验。经过对单因素试验结果分析,选取液料比10∶1、12.5∶1、15∶1(mL/g),接种量4.0%、6.0%、8.0%,发酵温度32、36、40℃,发酵时间15、20、25 h,这4 个因子进行响应面法分析。
1.2.5 联产提取与单独提取效果比较试验 采用本联产工艺研究中各阶段得到的优化参数,与单独微波辅助提取果胶、超声波辅助提取花色苷和发酵法提取膳食纤维进行对比试验,比较连续提取和单提间的提取效果。
1.3 数据处理
数据以平均值±标准差表示,每组试验均重复3 次,试验数据运用Design Expert 8.0.6、Origin 8.6和SPSS 20.0 软件进行统计分析。
2 结果与分析
2.1 联产提取工艺中百香果皮果胶制备条件优化
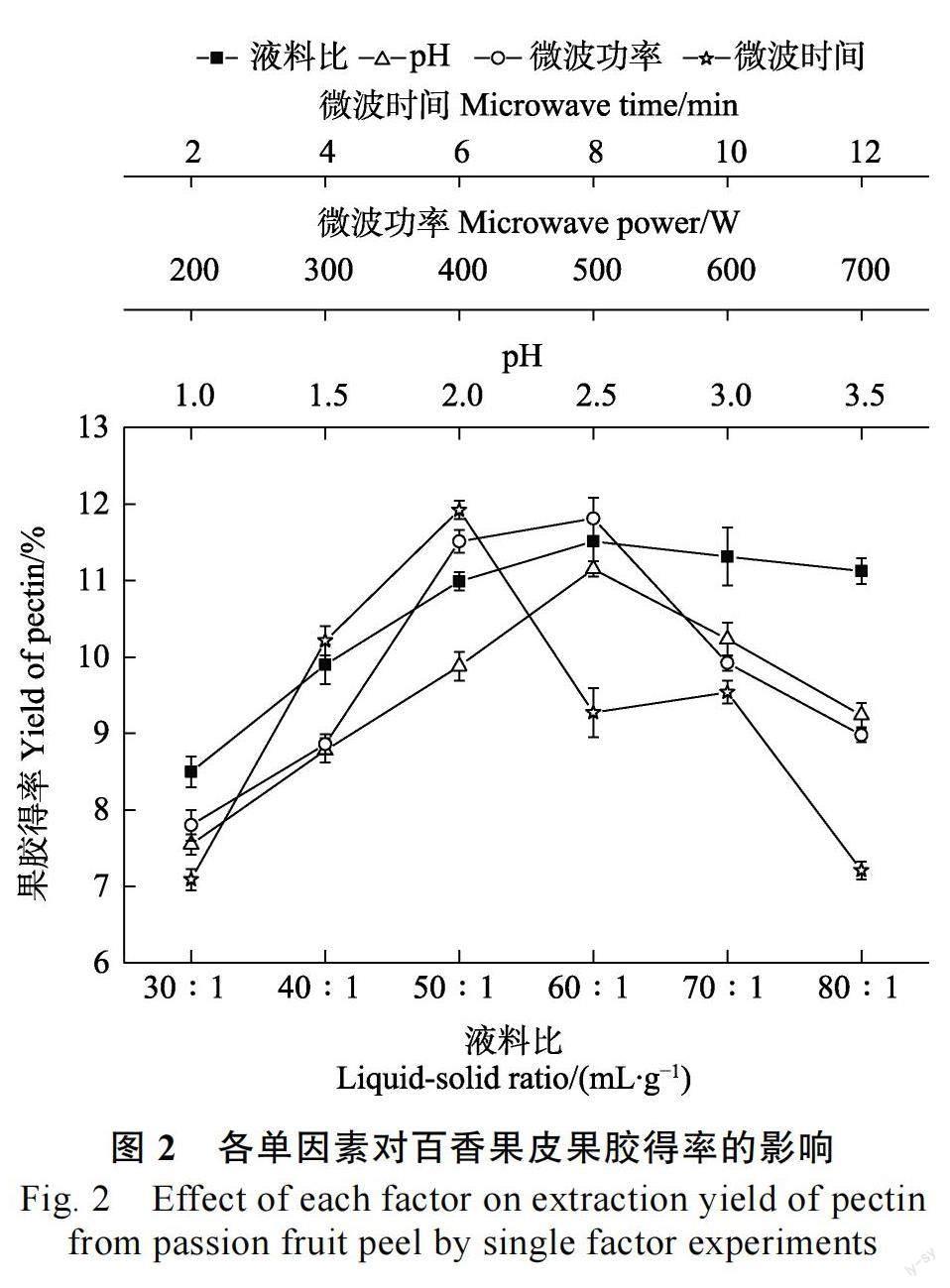
2.1.1 单因素试验结果分析 由图2 可知,液料比小于60∶1(mL/g)时百香果皮果胶得率随液料比的增加而上升,之后得率增减幅度不大。可能是液料比过小时不利于百香果皮充分浸制导致果胶未能完全溶出, 而浸提浓度大于60 ∶ 1(mL/g)后溶剂会加大对微波能量消耗,不利溶质对微波能量的吸收导致得率下降。综合考虑浓缩时能耗、时长、浸提效果和成本等因素,故料液比选择50∶1~70∶1(mL/g)为宜。
pH 不同,对果皮组织结构的破坏力和原果胶分解程度也不同。因此,只有在一定酸度条件下,才可以加快原果胶水解成果胶,得率才能达到最大值,若低于或高于该值,会造成其破坏力减弱或果胶侧链部分分解。故pH 选择2.0~3.0 为宜。
果胶得率在微波功率500 W 达最大值,可能开始时微波的穿透力和热效应随功率的增大而增强,有助于水介质摩擦撕裂植物细胞壁,加速细胞内原果胶的水解,促进果胶的溶出和扩散;接着得率下降是因果胶在酸性条件下耐热性较差,过大功率会增大体系压力使细胞及溶剂局部升温过高,引起部分果胶裂解为多糖分子[19-20],且功率过高提取液容易溢出引起实验误差。故微波功率为400~600 W 较适宜。
随微波时间的延长,果胶得率呈现先升高后下降的趋势。当微波时间为6.0 min 时得率达到最大值,之后得率急剧下降,可能是因为处理时间过短时提取液内部压力值和温度较小,果胶浸提不完全,而后部分果胶在长时间微波作用下被热裂解导致得率下降[21-22]。故微波时间选择4.0~8.0 min 较合理。
2.1.2 响应面试验结果分析 按1.2.2(2)中方法进行设计,采用Design-Expert 8.0.6 软件对数据进行线性处理,得到29 组不同因素组合试验,其中包括5 个中心点,试验设计方案及结果见表1。
对表1 中的试验数据进行多项回归设计及分析,获得百香果果胶得率对4 个编码自变量的相关回归系数,其二次多项回归方程为:
Y=?122.95308+0.54447×A+16.16833×B+0.40307×C+2.55867×D?0.03600×A×B?4.50000×10?5×A?6.37500×10?3×A×D+1.80000×10?3×B×C+0.08000×B×D?3.07500×10?3×C×D?3.45250×10?3×A2?3.05100×B2?4.34100×10?4×C2?0.095062×D2,进一步对回归方程进行分析,结果见表2。
由表2 方差分析数据显示,决定系数R2=0.9024,校正系数R2adj=0.8047,其回归模型达到极显著水平P<0.0001,失拟项P=0.0864>0.05,表明该模型与实际情况拟合程度良好。其次其置信度较高,变异系数CV=2.68%,因此可以用此回归模型对百香果皮果胶得率进行分析和预测。自变量B 和交互项AB、AC、AD、BC、BD、CD均不显著(P>0.05),自变量D 及二次项中的B2、C2 、D2对百香果皮果胶得率有极显著影响(P<0.01),自变量A、C 和二次项中的A2对百香果皮果胶得率有显著影响(P<0.05)。因素间对百香果皮果胶得率的影响程度顺序为:D(微波时间)>A(液料比)>C(微波功率)>B(pH)。
图3 直观反映了各因素和因素间交互作用对百香果皮果胶得率的影响,从变化速率来看,主效应大小为:微波时间>液料比>微波功率>pH,在各因素中微波时间对百香果皮果胶得率的影响最为显著,表现为曲线较陡,而料液比和微波功率次之,表现为曲线较为平缓,pH 和其他两两因素之间对果胶得率的交互作用不明显,这和表2 中数据的差异显著性相吻合。
2.1.3 提取工艺条件优化和验证 模型预测获得最佳条件为:液料比64.36∶1(mL/g),pH 2.47,微波功率455.10 W,微波时间4.98 min,百香果皮果胶得率最大理论值为12.61%。考虑实际操作可行性,优化为液料比65∶1(mL/g)、pH 2.5、微波功率450 W、微波时间5.0 min,并进行3 组平行实验,百香果皮果胶得率平均值为(12.45±0.06)%。与预测值相对误差为1.27%,表明所建立的模型能够预测实际百香果皮果胶提取,具有一定的实用价值。
2.2 联产工艺中百香果皮花色苷制备条件优化
2.2.1 单因素试验结果分析 由图4 可知,随着液料比的增加,百香果皮花色苷得率也不断增加,当液料比在60∶1~80∶1(mL/g)时,得率趋于平稳。可能因目标成分的溶出和扩散主要受传质动力影响,增加溶剂量会加大对超声波能量消耗,导致溶质所吸收的超声能量下降。考虑到溶剂成本和后续浓缩操作,故选取液料比50∶1~70∶1(mL/g)为佳。
随着pH 的增大先增后降,在pH 3.5 左右花色苷得率达最大值。可能由于百香果花色苷结构中含酚羟基在适宜温和的酸性条件下容易与水分子形成分子间氢键,从而增加花色苷的溶解性和稳定性[8, 23-24]。当pH 为2.0 时酸性较强容易造成氢键断裂,pH 为4.0 时酸性较弱不易形成氢键,故得率都较低。因此,最佳pH 选择3.5 左右比较适宜。
在超声功率为550 W 时花色苷得率达到最大值,而后呈下降趋势。可能是因为超声波功率较小时空化效应较弱,不利于花色苷的渗出和扩散,当功率过高时超声产生的空化作用过于激烈引起局部升温过快,进而断裂部分百香果花色苷分子结构,使得率降低[25]。故超声功率选500~600 W 为佳。
随超声时间的延长花色苷得率先升后降。可能开始料渣中的花色苷因溶液内部温度和压力较小浸提不彻底,超声30 min 后即可达完全渗透,而后在长时间的超声波机械剪切力作用下部分百香果花色苷被降解而损失[25]。考虑到能耗提取时间也不能过长,因此,以20~40 min 超声时间较适宜。
2.2.2 响应面试验结果分析 按1.2.2(2)中方法进行设计,采用Design-Expert 8.0.6 软件进行响应面设计,方案和花色苷得率结果见表3。
使用响应面分析法对表3 中的试验数据进行分析,可得到相关回归系数,其回归方程为:Y=?16.97017+0.15090×A+1.43100×B+0.03963×C+0.01278×D+2.50000×10?3×A×B?1.65000×10?4×A×C+1.75000×10?4×A×D+6.00000×10?4×B×C+0.00000×B×D?1.00000×10?5×C×D?6.11667×10?4×A2?0.27467×B2?2.84667×10?5×C2?2.61667×10?4×D2,进一步对回归方程进行分析(表4)。
由表4 可知,模型P<0.0001 达到极显著水平,表明不同处理组之间差异显著; 模型失拟项P=0.0870>0.05 不显著,证明所选模型适宜;并且决定系数R2=0.9864,说明误差对模型的影响小拟合程度良好;校正系数R2adj=0.9728,表明预测值与实测值之间具有高度相关性,较好反映液料比、pH、超声功率和超声时间对百香果皮花色苷得率的关系;再次变异系数CV=0.95%,也表明真实试验值能由模型方程来反映置信度较高,综合表明此回归模型可以准确预测百香果皮花色苷得率与自变量A、B、C 和D 之间的关系。其中自变量C、D 和二次项中的A2、B2、C2、D2 及交互项AC、AD、BC 都属于影响极显著的因素(P<0.01),自变量A 及交互项AB 属于影响显著因素(P<0.05),自变量B和交互项BD、CD 不显著(P>0.05)。
由图5 可知,D(超声时间)的曲面在AD、BD 和CD 中均最为陡峭,等高线密度均高于另外3个因子,表明超声时间对响应值的影响高于C、A、B。其次是超声功率其曲线也较陡,而料液比和pH 次之,其曲线较为平缓。且料液比与超声功率、料液比与超声时间、pH 与超声功率两两因素的交互作用极显著,其他2 个两两因素(pH 与超声时间、超声功率与超声时间)之间对花色苷得率的交互作用不明显,这和表4 中数据的差异显著性相吻合。4 个因素对花色苷得率的影响程度为:D(超声时间)>C(超声功率)>A(液料比)>B(pH)。
2.2.3 最佳工艺参数的选取和验证 通过拟合分析,确定提取百香果皮花色苷的最佳参数为液料比61.27∶1(mL/g),pH 为3.48,超声功率548.89 W,超声时间34.47 min,在此参数下预测花色苷得率1.249%。综合提取可操作性,将参数调整为液料比60∶1(mL/g),pH 3.5,超声功率550 W,超声时间35 min,并进行3 次平行试验,最终花色苷得率平均为1.21%±0.03%,与预测值相对误差为0.29%,表明响应面法优化分析获得的数据准确可靠。
2.3 联产工艺中百香果皮膳食纤维制备条件优化
2.3.1 单因素试验结果分析 由图6 可知,在同一发酵条件下,液料比为12.5∶1(mL/g)时,发酵产物中膳食纤维高达55.01%±0.78%,显著高于其他混合比例(P<0.05)。考虑到过多或过少的加水量都不利于菌体生长,影响乳酸等代谢产物生成,进而影响百香果皮膳食纤维的含量,故试验选择液料比为12.5∶1(mL/g),并在此基础上优化接种量、发酵温度和时间等条件。
在同一发酵条件下,随着接种量的增加,得率也随之增加,当接种量为5.0%时得率达最大,而后影响不明显。接种量过少时,会造成料渣中的菌体数不足影响乳酸等代谢产物的积累,进而导致得率低。故选择5.0%作为发酵培养基接种量。
发酵温度在28~36℃范围内,料渣中的膳食纤维得率随着温度的升高显著升高(P<0.05),到36℃时得率达到最大值55.23%±0.52%,大于36℃后得率降低。可能当温度达到36℃时,复合菌种产生的发酵产物达到了最大的富集;而后随温度进一步升高致使培养基温度升高过快,代谢热一时难以散发,不但影响到菌株正常代谢,还导致百香果皮中膳食纤维的纤维素和半纤维素之间作用力较强的氢键遭到破坏,使得半纤维素溶解加强,百香果皮膳食纤维得率下降[20, 26]。故发酵温度选择32~40℃为宜。
随着发酵时间的延长,得率先升高而后又显著降低,20 h 时得率达到最大。可能是因為发酵时间过短,菌丝体生长不完全,从而产生的百香果皮膳食纤维就少;时间过长,发酵周期延长,不但使发酵溶液体系中的pH 下降,导致产生的菌体出现自溶现象活菌数减少或抑制复合菌种的生长[27-28],得率下降;还增大生产成本。故发酵时间选12~16 h 为宜。
2.3.2 百香果皮膳食纤维得率的优化试验结果按1.2.2(2)中方法进行设计,运用Design-Expert8.0.6 软件对数据进行线性处理,试验设计方案及结果见表5。
对表5 中的试验数据进行二次回归拟合,得到相关回归系数及方程:
Y=?135.18492+2.72867×A+6.29525×B+4.80787×C+3.19647×D+0.03900×A×B+0.02100×A×C?8.60000×10?3×A×D?0.05781×B×C?0.10900×B×D?0.03125×C×D?0.14308×A2?0.23606×B2?0.05855×C2?0.03427×D2。进一步对回归方程进行分析(表6)。
由表6 方差分析可知,该回归模型的F 值为9.81,模型影响极显著(P<0.0001),失拟项不显著(P=0.558>0.05),表明模型有效。决定系数R2=0.9075,校正系数R2adj=0.8150,表明该模型能较好反映液料比、接种量、发酵温度和发酵时间与百香果皮膳食纤维得率的关系,且实测值将与预测值具有高度相关性;再次回归模型置信度较高(变异系数CV=3.34%),因此可用此模型对百香果皮膳食纤维得率进行分析和预测。在发酵影响因素中,除因素B、C、BD、A2、B2、C2、D2影响极显著(P<0.01),D、CD 影响显著因素(P<0.05),其他因素影响不显著(P>0.05)。
图7 直观反映了百香果皮膳食纤维得率与因素间及两两交互作用的关系,交互作用的等高线的形状越接近椭圆形,曲面弧度越陡,说明响应值对于处理条件改变的敏感程度越大,因素间交互作用越显著,反之则交互作用不显著。可以看出,影响百香果皮膳食纤维得率的主次因素为:B(接种量)>C(发酵温度)>D(发酵时间)>A(液料比),这和表6 中数据的差异显著性相吻合。
2.3.3 最佳工艺参数的选取 经拟合分析,获得的最佳条件为:液料比12.21∶1(mL/g),接种量5.05%,发酵温度35.12℃,发酵时间20.73 h,在此条件下预测得率为55.59%。为综合考虑料渣中膳食纤维的得率和实际操作,将提取工艺参数适当调整为液料比12.5∶1(mL/g),接种量5.0%,发酵温度35℃,发酵时间21 h,在此条件下进行3 次平行试验,平均得率为55.56%±0.05%,与预测值非常接近,相对偏差为0.19%,故所建立的回归模型能够预测实际百香果皮膳食纤维发酵,获得的参数准确可靠,具有一定的实用价值。
2.4 联产和单提效果的试验结果比较与分析
由表7 可以得出,采用微波辅助、超声波辅助和微生物发酵技术,连续从百香果皮中提取果胶、花色苷和膳食纤维,与单独采用微波辅助提取果胶、超声波辅助提取花色苷和微生物发酵技术提取膳食纤维相比,联产工艺中花色苷、膳食纤维产品的得率与单产相比分别减少了15.39%、11.43%。但从总的效益来看,若以每100 kg 百香果皮和渣原料计算, 联产工艺可得到果胶12.45 kg,花色苷1.21 kg,膳食纤维55.56 kg;而单提工艺得到的果胶、花色苷和膳食纤维分别为12.45、1.43、62.73 kg。参照目前市场同类产品的市售价(3 种粗提产品分别预估果胶90 元/kg,花色苷180 元/kg,膳食纤维50 元/kg)计算,一次联产工艺分别是单产果胶工艺效益的2.67 倍,单产花色苷工艺效益的14.99 倍,单产膳食纤维的0.31 倍,而原料仅为单产的1/3,且具有节能、环保等优点。
3 讨论
微波较强非离子电磁辐射穿透力,使水介质摩擦撕裂产生高效内热和电介质热快速传递能量,能缩短细胞中有效成分的溶出及扩散时间[19];超声空化效应形成高强度的冲击力和剪切穿透细胞壁,能促进细胞内有效成分溶出[19, 21];发酵法既能避免强酸强碱的影响,又能减少浸泡及冲洗过程中水溶性膳食纤维的流失,是一种理想的膳食纤维制备方式[20]。因此本研究工艺路线选择将微波、超声波辅助提取和微生物发酵技术集成运用于百香果果皮有效成分果胶、花色苷和膳食纤维的联产提取,即设计了一条连续提取百香果皮中果胶、花色苷和膳食纤维的工艺流程,考虑到果胶提取和醇析过程中会浸出部分花色苷,通过滤液回收可直接合并到第二阶段花色苷提取中,故本研究提出了一种先提取百香果皮中果胶,后连续提取花色苷和膳食纤维的新的联产工艺路线,大大提高了百香果皮的利用率和附加值。该联产工艺尚无文献报道,实验也表明该研究工艺路线合理、可行。
设计的联产提取过程中大多数溶剂可循环利用,除废水排放外,无废气、毒液排放,节能,环保。且各阶段采用RSM 法(响应面)拟合各函数之间非线性关系高精度的,并通过多元二次回归方程合理求得各阶段最佳工艺条件,所得3 种产品得率较高,因此本方法既可为百香果皮高值化全利用提供理论依据,也可为对其他动植物皮(壳)中成分联产提取提供一定的参考。
此外,本研究虽完成了一项百香果皮的增值研究工作,但由于研究的内容较多及试验条件限制,只初步完成了总体流程,还局限于提取的初级阶段,对采用哪种高新技术提取果胶、花色苷和膳食纤维,提高产品得率,及采用哪种分离纯化技术提高产品的纯度、稳定性,以及联产工艺对3 种产品的生物活性是否存在影响等问题均有待进一步深入探究。今后可以考虑采用液质联用、核磁共振等设备对百香果皮提取物(果胶、花色苷和膳食纤维)的结构进一步分析,探讨提取物活性的构效关系。也可进一步尝试将百香果皮提取物应用在果冻、面包及饼干等食品中,研究其对食品风味、感官和质构的影响。
4 结论
(1)微波辅助酸提果胶中各因素影响主次顺序为:微波时间>液料比>微波功率>pH,其最佳条件为液料比65∶1(mL/g)、pH 2.5、微波功率450 W、微波时间5.0 min,此条件下百香果皮果胶得率为12.45%±0.06%。
(2)超声波辅助从提取果胶后的滤渣中提取花色苷中各因素影响主次顺序为:超声时间>超声功率>液料比>pH,在乙醇质量浓度为50%条件下,其最佳条件为液料比60∶1(mL/g),pH 3.5,超声功率550 W,超声时间35 min,百香果皮花色苷得率为1.21%±0.03%。
(3)发酵法从提取果胶和花色苷后的百香果皮渣中提取膳食纤维中各因素影响主次顺序为:接种量>发酵温度>发酵时间>液料比,其最佳条件为液料比12.5∶1(mL/g),接种量5.0%,发酵温度35℃,发酵时间20 h,此条件下百香果皮膳食纤维得率为55.56%±0.05%。
(4)对联产工艺提取所得百香果皮果胶、花色苷和膳食纤维与单独提取效果进行比较表明,联产工艺中花色苷、膳食纤维的得率虽然与单产相比分别减少了15.39%、11.43%,但联产工艺节约了原料消耗,一次流程可获得3 种产品,且粗略估算联产工艺的效益是单产果胶、花色苷和膳食纤维的2.67 倍、14.99 倍、0.31 倍。因此,從总的效益来看,联产工艺更有利于提高百香果皮的产业效益。
