茶皂素对东亚飞蝗取食、消化及生长发育的影响
2023-05-30王铭铭崔国盈魏秀红张勇娟季荣张永军何岚
王铭铭 崔国盈 魏秀红 张勇娟 季荣 张永军 何岚
摘要 为明确茶皂素(tea saponin)对东亚飞蝗Locusta migratoria manilensis取食、消化及生长发育的影响,分别测定了13.26、82.88、169.89 mg/L茶皂素溶液对东亚飞蝗3龄蝗蝻取食量、消化酶活性、生长速率及营养效应的影响。结果显示,随着茶皂素浓度增加,试虫取食量、α-淀粉酶和胃蛋白酶活性、生长速率均显著下降;13.26 mg/L茶皂素溶液处理后,随着时间延长,试虫体内消化酶活性同样呈显著下降趋势,α-淀粉酶和胃蛋白酶活性分别在处理后12 h和24 h时显著低于对照组;茶皂素溶液显著降低了试虫的食物转化率和食物利用率,但13.26 mg/L茶皂素处理组试虫近似消化率高于对照组。研究结果表明茶皂素可以显著抑制东亚飞蝗取食和对营养的消化及吸收,抑制蝗蝻的生长发育,是蝗虫防治潜在的生物制剂。
关键词 茶皂素; 取食量; 消化酶; 营养效应指标; 生长速率; 东亚飞蝗
中图分类号: S 433.2
文献标识码: A
DOI: 10.16688/j.zwbh.2022224
Abstract In order to determine the effects of tea saponin on feeding, digestion, growth and development of Locusta migratoria manilensis, the effects of 13.26, 82.88 mg/L and 169.89 mg/L tea saponin solution on feed intake, activity of digestive enzyme, growth rate and nutrition effect index of the third instar locusts were determined, respectively. The results showed that with the increase of tea saponin concentration, the food intake, α-amylase and pepsin activities, and growth rate were significantly decreased. After treatment with 13.26 mg/L tea saponin solution, the digestive enzyme activity in the test insect also showed a significant decline trend with the time, α-amylase and pepsin activities were significantly lower than those of the control group 12 h and 24 h after treatment. The tea saponin significantly reduced the food conversion and food utilization of locusts, but the approximate digestibility of individuals treated with the 13.26 mg/L tea saponin was higher than that of the control group. The results showed that tea saponin can significantly inhibit the feeding, digestion and absorption of nutrients, and inhibit the growth and development of locusts. It is a potential biological agent for locust control.
Key words tea saponin; food intake; digestive enzymes; nutritional effect index; growth rate; Locusta migratoria manilensis
蝗災是世界三大自然灾害之一,长期以来对全球农业和畜牧业造成了严重的影响[1]。化学防治具有杀虫效果好、见效快、操作简单等优点,是防治蝗虫的必要手段。但随着人们对生态环境的保护意识日益增强,对生态环境友好的防治方法越来越被人们关注[2-3]。植物次生代谢物质是植物在长期进化过程中产生的化合物,在植物抵御不良环境或植食性昆虫取食过程中具有重要作用,一般具有环境友好和昆虫不易产生耐药性等优点[4-5]。我国植物资源丰富,防治蝗虫的植物次生代谢物开发潜力巨大[6]。
植物次生代谢物在抵御昆虫取食中发挥重要作用[7-8]。植物源拒食剂可以有效阻碍昆虫取食为害[9]。昆虫肠道含有多种消化酶,如淀粉酶、蛋白酶等参与物质消化和吸收,而植物体内含有丰富的防御物质,可抑制昆虫取食、影响昆虫生长发育和繁殖[10-11]。例如,芦丁(rutin)可以抑制亚洲小车蝗Oedaleus asiaticus的生长,0~1%的芦丁使其生长速率从18.2 mg/d显著下降至5.9 mg/d[12]。大豆浸提物抑制赤拟谷盗Tribolium castaneum的胰蛋白酶活性[13]。美国白蛾Hyphantria cunea幼虫取食单宁后生长发育受到显著抑制,幼虫在化蛹过程中全部死亡[14]。菊花中提取的次生代谢物黄烷酮(flavanone)抑制甘蓝夜蛾Mamestra brassicae的生长发育[15]。经印楝素和麻风树油处理过的沙漠蝗Schistocerca gregaria从5龄发育至6龄所需时间长于对照组[16]。由此可见,一些植物次生代谢物可以作为拒食剂、生长发育抑制剂等有效阻止害虫种群发展。
茶皂素(tea saponin)是山茶科Theaceae山茶属Camellia植物中皂素的统称[17]。茶皂素对哺乳动物毒性较低,但对昆虫有毒害作用[18]。例如,茶皂素显著增加小菜蛾Plutella xylostella死亡率,降低试虫取食量,延长试虫发育历期,抑制其体重增长和生长发育速率[19]。吴建国等[20]报道了茶皂素在防治新疆草原蝗虫中的应用,但是茶皂素对蝗虫的毒性作用机理以及蝗虫对茶皂素的生理响应尚不清楚。本研究旨在明确茶皂素对东亚飞蝗取食量、消化酶活性、营养效应指标及生长速率的影响,研究结果将为合理应用茶皂素防治蝗虫提供理论依据。
1 材料与方法
1.1 材料
1.1.1 供试昆虫及小麦
试验所需东亚飞蝗卵购自云南东亚飞蝗养殖场。蝗卵置于温度(30±2)℃、相对湿度(50±5)%和光周期L∥D=14 h∥10 h的人工气候箱内饲养,孵化后饲喂新鲜充足的小麦苗,选择同龄期的健康3龄蝗蝻供试。
试验所用小麦种子由新疆天博草业有限公司提供。种子经冷水浸泡20 h后平铺在苗盘上,避光置于15~20℃环境下培养,每日喷水2~3次保湿,待小麦嫩芽长至1 cm时,让其接受光照,收割高为10~15 cm小麦苗用于试验。
1.1.2 供试试剂
30%茶皂素溶液由湖北绿天地生物科技有限公司生产,由新疆维吾尔自治区蝗虫鼠害预测预报防治中心提供。根据本课题组前期的毒力测定结果,茶皂素对东亚飞蝗致死的LC5、LC25、LC50分别为13.26、82.88 mg/L和169.89 mg/L,试验按照此浓度将30%茶皂素溶液稀释备用。
α-淀粉酶活性检测试剂盒(AKSU030M),胃蛋白酶活性检测试剂盒(AKPR006M)购于北京盒子生工科技有限公司。
1.1.3 供试设备
人工气候箱(GTOP-26OB),浙江托普有限公司;精密电子天平(ME204E),梅特勒-托利多公司;电热恒温鼓风干燥箱(DHG-9070A),上海齐欣科学仪器有限公司;液氮罐(YDS-30),四川亚西机器有限公司;多功能酶标仪(infinite M200 PRO),瑞士Tecan;微量进样器,上海安亭微量进样器厂;养虫盒(450 mL),购自淘宝。
1.2 试验方法
1.2.1 茶皂素对东亚飞蝗取食量、营养效应和生长速率的影响
每日称取4 g新鲜小麦苗,于90℃ 38 h烘干至恒重,记录鲜重与干重,计算出干湿重比Pi(Pi=干重/鲜重)。每日称取4 g新鲜小麦苗,分别在13.26、82.88 mg/L和169.89 mg/L的茶皂素液中浸泡5 s,取出晾干后放入养虫盒,以蒸馏水浸泡的麦苗为对照。为每个养虫盒接入3头饥饿12 h大小相似且健康的3龄蝗蝻,每浓度处理10组,于每日上午10时更换食物,收集前一天食物残渣及粪便于信封内,90℃ 38 h烘干至恒重,用电子分析天平称取食物残渣干重及粪便干重,连续记录3 d。3 d后将存活的试虫液氮速冻,烘干至恒重后称取干重,记作处理后试虫干重。取30头饥饿12 h同日龄、大小相似的试虫,称取鲜重后烘干,称取干重,记作处理前试虫平均干体重。计算每头试虫3 d的取食量、近似消化率、食物利用率、食物转化率和试虫的生长速率。
取食量=Pi×4g-食物残渣干重;
近似消化率=(取食食物干重-粪便干重)/取食食物干重×100%;
食物利用率=體重增加干重/取食食物干重×100%;
食物转化率=体重增加干重/(取食食物干重-粪便干重)×100%;
生长速率=(处理后试虫干重-处理前试虫平均干重)/发育时间。
1.2.2 茶皂素对东亚飞蝗消化酶活性的影响
1.2.2.1 不同浓度茶皂素对东亚飞蝗消化酶活性的影响
选择同龄期大小相似且健康的3龄蝗蝻为试验对象。配制13.26、82.88 mg/L和169.89 mg/L的茶皂素溶液备用,同时设置蒸馏水对照组。用微量进样器取5 μL茶皂素溶液注入试虫腹部第二腹节侧面,每浓度注射30头,对照组注射蒸馏水。饲养条件如1.1.1,处理后24 h将存活试虫液氮速冻,置于-80℃冰箱保存。随机取处理后的单头试虫,按照试剂盒的操作步骤测定消化酶活性,每浓度设5次生物学重复,2次技术重复。
1.2.2.2 茶皂素处理后不同时间东亚飞蝗消化酶活性的变化
配制13.26 mg/L的茶皂素溶液。用微量进样器取5 μL茶皂素溶液注入试虫腹部第二腹节侧面,以注射蒸馏水为对照。饲养条件如1.1.1,于处理后0、12、24 h和48 h将存活试虫(每时间段20~30头)液氮速冻,置于-80℃冰箱保存。随机选取处理后的单头试虫按照试剂盒的操作步骤测定酶活性,茶皂素处理组与对照组每组各浓度均设5次生物学重复,2次技术重复。
1.3 数据分析
采用单因素方差分析法分析不同浓度的茶皂素(13.26、82.88 mg/L和169.89 mg/L)处理后对照组和茶皂素处理组试虫取食量、生长速率、营养效应指标、消化酶活性的差异。采用独立样本t测验法分析13.26 mg/L茶皂素处理0、12、24、48 h后处理组与对照组消化酶活性的差异。差异显著水平设为α=0.05。所有分析在SPSS软件中进行。
2 结果与分析
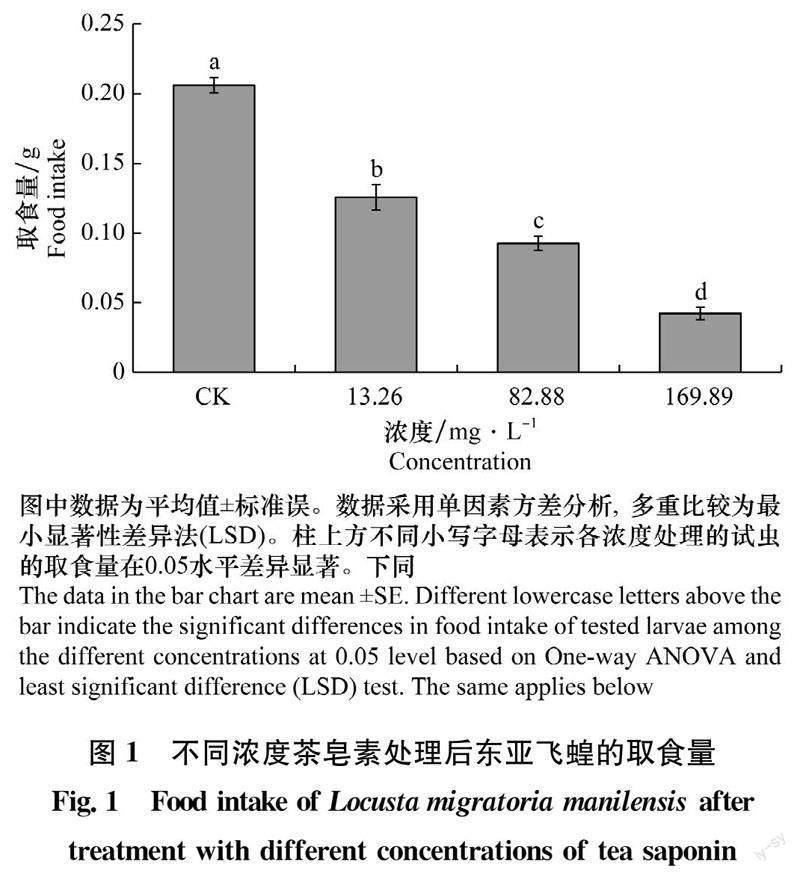
2.1 不同浓度茶皂素处理后东亚飞蝗取食量的变化
用不同浓度的茶皂素溶液处理的小麦苗饲喂试虫后3 d,对照组,13.26、82.88 mg/L和169.89 mg/L茶皂素溶液处理组每头试虫的平均取食量分别为0.21、0.13、0.09 g和0.04 g,随着茶皂素浓度增加,试虫取食量显著下降(F3,36=114.394,P=0.000)(图1)。
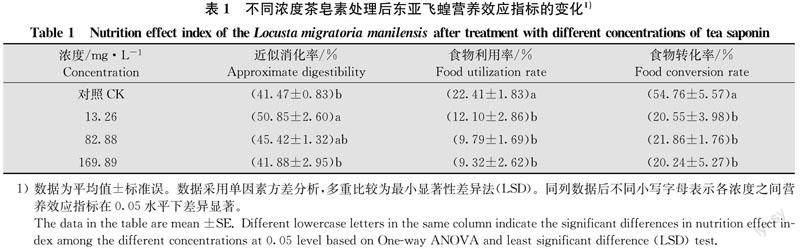
2.2 不同浓度茶皂素处理后东亚飞蝗营养效应指标的变化
不同浓度的茶皂素溶液处理试虫后3 d,试虫食物利用率(F3,36=7.056,P=0.001)和食物转化率(F3,36=14.796,P=0.000)显著低于对照组,但是13.26 mg/L茶皂素稀释液处理组试虫近似消化率显著高于对照组(F3,36=4.221,P=0.012)(表1)。
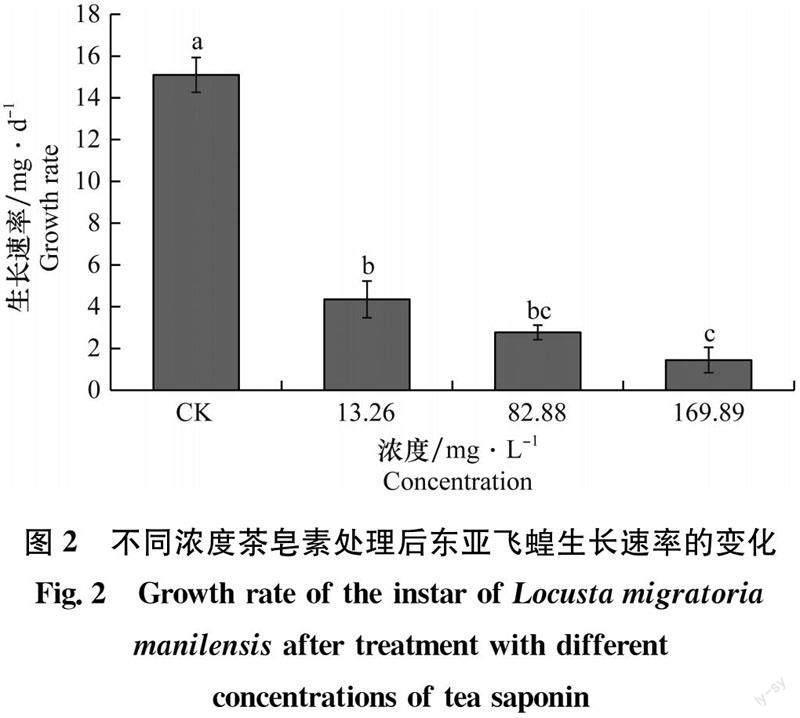
2.3 不同浓度茶皂素处理后东亚飞蝗生长速率的变化
对照组,13.26、82.88 mg/L和169.89 mg/L茶皂素处理组试虫的生长速率分别为15.10、4.35、2.77 mg/d和1.45 mg/d,随着茶皂素浓度的增加,试虫生长速率显著降低(F3,36=79.496,P=0.000)(图2)。
2.4 茶皂素对东亚飞蝗消化酶活性的影响
2.4.1 不同浓度茶皂素处理后东亚飞蝗消化酶活性的变化
对照组,13.26、82.88 mg/L 和169.89 mg/L茶皂素处理组试虫24 h后,α-淀粉酶活性分别为1.16、0.58、0.33 U/g和0.21 U/g(图3a),胃蛋白酶活性分别为2.22、1.34、0.67 U/g和0.41 U/g(图3b)。随着茶皂素液浓度的增加,试虫α-淀粉酶(F3,16=109.657,P=0.000)和胃蛋白酶(F3,16=85.772,P=0.000)活性显著下降,其中169.89 mg/L茶皂素处理组试虫α-淀粉酶和胃蛋白酶活性分别较对照组个体下降了81.90%和81.53%。
2.4.2 茶皂素处理不同时间后东亚飞蝗消化酶活性的变化
由图4可知,蒸馏水处理组(对照)试虫α-淀粉酶(F3,16=0.404,P=0.752)和胃蛋白酶(F3,16=0.836,P=0.494)活性均未发生显著变化。但是,13.26 mg/L茶皂素处理时,随着处理时间延长,α-淀粉酶活性和胃蛋白酶活性显著下降,处理48 h,处理组试虫α-淀粉酶活性由0 h的1.01 U/g显著下降至0.36 U/g(F3,16=33.228,P=0.000),胃蛋白酶活性由0 h的1.93 U/g显著下降至0.85 U/g(F3,16=17.122,P=0.000)。与对照组相比,13.26 mg/L茶皂素处理0 h时α-淀粉酶活性与对照组无显著差异(t8=1.218,P=0.258),处理12、24 h和48 h后,茶皂素处理组α-淀粉酶活性显著低于对照组(12 h:t8=2.986,P=0.017;24 h:t8=8.853,P=0.000;48 h:t8=11.201,P=0.000)。13.26 mg/L茶皂素处理0 h和12 h,试虫胃蛋白酶活性与对照组无显著差异(0 h:t8=0.523,P=0.615;12 h:t8=2.31,P=0.05),处理24 h和48 h,茶皂素处理组胃蛋白酶活性显著低于对照组(24 h:t8=5.739,P=0.000;48 h:t5.109=6.211,P=0.001)。
3 结论与讨论
本研究发现,茶皂素能显著抑制东亚飞蝗取食,随着茶皂素浓度增加,试虫取食量显著下降。其他学者也报道了茶皂素对昆虫的抑食作用。例如,用500 mg/L茶皂素水溶液浸泡过的芥蓝Brassica oleracea var. albiflora叶片饲喂菜青虫Pieris rapae 5龄幼虫12 h后,幼虫拒食率高达100%[21],用质量浓度大于800 mg/L的茶皂素溶液浸泡过的甘蓝Brassica oleracea var. capitata叶片饲喂菜青虫3、4、5龄幼虫,试虫表现出强烈的拒食性[22]。潘如军等报道,浓度为5.0%、10.0%和20.0%的茶皂素对甘薯小象甲Cylas formicarius 24 h的拒食率均达90%以上,最高达到98.57%[23]。茶皂素对昆虫具有拒食效果的原因可能有两个,一方面茶皂素具有浓烈的苦味,大多数昆虫并不喜欢苦味;另一方面可能是昆虫取食茶皂素后其肠道发生病变,消化系统功能紊乱,导致厌食反应[21]。
茶皂素对试虫营养效应指标和消化酶活性的影响试验结果显示,茶皂素可抑制消化酶活性,降低了食物在试虫体内的转化效率和利用效率,限制了试虫能量的摄入,从而影响试虫对营养物质的消化和吸收,进而影响其生长发育速率。其他研究也发现了茶皂素对昆虫摄食和生长发育的负面作用,例如,Yu等研究报道,茶皂素抑制了小菜蛾的摄食行为和生长发育[24]。潘如军等认为茶皂素可能具有抗保幼激素活性,使甘薯小象甲幼虫发育历期缩短[23]。涂雄兵等报道,低温环境下,东亚飞蝗蝗蝻感染绿僵菌后其近似消化力较高但食物转化率较低,这可能与蝗虫体内的能量分配有关,即高消化获得的能量绝大部分用于抵抗绿僵菌孢子的侵染,用于生长发育的能量分配则相对减少[25]。我们研究发现,茶皂素处理组试虫食物利用率和食物转化率显著低于对照组。可能是大部分能量被用来抵御茶皂素的毒性胁迫,用于幼虫生长发育的能量减少,因此,试虫生长发育速率受到显著抑制。值得注意的是,13.26 mg/L茶皂素处理组试虫的近似消化率显著高于对照组个体,但是82.88 mg/L和169.89 mg/L茶皂素处理时降低至对照组水平,表明低浓度茶皂素处理下,试虫可以通过提高消化率来补偿取食量的下降,但是随着茶皂素浓度增加,蝗虫取食量急剧降低,肠道内无足够的食物用来消化,因而近似消化率下降。
本研究发现试虫α-淀粉酶和胃蛋白酶活性分别在13.26 mg/L茶皂素处理后12、24 h被显著抑制,说明茶皂素可迅速抑制兩种酶的活性,干扰东亚飞蝗的取食、消化。本文未检测到脂肪酶活性,这可能与植食性昆虫的食性有关,东亚飞蝗主要利用植物中的糖类和蛋白质,对脂肪的利用较少[26]。茶皂素导致东亚飞蝗取食量下降,消化酶活性受抑制,降低了食物转化率和食物利用率,必然影响生长发育速率。
研究结果为茶皂素对蝗虫取食生理及生长发育的作用补充了基础数据,为合理利用茶皂素防治蝗虫提供了参考。
参考文献
[1] LECOQ M, CEASE A. What have we learned after millennia of locust invasions? [J/OL]. Agronomy, 2022, 12(2): 472. DOI: 10.3390/agronomy12020472.
[2] 徐超民, 王加亭, 李爽, 等. 蝗虫综合防控技术研究进展[J]. 植物保护学报, 2021, 48(1): 73-83.
[3] 李霜, 王加亭, 潘凡, 等. 沙漠蝗防控技术的综述[J]. 植物保护学报, 2021, 48(1): 37-45.
[4] 谭海军. 中国生物农药的概述与展望[J]. 世界农药, 2022, 44(4): 16-27.
[5] 董妍玲, 潘学武. 植物次生代谢产物简介[J]. 生物学通报, 2002(11): 17-19.
[6] 石旺鹏, 谭树乾. 蝗虫生物防治发展现状及趋势[J]. 中国生物防治学报, 2019, 35(3): 307-324.
[7] RANI P U, JYOTHSNA Y. Biochemical and enzymatic changes in rice plants as a mechanism of defense [J]. Acta Physiologiae Plantarum, 2010, 32(4): 695-701.
[8] GONG Bin, ZHANG Guangfu. Interactions between plants and herbivores: a review of plant defense [J]. Acta Ecologica Sinica, 2014, 34(6): 325-336.
[9] 朱玉坤. 昆虫拒食剂研究进展[J]. 世界农药, 2012, 34(3): 28-30.
[10]陈澄宇, 康志娇, 史雪岩, 等. 昆虫对植物次生物质的代谢适应机制及其对昆虫抗药性的意义[J]. 昆虫学报, 2015, 58(10): 1126-1139.
[11]KESSLER A, BALDWIN I T. Plant responses to insect herbivory: the emerging molecular analysis [J]. Annual Review of Plant Biology, 2002, 53(1): 299-328.
[12]WANG Yueyue, HUANG Xunbing, CHANG B H, et al. The survival, growth, and detoxifying enzyme activities of grasshoppers Oedaleus asiaticus (Orthoptera: Acrididae) exposed to toxic rutin [J]. Applied Entomology and Zoology, 2020, 55(4): 385-393.
[13]HILDER V A, GATEHOUSE A M R, SHEERMAN S E, et al. A novel mechanism of insect resistance engineered into tobacco [J]. Nature, 1987, 330(6144): 160-163.
[14]王沫, 姜礅, 孟昭军, 等. 美国白蛾生长发育对寄主植物不同次生代谢物质的适应性[J]. 东北林业大学学报, 2020, 48(3): 100-104.
[15]BENINGER C W, ABOU-ZAID M M, KISTNER A L E, et al. A flavanone and two phenolic acids from Chrysanthemum morifolium with phytotoxic and insect growth regulating activity [J]. Journal of Chemical Ecology, 2004, 30(3): 589-606.
[16]BASHIR E M, EI SHAFIE H A F. Toxicity, antifeedant and growth regulating potential of three plant extracts against the desert locust Schistocerca gregaria Forskal (Orthoptera: Acrididae) [J]. American Journal of Experimental Agriculture, 2014, 4(8): 959-970.
[17]麻程军, 王瑞, 刘彬, 等. 茶皂素杀螺活性及对3种水生生物的安全性[J]. 农药学学报, 2021, 23(1): 139-145.
[18]LIN Shuo, CHEN Yixin, BAI Yan, et al. Effect of tea saponin-treated host plants on activities of antioxidant enzymes in larvae of the diamondback moth Plutella xylostella (Lepidoptera: Plutellidae) [J]. Environmental Entomology, 2018, 47(3): 749-754.
[19]QASIM M, ISLAM W, ASHRAF H J, et al. Saponins in insect pest control [M]∥MERILLON J M, RAMAWAT K G. Co-evolution of secondary metabolites. Springer, Cham, 2020: 897-924.
[20]吴建国, 郭宏. 30%茶皂素对草地蝗虫的防控效果试验[J]. 青海草业, 2020, 29(4): 15-17.
[21]王小艺, 黄炳球. 茶皂素对菜青虫的拒食作用方式及机制[J]. 昆虫知识, 1999(5): 277-281.
[22]王小艺, 黄炳球. 茶皂素对菜青虫幼虫的拒食活性[J]. 中国蔬菜, 1999(1): 26-28.
[23]潘如军, 唐秀桦, 何龙飞, 等. 茶皂素对甘薯小象甲的行为及生长发育的影响[J]. 西南农业学报, 2019, 32(7): 1566-1571.
[24]YU Xiaolan, HE Yong. Tea saponins: effective natural surfactants beneficial for soil remediation, from preparation to application [J]. RSC Advances, 2018, 8(43): 24312-24321.
[25]涂雄兵, 李志紅, 牙森·沙力, 等. 绿僵菌侵染后东亚飞蝗营养生理参数变化研究[J]. 应用昆虫学报, 2011, 48(4): 896-901.
[26]吴昊. 蝗虫口器结构、消化酶及食性选择[D]. 太原: 山西大学, 2010.
(责任编辑:杨明丽)
