Bi掺杂的直接甲醇燃料电池阳极催化剂研究进展
2023-05-30顾颖颖于永昌龙安椿葛宪龙宋炎锴蒙敏凤胡少华
顾颖颖 于永昌 龙安椿 葛宪龙 宋炎锴 蒙敏凤 胡少华
摘要:发展可替代能源对缓解全球能源问题具有重要意义。直接甲醇燃料电池(direct methanolfuel cell,DMFC)因其工作温度低、能量密度高以及污染物排放少等特性,正逐渐成为最有发展前景的便携式能源技术之一。目前,其商业化进程主要取决于甲醇氧化反应(methanol oxidationreaction,MOR)的动力学快慢、催化剂的成本和寿命。Bi元素的掺杂可以极大地提高甲醇电催化氧化的性能,并且可以提高阳极催化剂抵抗CO中毒的能力。介绍了掺杂Bi的贵金属和非贵金属阳极电催化剂,以及贵金属掺杂Bi203、Bi2W06等光辅助电催化剂;综述了它们提高甲醇电催化氧化性能的机制,并展望了阳极Bi电催化剂在DMFC中所面临的机遇和挑战。
关键词:直接甲醇燃料电池:阳极Bi基催化剂;甲醇氧化反应;电催化性能
中图分类号:O614.53 文献标志码:A
煤、石油、天然气等不可再生能源的过度使用将引发能源危机,并导致环境污染等问题,这将严重地阻碍人类社会的进步。为了解决此问题,必须要发展从各种可再生原料中生产可再生燃料的技术,实现能源转型。其中燃料电池就是一种新型能源利用技术,可以有效解决上述问题。与传统的能源供应方法相比,新型甲醇燃料电池的特点是能量密度更高、体积更小、不会造成环境污染,以及拥有更容易充放电的电路。然而,这种电池的核心部件对甲醇氧化过程中催化剂的催化效果有更高的要求,且催化剂必须抗中毒能力强、能量密度高。
Pt是目前最常用的甲醇氧化的催化剂,但是其高昂的生产成本,以及对CO的耐受性限制了其发展。越来越多的研究将第2种金属(Ni、Bi、Pd)与Pt进行掺杂[1-5],以提高催化剂的电催化性能(活性和稳定性),并且降低生产成本。第2种金属中,Bi由于在酸性和碱性条件下能增强催化剂的活性和稳定性,成为了制备双金属纳米结构催化剂有力的候选者。在Pt基材料中添加Bi不仅是改善其结构特性和催化性能的重要方法,而且还影响其电化学特性。Chen等[6-7]报道,Pt表面上的Bi原子可以产生电子诱导效应。与单纯Pt的电子密度相比,Pt/Bi纳米颗粒中的Bi原子在近费米能级上耗尽了Pt原子的电子密度。
除Pt/M(“M”表示“第2种金属”)二元或多元催化剂外,非贵金属元素的过渡金属基催化剂因其成本低和丰度高被认为是贵金属催化剂的替代者[8-9]。研究发现,过渡金属间的电子结构由于元素间的电荷转移而发生改变,从而导致CO在金属位点上的吸附比单金属本身的吸附弱。此外,过渡金属元素在碱性溶液中较容易生成MOOH活性物种,从而促进中间产物CO的氧化[10-11]。这些非贵金属掺杂Bi后,电催化性能有很大提高,抵抗CO中毒能力也有很大增强,并且极大地降低了生产成本。
在最新的研究中,许多研究者合成了Bi203、Bi2W06等负载型的催化剂[12一14]。这些催化剂在光的照射下对甲醇氧化反应( methanol oxidationreaction,MOR)显示出优异的光电催化活性。这些催化剂特定的能带结构和活性较高的界面,对光生电荷的分离和转移非常有效。因此,在光辅助下提高了催化剂阳极电催化氧化的能力。直接甲醇燃料电池(direct methanol fuel cell,DMFC)采用质子交换膜做固体电解质,以甲醇作为燃料,属于低温燃料电池。低成本.高活性的阳极电催化剂的开发对于促进DFMC的发展具有重要意义。本文对DMFC的研究进展进行详细介绍。
1 DMFC的工作原理与研究进展
1.1 DMFC的工作原理
DMFC由阳极、离子交换隔膜、阴极和电解质溶液等组成,根据电解质溶液的差别,其工作原理不完全相同[15]。
在酸性介质中,甲醇被不断地输送到阳极室,在阳极催化剂的辅助下与H2O反应生成CO2、H+和e,产生的CO2从阳极室出口排出,H+通过质子交换膜到达阴极室与外电路转移的e-起将02还原成H2O,产生的H2O从阴极室出口排出。反应过程如下方程式所示:
阳极:CH3OH+H2O → CO2+6H++6e-(1)
阴极:6H++1.5O2+6e-→ 3H2O (2)
總反应:CH3OH+1.5O2→ CO2+2H2O (3)
在碱性介质中,阳极区的甲醇在催化剂的辅助下与OH反应生成CO2、H2O和e,阴极区的O2与H2O和外电路的e反应生成OH,并且通过电解质膜同到阳极继续参与反应,由于OH_和燃料的移动方向相反,因此可以显著降低甲醇的交叉渗透问题。反应过程如下方程式所示:
阳极:CH3OH+6OH-→ CO2+5H2O+6e (4)
阴极:3H2O+1.5O2+6e-→ 6OH-(5)
总反应:CH3OH+1.5O2→ CO2+H2O (6)
1.2 甲醇的氧化反应
在催化剂的辅助下,阴极的O2扩散到三相界面(固、气、液)发生还原反应,反应过程中涉及2e和4e路径,通常情况下是由2e和4e转移路径同时混合发生的。阳极甲醇分子在催化剂的辅助下发生氧化反应,完全氧化成C02需要释放6e。
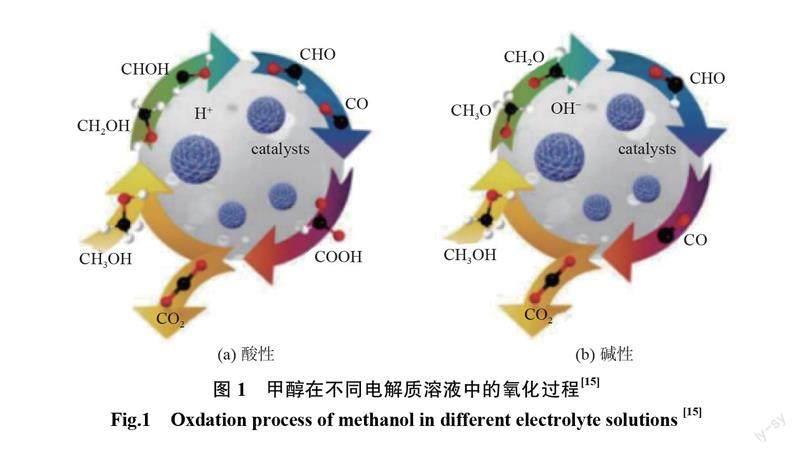
图1为甲醇在不同电解质溶液中的氧化过程。如图1所示:(1)在酸性电解质溶液中MOR最先脱去的是烷基上的氢,等到烷基上的氢完全脱去之后,羟基上的氢才会脱去,然后生成的碳质中间体与水分子解离产生的含氧物种结合生成羧基,接着与另一个含氧物种结合生成最终的产物CO2和H2O; (2)在碱性电解质溶液中,甲醇最先脱去的是羟基上的氢,而后烷基上的氢才开始脱落,等到氢完全脱去后产生的碳质中间体直接与H2O解离产生的含氧物种结合生成物生成最终产物CO-)和H,O。碱性电解质溶液比酸性电解质溶液去除碳质中间体需要的含氧物种更少,因此,和在酸性溶液中相比,催化剂在碱性溶液中较不易中毒,并且在碱性介质中的反应速率更快。堿性介质还降低了催化剂和碳材料的腐蚀风险,并增强了金属材料的电催化性能。
1.3 DMFC阳极催化剂研究现状
目前,DMFC阳极催化剂的研究主要存在以下一些问题:(1)催化剂本身的活性比较低,甲醇氧化的反应动力学比较缓慢;(2)Pt作为甲醇氧化最常用的催化剂,储量低,负载率高,成本高昂;(3)催化剂抗中毒能力差,易中毒。
Pt基催化剂是甲醇氧化时最常用和最有效的电催化剂。然而,其高昂的成本、较差的耐久性并且容易CO中毒,限制了其广泛使用。此外,越来越多的注意力集中在非贵金属(Mn、Ni、Co、Bi等)作为引入Pt基催化剂的第二种金属上[8,16-18],以减少高成本贵金属的使用。特别是Bi掺杂催化剂因其在提高电催化活性和抑制毒性效应方面具有良好的性能而受到了广泛关注。
2 Bi掺杂的贵金属阳极催化剂电催
化甲醇氧化
2.1 Bi掺杂的Pt单贵金属电催化剂
Pt/Bi催化剂因其在提高电催化活性和抑制毒性方面具有良好的性能而受到了广泛关注。Yang等[18]报道了在碱性介质中电沉积球形Pt/Bi纳米颗粒用于催化甲醇氧化。Liao等[19]用一锅法合成了Pt/Bi纳米片(或纳米线),其形状可控,用于催化甲醇氧化。Figueiredo等[20]报道了,在碱性介质中,表面不可逆吸附的Bi修饰的Pt/C对甲醇氧化的催化活性有增强作用。他们发现,将Bi引入Pt基材料可有效地抑制C0对Pt表面的毒害作用,并促进直接氧化过程[21]。Bi白发地吸附在Pt表面上,从而形成稳定的表面,其中Pt活性位点可以大大减少。因此,许多研究强调将Pt与适量Bi结合,以确保Bi对C0耐受性的促进作用,并减少Pt的活性位点。
Zhong等[22]通过NaBH4还原Pt、Bi,然后采用硝酸蚀刻将痕量Bi引入Pt基催化剂中。蚀刻过程导致形成中空的P佃i纳米颗粒,其内部中空直径为2.5 nm。Bi的痕量存在不仅为Pt/Bi保留了更大的电催化活性表面积(electrocatalytic active surfacearea,ECSA),且极大地提高了抗C0中毒能力。
2.2 Bi掺杂的Pf/Ru双贵金属电催化剂
Pt瓜u合金被发现是DMFC最活跃的二元催化剂。与纯Pt相比,Pt/LI催化剂的甲醇氧化活性增强归因于双功能机制和电子(配体)效应。该机制为含氧物质在较低电势下吸附在Ru原子上,从而促进CO氧化为CO2。Pt/Ru催化剂的催化活性强弱与其组成、结构、形态、粒度和合金化有关。研究表明[23-24],纳米颗粒铂电极,由于其大的比表面积和明确的周期性纳米结构,在给定条件下,可以提供对甲醇氧化的高活性和对毒物的耐受性。催化剂的表面几何形状和化学性质在对小有机分子电氧化的催化活性和对吸附的CO中毒的耐受性中起着重要作用。因此,表面改性成为提高催化剂电化学性能的有效途径[25-28]。如Kang等[29]研究发现,甲酸氧化反应在通过欠电位沉积( underpotential deposition,UPD)方法制备的Bi改性Pt阳极催化剂上快速进行。Du等[30]还报道了,在硫酸溶液中通过Ru或Bi的沉积而改性的Pt颗粒,对甲醇的氧化得到了增强。Pt/Ru催化剂在甲醇氧化中具有许多固有优势,Bi在碱性介质中对甲醇氧化具有促进作用。
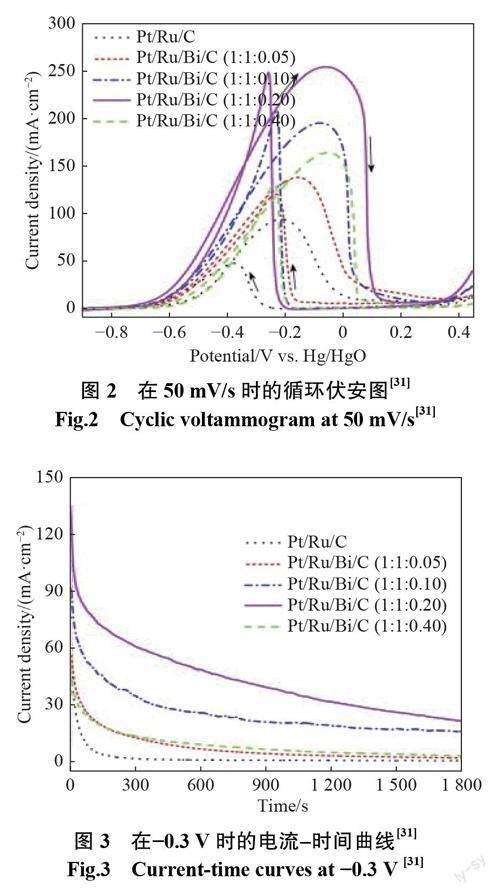
在Yi等[31]的研究中,通过简单混合市售Pt/Ru/C和Bi(N03)3制备了PURu/Bi/C催化剂。该催化剂对甲醇和乙醇氧化的电催化活性以及对CO中毒的耐受性都有着很大的提高。图2为在10个循环后的循环伏安(cyclic voltamogram,CV)测试,甲醇氧化发生在-0.6~0.15 V内(图上括号中的数字为元素Pt、Ru、Bi的物质的量比,C为负载体)。Bi引起的强烈表面氧化也发生在该电位范围内,研究发现催化剂表面上形成了大量活性氧物种。这些活性氧物种可以与强吸附物种(如低电位的CO)反应,并释放游离的Pt活性位点以进一步氧化甲醇。这种促进作用符合双功能方案,并且双功能机制似乎在促进Bi活化催化剂的甲醇氧化中发挥了重要作用。在甲醇电氧化过程中,OH在碱性介质中放电可产生活性氧物种[32]。这一结果表明,Pt/Ru颗粒表面的Bi部分对催化性能起决定性作用。Pt/Ru/Bi/C催化剂的最高电流密度为297.1 rriA/crri2,比Pt/Ru/C(112.2 mA/cm2)的高2.65倍。
图3是对各材料进行恒电位测试(图上括号中的数字为元素Pt、Ru、Bi的物质的量比,C为负载体)。所有催化剂的电流在约20 s的初始阶段快速下降,表明催化剂的催化活性快速衰减。这是由于类CO中间体在催化剂表面上的积聚。这些有毒物质占据了许多游离的Pt活性位点,阻止甲醇进一步吸附和氧化。随着时间的推移,电流缓慢下降,电极反应接近稳定状态。最终电流密度为Pt/Ru/C的小于Pt/Ru/Bi/C的,Bi的加入导致大量的含氧物质的产生,这可以将CO类中间体在催化剂表面上的强吸附降低到很低的水平。线性电流扫描用于进一步评估所制备的催化剂的抗中毒能力。如参考文献[33]所述,抗中毒能力较差的催化剂容易出现电势振荡。然而,该Pt/Ru/Bi/C催化剂上没有观察到电位振荡,这主要归因于Ru和Bi在碱性介质中提高抗中毒能力,并且Bi掺杂的双贵金属Pt/Ru催化剂对甲醇电催化氧化的电流密度明显增强。
3 Bi掺杂的非贵金属阳极催化剂电催化甲醇氧化
3.1 Bi掺杂的Mn双金属电催化剂
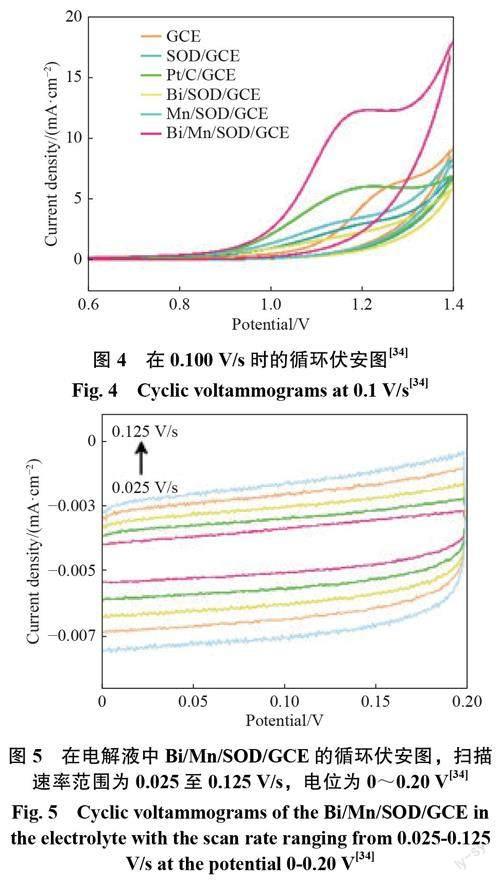
贵金属催化剂因为其高昂的生产成本,以及较差的CO耐受性限制了其发展。最近越来越多的学者将目光转移到了非贵金属催化剂上。Wei等[34]利用分子筛刚性框架的限制和保护作用,合成了Bi/Mn纳米颗粒,这些纳米颗粒催化剂在电化学催化甲醇的过程中不会增长,因此不容易聚集和失去活性,副产物 CO 将通过分子筛的孔排出,不会聚集在催化剂表面导致失去活性。通过 Mn 和 Bi 的联合作用,复合电极在 MOR?中表现出高活性。如图 4 所示,Bi/Mn/SOD(SOD 是方钠石结构的沸石)修饰电极表现出良好的性能,在 0.5?mol/L 甲醇中的氧化峰电流密度为 12.40mA/cm2,而 Pt/C/GCE(GCE为玻碳电极 )表现出电流密度 为 5.990 mA/cm2,Mn/SOD/GCE 的电流密度为 3.574mA/cm2。可以看出,Bi/Mn/SOD 的催化氧化活性几乎是其他电极的 2~3 倍。这一结果表明,高度分散的 Mn 和 Bi 纳米颗粒对甲醇氧化都表现出优异的甲醇电催氧化的性能。图 5 描绘了当扫描速率从 0.025V/s 增加到0.125V/s 时,0 到 0.20V 范围内的 CV 扫描曲线。基于 Cdl(电化学双层电容) 和 CV 曲线,估算了 Bi/Mn/SOD/GCE 的电化学活性表面积,为 0.216cm2。图 6 显了 Bi/Mn/SOD 在 5 mol/L 甲醇浓度下的 CV 曲线。随着扫描速率的增加,甲醇氧化峰电流密度显著增加。扫描速率与电流密度成比例(R2=0.998),可以表明 Bi/Mn/SOD/GCE 的甲醇氧化过程是由吸附控制的。当甲醇浓度达到 15mol/L 时,依旧有着很高的电流密度,说明其有着较强的抗甲醇中毒的能力。
3.2 Bi掺杂的Ni双金属电催化剂
非贵金属催化剂中,镍基材料由于成本低、化学稳定性好以及在碱性介质中去除中间CO的能力强,被认为是MOR的一种很有前途的电催化剂。然而,与贵金属相比,镍基材料仍保持较低的催化性能。Gao等[17]通过溶胶一凝胶法合成了一系列Bi掺杂镍基材料,该材料比单纯的镍基材料的电流密度增长了30%。事实证明,Bi/Ni催化剂在MOR中表现出比Ni或氧化镍材料本身更好的催化性能。
在Qian等[16]的工作中,他们选择了具有阴离子骨架的LTA( Linde Type A沸石分子筛)结构分子筛作为载体和主体材料。在水热条件下,通过原位合成,将微量Bi离子和Ni离子高度分散在载体上。其对Ni、Bi的光电子能谱(X-ray photoelectronspectroscopy,XPS)进行研究发现,对于Bi元素,155.8 eV和161.2 eV处的特征峰可以被归属到4f轨道。被电化学还原后不能观察到162.4 eV处的峰。对于Ni元素,857.5 eV处的加宽峰被分裂并移动到854.leV和860.4 eV两处。854.1 eV和860.4 ev處的峰可以被归属到2p轨道。此外,在被电化学还原后,871.7 eV处的峰可归因于Ni 2p sat轨道。对比被电化学还原前后的结果,可以发现Bi和Ni的配位部分地受到电化学还原过程的影响。所有的Bi都被整合到4f轨道中,而Ni被整合到2p轨道中。一些Ni在被电化学还原后,发现其具有较低价态的原子态,这可能导致其具有较高的甲醇电催化氧化的活性。
3.3 Bi掺杂的Co双金属电催化剂
C0304作为MOR的一种有前途的阳极电催化剂已引起广泛关注[35-36]。根据之前的研究,Co和甲醇之间的特征化学吸附可导致活化能很低[37],因为Co具有未成对电子和空d轨道。此外,由于不同组分的协同效应,双组分过渡金属氧化物催化剂通常比单金属氧化物具有更好的电催化性能。原因是,催化剂表面的亲氧元素,包括Mo、Y和Bi,可以帮助解离/活化以产生更多的活性氧物种,从而通过亲氧和协同效应改善电催化性能。此外,在催化剂表面引入少量Bi可以改变催化剂表面的电子结构并产生更强的电子效应,从而提高催化活性和耐久性。
三维多孔纳米结构,特别是三维金属氧化物纳米材料( three-dimensional metal oxide nanomaterials.3D MON),已经受到了极大的关注,并在电催化中显示出巨大的应用前景。在Zhao等[38]的工作中,通过控制Bi的量和煅烧温度,制备了一系列由低维金属氧化物纳米颗粒组成的絮凝结构。如图7扫描电子显微镜( scanning electron mlcroscope,SEM)图所示,Bi0.13C02.8704显示了具有延伸纳米链的3D多孔网络。图8透射电子显微镜( transmission electronmlcroscope,TEM)图显示3D多孔结构由低维纳米颗粒组成。这种类型的电催化剂具有连续多孔网络结构的特征,不仅保留了金属氧化物的独特化学性质,还表现出优异的物理性质,包括低密度、高孔隙率和高比表面积,这有利于提高电催化MOR的性能。
4 Bi化合物作为阳极催化剂光辅助
电催化甲醇氧化
4.1 贵金属掺杂Bi203阳极催化剂光电催化甲醇
氧化
光催化辅助电催化,可以大大地提高甲醇的氧化效率。太阳能的利用效率主要取决于光吸附、光生电荷分离/转移和表面反应的效率,而表面反应又主要依赖于光催化剂。理论上,价带能量比MOR的能斯特电势更正的半导体都有可能氧化甲醇。TiO2,是在甲醇的光催化电氧化中报道的第一种半导体[39],与在黑暗中相比,在紫外光下Pt/Ru/TiO2上的MOR电流增加了1.93倍。具有窄带隙( 2.4-- 2.5 eV)的铋基材料作为新浸入式水分解光催化剂也有望用于MOR。铋基半导体,如BiOBr、BiO1和Bi2O3,在与Pt结合后已被研制为光电催化剂,显示出很有希望的醇氧化活性。Wu等[40]使用简单的湿化学法使得Pt/Bi纳米颗粒均匀地分布在石墨烯的表面,并且含有少量的Bi203,该材料对MOR和氧还原反应(oxygen reduction reaction,ORR)表现出优异的电催化性能。该复合材料由于光敏物质( Bi2O3)的存在而在模拟阳光照射下对MOR和ORR的催化具有电光协同催化作用,该光敏物质收集模拟阳光以帮助电催化剂将化学能转化为电能。
Wang等[41]通过在碱性溶液中照射Pt/BiV04就可以原位生成Pt/BiVO4/Bi2O3异质结构。原位生成的 Pt/BiVO4/Bi2O3 异质结构对于光生电荷分离和转移效率很高,因此在辐照下显示出对 MOR 优异的电催化活性。Pt/BiVO4/Bi2O3 异质结构上 MOR的光催化机制,包括光/电催化耦合机制和提出的MOR 途径,如图 9 所示。在辐照下,光生电子在内置电化学电势和偏置电势的驱动下从?Bi2O3 的 导带(conductionband,CB) 转移到 BiVO4 的 CB,然后通过 Pt 转移到外部电路。如图 10 所示,在 Pt 纳米颗粒上,BiVO4/Bi2O3 异质结表面生成的光生空穴捕获溶液中 OH?产生了 OHad,促进了甲醇依次脱氢 。通过与溶液中 的 OH? 反应 ,生成 的 CO2 以CO32 或?HCO3 的形式存在。这样,通过电催化和光催化的耦合,甲醇被高效地转化。
4.2 贵金属掺杂Bi2WO6阳极催化剂光电催化甲醇氧化
MOR的阳极材料应使用具有强氧化能力的光催化剂作为基材。Bi2W06半导体在光电催化领域受到越来越多的关注,Bi2WO6 是一种可见光驱动的光催化剂,窄带隙为 2.70eV[42-43]。由于 Bi2WO6中独特的层状结构,O2p 和 Bi6s 能级可以形成大量扩散的混合价带。这有利于空穴的迁移和氧化反应的进行。然而,由于光生电荷载流子寿命短,纯Bi2WO6 的 光 催 化 活 性 相 对 较 低 。 提 高 Bi2WO6的催化性能 ,关键是减缓电子和空穴的复合 。Zhang 等[44] 报道了 Pt 纳米颗粒可以通过光沉积方法牢固地固定在 Bi2WO6 异质结构上。Pt 的修饰有效地拓宽了 Bi2WO6 的可见光响应,并抑制了光生电子–空穴对的复合。Pt 和 Bi2WO6 之间的协同应导致最佳的光降解效率。
Zheng等[45]通过光沉积法将铂颗粒加载到Bi2W06纳米板上,并通过浸渍涂覆法将光敏化碳量子点( carbon quantum dots,CQD)涂覆在其上面,成功制备了光电催剂Pt-Bi2W06/FTO(FTO为掺杂氟的SnO2导电玻璃)和CQDs-Pt-Bi2W06,并研究了甲醇氧化的性能。结果表明该催化剂由于在太阳光照射下光催化和电催化过程之间的特殊协同效应,甲醇氧化的光电催化性能更高。图II所示,当电极被太阳光照射时,在光催化剂Bi2WO6中获得光生电子(e-)和空穴(h+)。Bi2WO6价带中产生的空穴( h+)将迁移到Pt颗粒,然后甲醇在Pt颗粒和Bi2WO6纳米板上光电催化氧化产生CO2和H2O2
5 结论
低成本、高活性的阳极电催化剂的开发对于促进DFMC的发展具有重要意义。研究方向主要集中在两个方面,一是降低贵金属催化剂的使用成本,二是保证其电催化效率。本文简要介紹了DMFC的工作原理,以及Bi基金属材料阳极催化剂的研究进展。总结了现在商业应用最广泛的Pt阳极催化剂的优缺点及目前待解决的问题。介绍了Bi掺杂贵金属与非贵金属以及Bi2O3.Bi2WO6阳极催化剂材料。这些材料可以在光辅助下进行甲醇的电催化氧化,成功地将太阳能转化为电能,极大地提高了甲醇的转换效率。这很符合21世纪低碳环保的能源理念,现如今人们对光辅助电催化甲醇氧化的研究还不够深入,Bi203.Bi2W06阳极催化剂材料依旧需要进行Pt贵金属的掺杂,生产成本较高。将来如果能够生产出无贵金属掺杂的Bi2O3 .Bi2WO6催化剂材料,降低生产成本,该材料将会实现大范围的工业化生产。
参考文献:
[1] ATAEE-ESFAHANI H,WANG L,YAMAUCHI YBlock copolymer assisted synthesis of bimetallic colloidswith Au core and nanodendritic Pt shell[Jl. ChemicalCommunications. 2010. 46(21):3684-3686
[2]KANNINEN P,KALLIO T.Activation of commercialPt/C catalyst toward glucose electro-oxidation byirreversible Bi adsorption[J] Joumal of EnergyChemistry, 2018. 27(5): 1446-1452
[3]LEE K Y,LEE Y W. KIM T H,et al Formation of Bi-containing sea urchin-like Pt nanoparticles induced bythe addition of bismuth element and their enhancedelectrocatalytic properties for methanol oxidation[J]Materials Chemistry and Physics. 2019. 235: 121758.
[4] YANG Y F,YIN H M. HE M F,et al In-situsynthesizing and optimizing the surface structure ofnanoporous PtBi electrocatalysts for formic acid electro-oxidation[Jl. ChemistrySelect, 2017. 2(4): 1671-1674.
[5] ZHOU L N,ZHANG X T,WANG Z H,et al.Cubicsuperstructures composed of PtPd alloy nanocubes andtheir enhanced electrocatalysis for methanol oxidation[J]Chemical Communications. 2016. 52(86): 1273 7-12740
[6]MA Y G,BALBUENA P B Pt surface segregation inbimetallic Pt3M alloys: a density functional theorystudy[J] Surface Science. 2008. 602(1): 107-1 13
[7]CHEN Q S,ZHOU Z Y,VIDAL-IGLESIAS F J,et alSignificantlyenhancingcatalyticactivityoftetrahexahedral Pt nanocrystals by Bi adatomdecoration[J] . Journal of the American Chemical Society,2011. 133(33): 12930-12933.
[8] ABREGO-MARTiNEZ J C. WANG Y L. MORENO-ZURIA A. et al. Nanostructured Mn203/Pt/CNTsselective electrode for oxygen reduction reaction andmethanol tolerance in mixed-reactant membranelessmicro-DMFC[J]. Electrochimica Acta. 2019. 297:230-239.
[9] ATAR N. EREN T. YOLA M L. et al. Magnetic ironoxide and iron oxide@gold nanoparticle anchorednitrogen and sulfur-functionalized reduced grapheneoxide electrocatalyst for methanol oxidation[J]. RSCAdvances. 2015. 5(33): 26402-26409.
[10] WOO S. LEE J. PARK S K. et al. Enhancedelectrocatalysis of PtRu onto graphene separated byVulcan carbon spacer[J]. Journal of Power Sources.2013. 222: 261-266.
[11] BELTRAN-GASTELUM M. SALAZAR-GASTELUMM I. FLORES-HERNANDEZ J R. et al. Pt-Aunanoparticles on graphene for oxygen reduction reaction:stability and performance on proton exchange membranefuel celI[J] . Energy, 2019, 181: 1225-1234.
[12] MESA C A. KAFIZAS A. FRANCaS L. et al. Kineticsof photoelectrochemical oxidation of methanol onhematite photoanodes[J]. Journal of the AmericanChemical Society, 2017, 139(33): 11537-11543 .
[13]LIU W. ZHOU J B. ZHOU J. Facile fabrication of multi-walled carbon nanotubes (MWCNTsya-Bi203nanosheets composite with enhanced photocatalyticactivity for doxycycline degradation under visible lightirradiation[J]. Journal of Materials Science. 2019, 54(4):3294-3308.
[14]ZHANG H M. HE J. ZHAI C Y. et al. 2D Bi2W06/MoS2as a new photo-activated carrier for boostingelectrocatalytic methanol oxidation with visible lightillumination[J]. Chinese Chemical Letters. 2019, 30(12):2338-2342.
[15] TONG Y Y. YAN X. LIANG J. et al. Metal-basedelectrocatalysts for methanol electro-oxidation: progress,opportunities. and challenges[J]. Small. 2021, 17(9):1904126.
[16] QIAN K. FANG F. E Y F. et al. Bimetallic Bi and Nidoped LTA zeolite as synergy electrocatalyst towardshigh concentration of methanol oxidation reaction[J].International Joumal of Hydrogen Energy, 2023, 48(19):6995-7003.
[17]GAO P Y. GU Y Y. LI P H. et al. Promoting effect of Biin Ni-Bi oxide electrocatalysts for methanol oxidationreaction[J]. Joumal of Materials Science:Materials inElectronics. 2020. 3 1( 16) : 13219-13228.
[18] YANG M L. Catalytic activities of PtBi nanoparticlestoward methanol electrooxidation in acid and alkalinemedia[J] . Journal of Power Sources. 2013. 229: 42-47.
[19] LIAO H B. ZHU J H. HOU Y L. Synthesis andelectrocatalytic properties of PtBi nanoplatelets and PdBinanowires[J] . Nanoscale. 2014, 6(2) : 1049-1055 .
[20] FIGUEIREDO M C. MELANDER M. SOLLA-GULLON J. et al. Bismuth and CO coadsorption onplatinum nanoparticles[J]. The Joumal of PhysicalChemistry C, 2014. 118(40): 23100-23110.
[21] LI W. GAN M. MA L. et al. Fe-doped hollow PtBinanocages loaded on Bi202C03-NC composite supportwith excellent methanol electrooxidation performance[J] .Materials Today Chemistry, 2022, 26: 101212.
[22] LI Z S. XU S H. XIE Y X. et al. Promotional effects oftrace Bi on its highly catalytic activity for methanoloxidation of hollow Pt/graphene catalyst[J].Electrochimica Acta. 2018, 264: 53-60.
[23] JAMIL R. SOHAIL M. BAIG N, et al. Synthesis ofhollow Pt-Ni nanoboxes for highly efficient methanoloxidation[J] . Scientific Reports, 2019, 9( 1): 15273 .
[24] EL SAWY E N. BIRSS V I. NanoengineeredIrcore@PtsheU nanoparticles with controlled Pt shellcoverages for direct methanol electro-oxidation[J]. ACSApplied Materials & Interfaces. 2018. 10(4): 3459-3469.
[25] SIMOES M. BARANTON S. COUTANCEAU C.Enhancement of catalytic properties for glycerolelectrooxidation on Pt and Pd nanoparticles induced byBi surface modification[J]. Applied CatalysisB:Environmental. 201 1. 1 10: 40-49.
[26] PAUTIENIENEV.TAMASAUSKAITE-TAMASIUNAITE L. SUDAVICIUS A. et al.Spontaneous Bi-modification of polycrystalline Ptelectrode: fabrication. characterization, and performancein formic acid electrooxidation[J]. Journal of Solid StateElectrochemistry, 2010, 14(9): 1675-1680.
[27] KIM J. RHEE C K. Ensemble size estimation in formicacidoxidationonBi-modifiedPt(lll)[J].Electrochemistry Communications.2010.12( 12):1731-1733.
[28] ZHENG Q W, FAN C J. ZHEN C H. et al. Irreversibleadsorption of Sn adatoms on basal planes of Pt singlecrystal and its impact on electrooxidation of ethanoI[J].Electrochimica Acta. 2008. 53(2 1) : 6081-6088.
[29] KANG S. LEE J. LEE J K. et al. Influence of Bimodification of Pt anode catalyst in direct formic acidfuel cells[J] . The Journal of Physical Chemistry B, 2006,110(14): 7270-7274.
[30] DU Y L. WANG C M. Preparation Ru. Bi monolayermodified Pt nanoparticles as the anode catalyst formethanol oxidation[J]. Materials Chemistry and Physics,2009. 113(2/3): 927-932.
[31]HUANG Y Y.CAI J D. GUO Y L. Facile synthesis of aBi-modified PtRu catalyst for methanol and ethanolelectro-oxidation in alkaline medium[J]. InternationalJournal of Hydrogen Energy, 2013, 38( 8) : 3250-3256.
[32] JIANG L. HSU A. CHU D. et al. Ethanol electro-oxidation on Pt/C and PtSn/C catalysts in alkaline andacid solutions[J]. International Joumal of HydrogenEnergy, 2010, 35(1): 365-372.
[33] HUANG Y Y.CAI J D, GUO Y L. Roles of Pb andMnOx in PtPb/MnOr_CNTs catalyst for methanolelectro-oxidation[J]. International Journal of HydrogenEnergy, 2012, 37(2): 1263-1271.
[34] WEI P Y. E Y F. JIANG Y Y. et al. Bi-Mn diatomicmteraction on SOD zeolite substrate promoteselectrochemicalmethanoloxidation [J] .ScriptaMaterialia. 2022. 218: 114840.
[35]WU J B. LI Z G. HUANG X H. et al. Porous C0304/Ni0core/shell nanowire array with enhanced catalyticactivity for methanol electro-oxidation[J]. Journal ofPower Sources. 2013. 224: 1-5.
[36] KHALAFALLAH D. ALOTHMAN O Y. FOUAD H. etal. Hierarchical C0304 decorated PPy nanocasting core-shell nanospheres as a high performance electrocatalystsfor methanol oxidation[J]. International Journal ofHydrogen Energy, 2018, 43(5): 2742-2753 .
[37] CAO Y M. GE J M. JIANG M H. et al. Acid-etchedC0304 nanoparticles on nickel foam: the highly reactive(311) facet and enriched defects for boosting methanoloxidation electrocatalysis[J]. ACS Applied Materials &Interfaces. 2021. 13(25): 29491-29499.
[38] ZHAO F Y. ZHU B C. LI S. et al. Bismuth-dopedcobaltosic oxide as a noble-metal free electrocatalyst forthe efficient methanol oxidation reaction[J]. Journal ofthe Taiwan Institute of Chemical Engineers, 2022. 131:104182.
[39DREWK,GIRISHKUMARG,VINODGOPALK,etal.Boosting fuel cell performance with a semiconductorphotocatalyst: TiO2/PtRu hybrid catalyst for methanoloxidation[J]. TheJournalofPhysicalChemistryB,2005,109(24):11851–11857.
[40]WUYL,DUANXY,LIZS,etal.ThemodificationofPt/graphenecompositeswithoxophilicmetalBi(Bi2O3)and Its dual-functional electro-photo catalyticperformance[J]. Catalysts,2018,8(10):465.
[41]WANG G, XIE X M, CUI X J, et al. PhotoinducedPt/BiVO4/Bi2O3 heterostructures for methanol oxidationandnewinsightsonthephoto-/electrocatalysiscouplingmechanism[J]. ACS Sustainable Chemistry &Engineering,2021,9(11):4271–4281.
[42] GEL,HANCC,LIUJ.Novelvisiblelight-inducedg C3N4/Bi2WO6 composite photocatalysts for efficientdegradation of methyl orange[J]. Applied Catalysis B:Environmental,2011,108–109:100–107.
[43]KONGXY,TANWL,NGBJ,etal.HarnessingVis NIR broad spectrum for photocatalytic CO2 reductionover carbon quantum dots-decorated ultrathin Bi2WO6nanosheets[J]. NanoResearch,2017,10(5):1720–1731.
[44]GAO H F, ZHAI C Y, FU N Q, et al. Synthesis of Ptnanoparticles supported on a novel 2D bismuthtungstate/lanthanum titanate heterojunction forphotoelectrocatalyticoxidationofmethanol[J]. JournalofColloidandInterfaceScience,2020,561:338–347.
[45]ZHENG H J, NIU P, ZHAO Z F. Carbon quantum dotsensitized Pt@Bi2WO6/FTO electrodes for enhancedphotoelectro-catalytic activity of methanol oxidation[J].RSCAdvances,2017,7(43):26943–26951.
