醇化烟叶附生产蛋白酶细菌分离筛选及活性评估
2023-05-30梁伟刘鸿邹克兴陈义昌王小东孙会忠蔡联合苏赞胡逸超
梁伟 刘鸿 邹克兴 陈义昌 王小东 孙会忠 蔡联合 苏赞 胡逸超

摘要 本文以醇化烟叶为材料,采用平板分离技术分离培养出26株细菌活体纯培养物,依次编号为GXZY1~GXZY26,纯化菌株通过牛奶琼脂培养基的鉴别培养,初筛出GXZY3、GXZY7和GXZY9 3株具有明显的水解圈,初步定性为产蛋白酶功能细菌。对GXZY3、GXZY7和GXZY9菌株连续60 h的连续发酵实验,发现3株菌发酵液中的蛋白酶活性均呈现先高后低的变化规律,酶活性的最大值均出现在发酵后18 h;GXZY9菌株发酵液中的酶活性持续保持高位,最大值达到18.2 U/g,且酶活性下降幅度最小,而GXZY3和GXZY7则在发酵36 h后持续下降到较低水平。对菌株GXZY13的多相鉴定结果表明,其隶属于芽孢杆菌属(Bacillus),命名为Bacillus subtilis GXZY9。菌株GXZY9对烤烟蛋白质含量具有较强的调控功能,可作为烟叶醇化微生物制剂开发的良好备用菌株。
关键词 烟叶醇化;附生菌;蛋白酶;筛选
中图分类号 S47 文献标识码 A
文章编号 1007-7731(2023)03-0021-05
Isolation, Screening and Activity Evaluation of Protease Producing
Bacteria from Alcoholized Tobacco Leaves
LIANG Wei1 LIU Hong1 ZOU Kexing1 CHEN Yichang1 WANG Xiaodong2 SUN Huizhong2
CAI Lianhe1 SU Zan1 HU Yichao1
(1Technical Center of Guangxi China Tobacco Industry Co., Ltd., Nanning Guangxi 530000;
2College of Agriculture, Henan University of Science and Technology, Luoyang Henan 471023)
Abstract Twenty-six strains of pure bacteria in vivo were isolated and cultured from alcoholized tobacco leaf by plate separation technology, which were numbered GXZY1-GXZY26. The purified strains were identified by milk AGAR medium and GXZY3, GXZY7 and GXZY9 had obvious hydrolytic circles, and were preliminarily identified as protease-producing functional bacteria. The protease activity of GXZY3, GXZY7 and GXZY9 strains in the fermentation broth of GXZY3, GXZY7 and GXZY9 strains increased at first and then decreased, and the maximum value of enzyme activity occurred at 18 h after fermentation. The enzyme activity in the fermentation broth of GXZY9 strain remained high, reaching the maximum value of 18.2 U/g, and the enzyme activity decreased the least, while the enzyme activity of GXZY3 and GXZY7 continued to decrease to a low level after 36 h of fermentation. Polyphase identification of strain GXZY13 showed that it belonged to Bacillus subtilis GXZY9. Strain GXZY9 had strong regulation function on protein content of flue-cured tobacco and could be used as a good standby strain for the development of tobacco mellow microbial preparation.
Keywords tobacco mellow; pick the fungus; protease; screening
煙叶醇化是卷烟生产过程中的重要一环,与卷烟风格和特色形成关系密切,其核心原理是通过醇化可以消除烟叶天然存在的刺激性大、青杂气重、烟气粗糙、余味涩口、香气显露不足的品质缺陷[1-3]。大量研究证明[2-5],烟叶醇化是一个极其复杂的过程,醇化风格和特色的形成受多种因素的影响,醇化过程中烟叶化学成分和其他物理化学特征的分化和定型,对微生物及其产生的酶发挥了极其关键的作用,主要是因为微生物不仅可以通过自身的生命活动作用于烟叶醇化过程,还可通过其代谢产生的生物酶参与烟叶的生理生化反应,促进烟叶中生物大分子的转化,同时微生物因素对烤烟醇化周期也有深刻影响。影响烤烟醇化的微生物酶也是一个复杂的体系,多酚氧化酶(polyphenol oxidase)、蛋白酶(protease)、淀粉酶(amylase)、蔗糖酶(sucrase)、纤维素酶(cellulase)等均参与其中[6-8]。蛋白质含量过高的烟叶在燃烧吸食时会有较为强烈的烧焦羽毛臭味,而且烟叶的燃烧性也相应变差,故蛋白质含量是烟叶品质和吸食者健康评价的重要影响因素,因而蛋白质含量调控就成了烟叶醇化工艺和技术的重要组成部分,微生物降解蛋白质含量的机理是将大分子蛋白质降解为氨基酸等小分子物质,从而降低烟叶蛋白质含量,但不同的烟叶品种、存储条件和工艺类型,调控醇化烟叶蛋白质含量的功能微生物种类也存在差异。
在此背景下,本文结合广西中烟工业有限责任公司卷烟生产过程中醇化周期偏长的实际现状,着眼特定卷烟生产原料,开展了醇化烟叶附生益生菌的分离、筛选、鉴定和活性评估等研究工作,以期为烟叶醇化提供更加具有针对性的益生菌遗传资源。
1 材料与方法
1.1 材料
烟叶样品于2022年2月取自广西中烟工业有限责任公司烟叶仓库,烟叶品种是K326。枯草芽孢杆菌标准株(Bacillus subtilis ATCC 6633)由河南科技大学农学院特色生物资源开发与利用试验室保藏。
1.2 培养基
烟叶水浸提物固体分离培养基:20 g烟叶样品加入400 mL蒸馏水煮沸提取30 min,冷却后2层纱布过滤得烟叶沸水浸提液。以分别添加10%、30%和50%的水浸提液代替 LB培养基成分,制备烟叶浸提物培养基(30%烟叶水浸提液固体培养基成分及配制:300 mL烟叶水浸提液,700 mL蒸馏水,牛肉膏0.3 g,蛋白胨1.0 g,NaCl 0.5 g,琼脂1.5 g,pH 自然,120 ℃高压蒸汽灭菌30 min)。
牛奶琼脂鉴别培养基:牛肉膏3 g,蛋白胨5 g,NaCl 5 g,脱脂奶粉15 g,琼脂粉20 g,蒸馏水1 000 mL,pH 7.0。
发酵培养基:1 000 mL蒸馏水,葡萄糖20 g,醇化烟叶粉碎样品(37 ℃烘干6 h,过40目筛)10 g。
LB培养基:胰蛋白胨7 g,酵母提取物3 g,NaCl 5 g,琼脂 20 g,pH自然。
1.3 醇化烟叶附生细菌的分离纯化
取醇化烟叶粉碎样品(过40目筛)5 g装入灭菌三角瓶,加入100 mL无菌水,震荡5 min,静置5 min后,分别取50、100、150 ?L不同体积上清液涂布于固体分离培养基,每个体积涂6个平板,28 ℃恒温培养48 h后,挑取菌落连续进行3次平板划线纯化,并将纯化菌株甘油-20 ℃保存。
1.4 纯化菌株产蛋白酶活性初筛
将纯化菌株接种于牛奶琼脂鉴别培养基,28 ℃恒温培养48 h,具有透明圈者定性为具有产蛋白酶活性目标菌株。
1.5 纯化菌株产蛋白酶活性复筛
首先将目标待测菌株进行活化培养(OD600 控制在 0.8~1.2),以2%接种量接种于发酵培养基,28 ℃、180 r/min摇床连续培养60 h,期间每隔6 h取样1次,测定发酵液蛋白酶活力。设3次重复,以不接种作为对照。蛋白酶活力采用文献方法进行[9-10]。
1.6 菌株的多相分类鉴定
将测定菌株于LB培养基培养48 h,制样进行光镜和扫描电镜观察[11]。生理生化指标的测定方法参考文献[12-13]进行。
测定菌株16S rDNA分析操作方法参考文献进行,采用MEGA7的Neighbor-Joining法构建进化树[14-15]。
2 结果与分析
2.1 醇化烟叶附生细菌分离结果
醇化烟叶粉碎样品稀释涂布烟叶水浸提物固体分离培养基平板中,28 ℃培养2~3 d后,平板上形成特征典型的菌落(图1)。挑取菌落进行3次划线纯化,共获得26株细菌活体纯培养物,依次编号为GXZY1~GXZY26。15 %甘油-20 ℃保种备用。
2.2 产蛋白酶活性菌株初筛
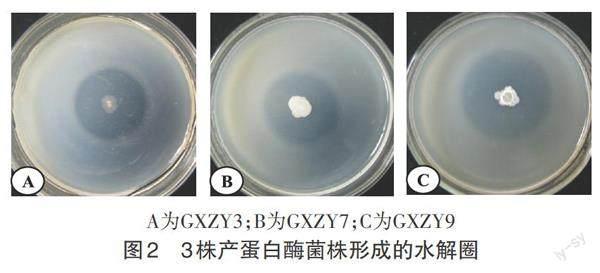
分别将获得的31株纯化菌株点接于牛奶琼脂鉴别培养基平板,28 ℃培养2~3 d。结果表明,共有3株菌形成了明显的水解圈,分别是GXZY3、GXZY7和GXZY9(图2),其中GXZY9的抑菌圈直径最大,达到24 mm,初步将其定性为具有生防活性功能菌株。
2.3 产蛋白酶活性菌株发酵液酶活性
如图3所示,GXZY3、GXZY7和GXZY9 3株菌经过连续60 h的发酵,发酵液中的蛋白酶活性与对照相比存在显著变化,总体而言,3株菌均呈现先高后低的变化规律,酶活性的最大值均出现在发酵18 h时间节点;3株菌相比较而言,GXZY9菌株发酵液中酶活性最大,为18.2 U/g,且酶活性下降幅度最小,酶活性维持高位的时间最长,GXZY3和GXZY7则在发酵36 h后持续下降。以上结果说明3株产蛋白菌株对蛋白质存在不同的调节能力,可作为后期烟叶醇化调控剂开发功能菌株选择的依据。
2.4 产蛋白酶菌株GXZY9的鉴定
选取在发酵过程中酶活性下降幅度最小的GXZY9进行多相分类学鉴定。结果显示,形态特征:将菌株GXZY9在LB培养基形成的菌落观察可见,菌落表面粗糙,有皱褶,不透明,微黄,无荚膜,有鞭毛(图4A);革兰氏阳性,芽孢(0.5~0.8)μm×(1~1.4)μm,位于菌体中央或稍偏(图4B);大小为(0.5~0.7)μm×(1.5~2.5)μm(图4C)。
根据形态特征推测GXZY9可能为枯草芽孢杆菌,故拟以枯草芽孢杆菌标准菌株为参比菌株,对GXZY9菌株进行部分生理生化特征测定,测定项目及结果见表1。根据《常见细菌系统鉴定手册》和《Bergey,s Manual of Systematic Bacteriology》(第九版)对枯草芽孢杆菌的描述[16],GXZY9菌株与标准株基本吻合,为GXZY9菌株的系统归属提供了证据支撑。
对菌株GXZY9的16S rDNA分子鉴定表明:菌株GXZY9的16S rDNA基因扩增产物测序结果为1 514 bp,序列提交GenBank获得登录号OL913106。在GenBank比对获得同源性较高序列并构建进化树(图4)。结果表明,菌株GXZY9与Bacillus subtilis JCL16聚为一支,相似度达到99%。结合菌株GXZY9的形态、生理生化和分子鉴定结果,将其鉴定为芽孢桿菌属(Bacillus)菌株,暂命名为Bacillus subtilis GXZY9。
3 讨论
烟叶醇化过程是一个复杂的生化变化过程,尤其是有机大分子化合物在微生物繁殖和生理代谢过程中发生的降解和含量上的消长[1,2,5,17]。本研究采用改良的牛肉膏蛋白胨细菌分离培养基从醇化烟叶中分离得到26株附生细菌活体纯培养物,醇化烟叶上有细菌的滋生,如果不断优化和改变分离培养基类型,分离到更多种类的附生细菌是可能的。
本研究以获取烟叶醇化菌株为主要目的,根据烟叶醇化过程中微生物种群数量由高到低的一般规律,选取了醇化6个月的仓储醇化烟叶材料作为分离附生菌的实验材料,为了增加分离可培养细菌的检出概率,采用了烟叶浸提物改良分离培养基,这对经过高温烘烤的醇化烟叶实验材料是有益的,文献报道显示,烤烟附生菌种群的绝多数量与土壤、水体等环境的微生物种群多样性相比相差甚远[2,4,5,18]。
本研究筛选出的3株产蛋白酶菌株在烟叶发酵过程中均表现出一定的蛋白酶活性,说明烟叶发酵过程中蛋白质转化相对活跃,相比较而言GXZY9菌株的蛋白酶活性高位活性持续时间最长,后期下降幅度小,说明对发酵体系中具有更强的调控能力,开发应用潜力也最大。
GXZY9菌株经过形态特征、生理生化特征和16S rDNA序列分析的多相分类鉴定,确定为芽孢杆菌属的枯草芽孢杆菌(Bacillus subtilis)。按照国家农业行业标准NY1109—2006微生物菌种安全四级管理,枯草芽孢杆菌属于第一级免做毒理学试验菌种,可直接投入使用,这有利于GXZY9菌株的快速开发应用[19]。
4 参考文献
[1] 吴光丽,孙玮宏,董高峰,等. 云南复烤烟叶不同地点醇化过程中可培养真菌种群分析[J]. 中国烟草科学,2018,39(3):66-71.
[2] 张亚恒,王芳,张庆明,等. 微生物在烟叶醇化和再造烟叶生产中的应用进展[J]. 湖北农业科学,2015,54(18):4390-4393.
[3] 李秀妮,李猛,万德建,等. 烟叶微生物及其在烟叶发酵和醇化中的作用研究进展[J]. 微生物学通报,2019,46(6):1520?1529.
[4] 汪长国,李宁,寇明钰,等. 复烤烟叶异地醇化过程中生物活性的变化[J]. 中国农业大学学报,2013,18(2):105-109.
[5] 浦绍占,马永凯,刘敏,等. 玉溪地区自然陈化烟叶表面可培养细菌多样性研究[J]. 中国微生态学杂志,2016,28(8):920-925.
[6] 颜克亮,武怡,曾晓鹰,等. 复合酶产生菌的筛选及其在烟叶醇化中的应用[J]. 工业微生物,2012,42(2):11-17.
[7] 朱大恒,陈锐,陈再根,等. 烤烟自然醇化与人工发酵过程中微生物变化及其与酶活性关系的研究[J]. 中国烟草学报,2001,7(2):26-20.
[8] 颜克亮,武怡,曾晓鹰,等. 复合酶产生菌的筛选及其在烟叶醇化中的应用[J]. 工业微生物,2012,42(2):11-17.
[9] 李力,刘冬梅,罗淑萍,等. 高淀粉酶蛋白酶活力枯草芽孢杆菌菌株的筛选及鉴定[J]. 渔业现代化,2008,35(2):15-18.
[10] 蒋咏梅. 微生物育种学实验[M]. 北京:科学出版社,2012.
[11] 谢家仪,董光军,刘振英. 扫描电镜的微生物样品制备方法[J]. 电子显微学报,2005,24(4):440.
[12] 杜连祥,路富平. 微生物学实验技术[M]. 北京:中国轻工业出版社,2010.
[13] 徐丽华,娄恺,张华,等. 微生物资源学(第二版)[M]. 北京:科学出版社,2010.
[14] 范俐. 微生物学基础与实验技术[M]. 北京:科学出版社,2009.
[15] 东秀珠,蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社,2001.
[16] HOLT J G,KRIEG NR.Bergey′s Manual of Systematic Bacteriology(9th ed.)[M]. Baltimore London:Williams &Wilkins Co.,1994.
[17] 杨金奎,段焰青,陈春梅,等. 醇化烟叶表面可培养微生物的鉴定和系统发育分析[J]. 烟草科技,2008(11):51-55.
[18] 陈泽斌,夏振远,雷丽萍,等. 烟草内生细菌种群特征分析[J]. 中国烟草学报,2014,20(3):102-107.
[19] 李博文,刘文菊,张丽娟. 微生物肥料研发与应用[M]. 北京:中国农业出版社,2016.
(责编:王 菁)
基金项目 广西中烟工业有限责任公司科技计划项目(功能微生物提升真龙卷烟原料醇化质量技术研究,GXZYCX2021B002)。
作者简介 梁伟(1979—),男,河南辉县人,硕士,高级农艺師,从事烟草原料应用研究工作。
收稿日期 2022-04-26
