林奇综合征的筛查和诊治研究进展*
2023-05-29高显华赵子夜刘连杰白辰光颜宏利张卫
高显华,赵子夜,刘连杰,白辰光,颜宏利,张卫
1 海军军医大学第一附属医院(上海长海医院)肛肠外科 上海 200433
2 海军军医大学第一附属医院(上海长海医院)遗传性结直肠癌筛查防治中心和遗传性肿瘤家庭阻断中心 上海 200433
3 海军军医大学第一附属医院(上海长海医院)病理科 上海 200433
4 海军军医大学第一附属医院(上海长海医院)生殖医学中心 上海 200433
1 概述
林奇综合征(Lynch syndrome,LS)是由于错配修复(mismatch repair,MMR)基因(MLH1、MSH2、MSH6、PMS2)和EPCAM基因胚系突变引起的一种高度外显性的遗传性癌症综合征[1]。LS是一种常染色体显性遗传疾病,占所有结直肠癌(colorec⁃tal cancer,CRC)的3%~5%,是最常见的遗传性结直肠癌综合征。在2010年之前,临床曾使用“遗传性非息肉病性结直肠癌(hereditary non-polyposis colorectal cancer,HNPCC)”这一名称命名LS,以区别于家族性腺瘤性息肉病(familial adenomatous polyposis,FAP)。然而,HNPCC 一词并不准确,因为LS 患者不仅容易患CRC,还容易患其他多种肿瘤。另外,部分LS 患者也有伴发结肠息肉,所以“非息肉病”一词也不准确。在2010年之后,国际上统一不再使用HNPCC这一名称。LS患者发生多个系统肿瘤的风险显著升高[2],包括消化系统肿瘤(CRC、胃癌、小肠癌和胰腺癌)、生殖系统肿瘤【子宫内膜癌(endometrial cancer,EC)和卵巢癌】、泌尿系统肿瘤(肾盂癌、输尿管癌、膀胱癌和前列腺癌)、神经系统肿瘤和皮肤肿瘤(皮脂腺癌和角化棘皮瘤)等[3]。LS 患者不仅容易发生多种肿瘤,而且发病年龄更年轻。不同基因突变引起的LS,其肿瘤风险也不一样[4]。LS的筛查比较复杂,涉及多个步骤和多种方法,LS 的诊断、治疗和预防都有很多独特之处。本文将从LS的分子遗传学基础、临床表现、筛查、诊断、治疗、预后、随访监测、预防和遗传学阻断等各个方面的最新进展作一简要综述。
2 LS的分子遗传学基础
LS 是由于MMR 基因的致病性胚系突变而引起的。MMR基因是一个参与DNA复制时错配修复的基因家族。与LS 有关的MMR 基因有MLH1、MSH2、MSH6和PMS2。MLH1、MSH2、MSH6 和PMS2 这四个蛋白是两两配对发挥作用,MLH1和PMS2配对,MSH2和MSH6配对。只有配对之后,蛋白才能稳定地存在,并发挥生物学功能。当一个基因突变时,不仅可以引起自身蛋白的表达缺失,还可引起配对蛋白的表达缺失。例如,MLH1的突变可以引起MLH1和PMS2 的表达缺失,MSH2的突变可以引起MSH2 和MSH6 的表达缺失。但是,MSH6的突变一般只引起MSH6的表达缺失,PMS2的突变一般只引起PMS2的表达缺失[5]。MSH2—MSH6(MutSα)形成的复合物识别并结合到单个错配的核苷酸碱基对,以及小的插入缺失异常位点,随后第二个异二聚体复合物MLH1—PMS2(MutLα)与MutSα 结合,并募集核酸外切酶-1,触发对错配DNA附近新合成DNA的长补丁切除修复。DNA 修复蛋白可以从DNA 中快速释放出来,重新正确地合成所切除的DNA片段。MMR活性的丧失导致基因突变的快速累积和超突变,并最终引起致癌的基因突变[4]。
MLH1和MSH2是引起LS最常见的突变基因,约各占30%。MSH6和PMS2很少,约各占5%。但是,据统计MSH6和PMS2基因胚系突变在普通人群中的患病率比MLH1和MSH2基因高。MSH6和PMS2基因突变的外显率低和肿瘤发病年龄晚,使得许多MSH6和PMS2突变的家庭成员不符合临床诊断的标准。一项来自冰岛的基于人群的研究发现,MMR 基因致病性胚系突变的患病率为0.442%,即每225 个普通人群中就有1 个人有MMR 基因的致病性突变[6],MSH6和PMS2的突变占90%以上。来自美国、加拿大和澳大利亚的其他基于人群的研究显示,MMR 基因胚系突变中MSH6和PMS2突变的总人群患病率为1/279,远高于MLH1和MSH2[7]。
另外,EPCAM基因突变也可引起MSH2启动子甲基化,从而引起MSH2蛋白的表达缺失,进而引起LS。还有10%~30%的LS致病基因不明[1,4]。
3 LS的临床表现
LS 是由于MMR 基因的致病性胚系突变引起的,此类患者患CRC 和其他多种肿瘤的风险增加,包括EC、卵巢癌、胃癌、小肠癌、胆管癌、尿路上皮癌、脑肿瘤及皮脂肿瘤。随着对LS疾病谱研究的逐步深入,发现不同患者的肿瘤发病年龄差异很大,肿瘤类型也多种多样[8]。这些差异一方面可能是由于基因型和表型的差异引起的,可能还与外显率和表现度差异有关。不同MMR基因突变引起的LS,患者的肿瘤风险存在差异。即使是同一个基因同一个位点的变异,不同患者的肿瘤风险也存在较大差异,这可能与种族、地理位置、个人特征、生活方式和其他遗传变量的差异有关。另外,环境因素、饮食因素和生活习惯可能也会改变LS 患者的肿瘤风险[4,9]。目前已确定多种环境因素可能会影响LS 患者的CRC 风险,包括体质量指数、吸烟、饮酒、阿司匹林和布洛芬的摄入量、糖尿病、胆固醇升高、饮食和体力活动[10-12]。不同MMR 基因突变引起的LS 患者发生各种肿瘤的风险和平均发病年龄详见表1。由于LS 患者发生CRC 和EC 的概率较高,而乳腺癌和LS 之间的关系尚未证实。下文重点讨论这3 类肿瘤。LS 相关的其他肿瘤发病率低,临床意义有限,所以不逐一讨论。
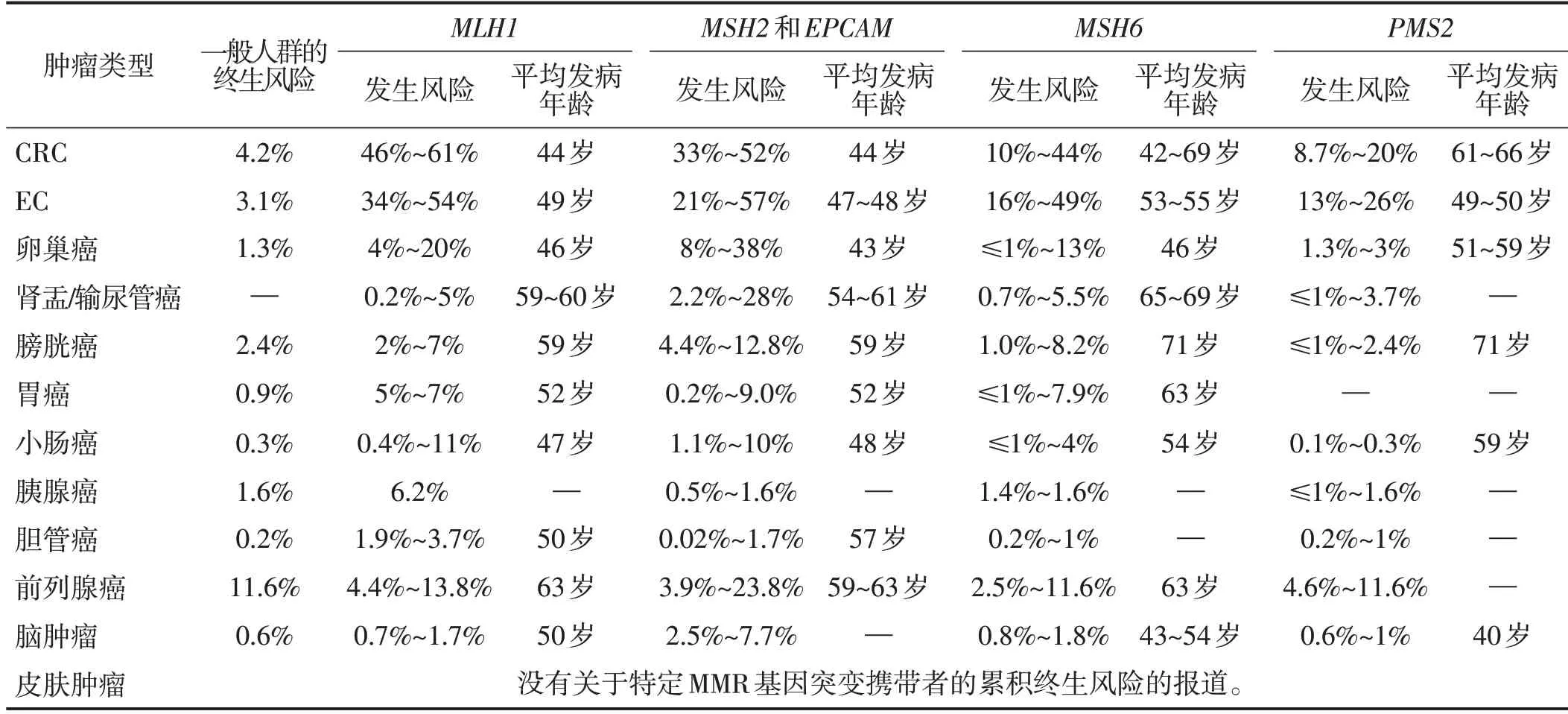
表1 不同MMR基因突变引起的LS患者和普通人群80岁之前发生各种肿瘤的风险对比[3]
3.1 CRC
MLH1和MSH2基因突变携带者患CRC 的风险显著高于MSH6和PMS2基因突变携带者。EPCAM基因3’端缺失突变的LS 患者的临床表现和MSH2突变的LS患者相似。LS相关CRC的组织学特征:组织学分化差、淋巴细胞浸润肿瘤、黏液腺癌、印戒细胞癌或筛孔状组织学特征。但是此类CRC 患者的预后好于散发性CRC[4]。
3.2 EC
LS 的女性患EC 的终生风险为13%~57%,是LS中第二常见的肿瘤。在患有CRC 和EC 的LS 女性中,约50%首先患有EC。首次发生CRC的LS女性之后再患EC 的风险,在首次诊断CRC 之后的10年内约为26%。LS 约占所有EC 的2%。在LS 相关的EC中也观察到了类似于LS相关CRC的生存优势[4]。
3.3 乳腺癌
虽然研究发现女性LS患者的乳腺癌有42%~51%是错配修复缺陷(deficient mismatch repair,dMMR),且表达缺失的蛋白与突变的MMR基因相对应[13],但没有足够的数据支持女性LS 患者患乳腺癌的风险增加[14-15]。由于一般人群中乳腺癌的发病率高,散发性乳腺癌的存在使得乳腺癌与LS的关联分析复杂化。目前尚不清楚,LS 是否会导致乳腺癌的风险增加。因此,乳腺癌没有被写入LS的肿瘤风险表中。乳腺癌的风险管理应基于其个人史和家族史[3]。
4 筛查
4.1 基于肿瘤家族史的LS筛查标准
LS 患者容易患多种肿瘤,危害大,而且临床表现复杂多样,诊断困难,漏诊率高。为了将LS筛选出来,国内外的学者们先后提出了多个筛查标准,包括阿姆斯特丹Ⅰ(Amsterdam Ⅰ)标准[16]、阿姆斯特丹Ⅱ标准、贝塞斯达(Bethesda)标准[17]和修订版的贝塞斯达标准[18]。这4 个标准都不是LS 的诊断标准,只是LS的筛查标准,都是用于筛选哪些CRC患者需行dMMR 或微卫星不稳定性(microsatellite in⁃stability,MSI)检测,然后决定是否需要进一步行LS 的其他相关检测。其中,阿姆斯特丹Ⅰ标准的敏感性最低,特异性最高;修订版的贝塞斯达标准的敏感性最高(72%),特异性最低[1]。
4.2 LS的预测模型
由于上述各筛查标准都不够完美,敏感性和特异性还达不到理想的要求。于是,又有学者提出了用数学模型来预测LS 的风险。目前常用的LS 预测模型有以下3 个:(1)PREMM5 预测模型(http://premm.dfci.harvard.edu/);(2)MMRpredict 预测模型(http://hnpccpredict.hgu.mrc.ac.uk/);(3)MMRpro 预测模型(http://www4.utsouthwestern.edu/breasthealth/cagene/)。这3 个预测模型均为网络在线版,通过登录相应的网站,按照提示输入各个危险因素,即可得出患LS 的概率。当预测LS 的风险大于5%时,则需进一步检查[1]。据报道,PREMM5预测模型筛查LS的漏诊率为12.5%[19]。预测模型应用的前提是要准确地收集各种危险因素和家族史,而在繁忙的临床实践中往往很难做到[1]。
4.3 通过对肿瘤行dMMR或者MSI检测进行LS的普查
由于上述4 个LS 的筛查标准都有较高的漏诊率;而预测模型虽然漏诊率较低,但是要耗费临床医师大量的时间来收集病史,临床上很难实施。所以,NCCN 指南从2015年开始推荐通过肿瘤筛查进行LS 的普查,即所有初次诊断的CRC 都要行dMMR或者MSI 检测。目前,多个权威国际组织(NCCN、ASCO 和ACG)建议对所有初诊的CRC 进行LS 的普查。由于70 岁以上的CRC 患者dMMR 和高度微卫星不稳定(MSI-H)的特异性不强,所以又有学者提出了修正版的普查方案,即只对≤70 岁的CRC 患者和大于70岁且符合修订版的贝塞斯达标准的CRC患者行dMMR和MSI检测[1]。
EC作为LS患者中的第二大肿瘤,目前也推荐常规对所有EC 患者行dMMR 或MSI 检测来筛查LS[20-21]。除了CRC 和EC,还有学者研究了在其他肿瘤中进行MSI 检测筛查LS 的可行性。他们分析了超过50 种肿瘤的15 045 例患者,研究结果发现,在16.3%(53/326)、1.9%(13/699)和0.3%(37/14 020)的MSI-H、低度微卫星不稳定(MSI-L)和微卫星稳定(MSS)患者中发现了LS(P<0.001)。在患有MSI肿瘤的LS 患者中,50%(33/66)患有CRC 和EC 以外的肿瘤。在这些肿瘤患者中,45%(15/33)不符合那些基于个人史或家族史的LS 筛查标准。因此,除了CRC和EC,其他MSI-H/dMMR的肿瘤也可用于筛查LS。有学者建议所有MSI-H/dMMR 肿瘤,无论肿瘤类型或家族肿瘤史如何,都要进行LS相关基因的胚系突变检测,以免漏诊LS[22-23]。
MSI和dMMR这两种筛查方法各有优缺点,可以相互补充。dMMR 检测费用低、对检测设备的要求低,便于在基层医院开展,而且可以提示发生突变的MMR 基因,成为LS 筛查的首选[5]。但是,免疫组化(IHC)受组织固定、抗体质量、染色技术和免疫组化读片质量的影响很大,应予以注意。此外,很多因素还会干扰IHC 结果的解读,这些因素包括肿瘤细胞的胞浆染色、内对照细胞染色弱、肿瘤细胞的异质性、特殊的病理形态表现(如,浸润肿瘤的淋巴细胞,印戒细胞癌)、新辅助放化疗等。注意避免IHC 结果解读的各种陷阱,对于准确识别LS 至关重要[24]。同时,由于LS 的各种筛查方案均存在一定的漏诊率,所以应综合应用筛查标准、dMMR、MSI、BRAF V600E突变、MLH1启动子甲基化和基因的胚系突变检测,以便对LS做出准确的诊断[24]。
4.4 对所有CRC 通过MMR 基因的胚系突变检测进行LS的普查
为了掌握LS的真实患病率,有学者进行了一项Meta分析,共纳入来自18个国家51项研究中的49 557例CRC患者,发现CRC中LS的总患病率为2.2%,而且不同种族、地域和临床人群的LS 患病率非常相似。对所有CRC患者进行MMR基因的胚系突变检测的研究报告了更高的LS 患病率(5.1%),年轻的和符合LS 筛查标准的CRC 患者的LS 患病率更高。因此,作者推荐对所有CRC患者进行LS相关基因的胚系突变筛查[25]。随着二代测序(NGS)基因检测费用的不断下降,这一方案的优越性逐渐显现。由于NGS 一次可以检测多个基因,除了LS 相关基因,还可以同时检测遗传性结直肠癌综合征的相关基因突变。但是,也存在较多的缺点,如需要更多的检测前和检测后的遗传咨询,可能会检出大量临床意义不明的基因突变。
4.5 对普通人群通过MMR基因的胚系突变检测进行LS的普查
由于LS患者的外显率不是100%,因此很多尚未发生肿瘤的LS患者无法通过上述方法筛查出来。据估计,在西方普通人群中,LS 的患病率在1∶2 000和1∶370 之间[25]。因此,又有学者提出,对所有普通人群进行LS 相关基因的胚系突变筛查。随着NGS的普及,以及基因检测费用的不断下降,这个建议的可行性也在逐渐提高。有学者还分析了对美国30岁的普通人群进行基因组合筛查的成本效益,发现每增加一个质量调整生命年的成本为15 万美元,尚不具有成本效益。如果基因检测成本进一步降低,并在基因检测组合套餐中加入更多的基因,可能会使得这一方案更具成本效益[26]。但是,这将会对全球有限的医疗资源带来更大的负担,因此这一筛查方案的实施要非常谨慎。
5 LS的诊断
5.1 LS的一般诊断流程
当临床遇到一个初诊的CRC 患者时,首先要评估他的个人史和家族史,判断他是否符合LS的各种筛查标准。如果符合某个LS的筛查标准,则需要进一步行dMMR 或者MSI 检测。当检测结果为dMMR/MSI-H,则需要行基因的胚系突变检测。如果是MLH1 蛋白的表达缺失或者MSI-H,还需要行MLH1的启动子甲基化检测或者BRAF V600E突变检测,以便排除MLH1甲基化引起的MLH1蛋白表达缺失;存在MLH1甲基化或BRAF V600E突变时基本上可以排除LS,可以判定是散发性癌,否则就要行基因的胚系突变检测。但是,由于dMMR 或MSI 检测的准确性也只有80%~90%;所以,对于发病年龄小于50岁和有CRC 家族史的患者,不论dMMR/MSI 筛查的结果如何,都需要行基因的胚系突变检测。只有找到了有临床意义的MMR 基因的胚系突变(致病性变异,或疑似致病性变异),才能确诊为LS(图1)[1]。
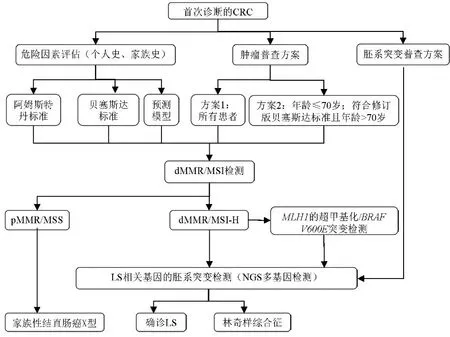
图1 LS的筛查诊断流程图
胚系突变检测的方法包括一代测序(Sanger法),NGS和多重连接探针扩增技术(MLPA)。一代测序由于一次只能检测一个基因,检测时间长,成本高,目前已很少应用。而NGS 由于检测成本低,而且一次能检测多个基因,近年来已经得到了广泛应用。但是NGS 只能检测点突变和小片段的突变。对于基因的大片段缺失或重组,需要采用MLPA才能检测出来,MLPA一次也只能检测一个基因,检测成本相对较高。由于LS的各种筛查和诊断方法的准确性都不是100%,因此需要综合应用各种筛查和检测方法,从而最大程度地降低LS的漏诊率。
5.2 家族性结直肠癌X 型(familial colorectal can⁃cer Type X,FCCX)
FCCX是指符合阿姆斯特丹Ⅰ标准,但是肿瘤筛查结果未检测到dMMR 和MSI-H 的患者[4,27-28]。约有50%的符合阿姆斯特丹Ⅰ标准的CRC 患者为FCCX。FCCX 是一大类异质性极大的疾病,病因尚不清楚。有些可能是其他基因引起的单基因病;有些可能是多基因病;也有些可能是由于相似的环境因素和生活方式引起的。
5.3 林奇样综合征(Lynch-like syndrome,LLS)
LLS 是指肿瘤筛查结果提示为MSI-H 或dMMR(若为MSI-H 或MLH1 表达缺失,还需排除MLH1的甲基化),但却未检测到相关MMR 基因的胚系突变的CRC 患者,大约占所有CRC 的2.5%[5,24,29]。LLS 对于LS 的诊断造成了很大的干扰。LLS 的可能病因[5]:基因的双重体细胞突变,约占所有LLS的50%;IHC结果的读片错误;胚系突变检测方法的缺陷;其他基因的胚系突变引起的MSI,如MUTYH的双等位基因突变[30]、体细胞镶嵌和MLH1组成性表观突变。因此,LLS是由多种原因引起,其中大部分与胚系突变和家族性肿瘤风险无关。分析清楚他们的原因,以免引起不必要的恐慌和进行不必要的随访监测。
6 治疗
当结肠镜检查没有发现CRC 时,不建议进行预防性结直肠手术。对于LS合并结肠癌的患者,可以考虑行节段性结肠切除术+每1~2年复查结肠镜,或者行次全结肠切除术。次全结肠切除术后,异时性大肠多原发癌的发生率显著下降,但是患者术后的生活质量较差,需要与患者及家属充分沟通后慎重选择。而对于LS合并直肠癌,可以考虑保留或不保留括约肌的全直肠系膜切除术。LS 患者CRC 均为dMMR,dMMR 的肿瘤对5-氟尿嘧啶(5-FU)类药物的效果较差。对于Ⅱ期CRC 术后的辅助化疗,不推荐行5-FU类药物的单药化疗,推荐行FOLFOX 或CAPOX方案的全身化疗。LS伴转移性CRC患者也可考虑行免疫治疗。
7 预后
与散发性CRC患者相比,LS相关性CRC的淋巴结转移率和远处转移率较低,而且生存期比相同分期的CRC 患者更长。这可能与dMMR 导致大量新抗原的产生有关,进而引起肿瘤浸润淋巴细胞密度的增加。
8 随访监测
LS 患者的一级亲属和二级亲属推荐行该突变基因的检测。如果亲属未发现该致病性突变,则按普通人群进行随访。如果亲属也有同样的突变,或者拒绝行基因检测,则建议按LS的推荐方案进行随访监测[31-32]。
8.1 CRC的监测
从20~25岁开始,每1~2年复查结肠镜。如果家族中有人发病年龄更早,建议从家族中CRC 的最早发病年龄提前5~10年开始行结肠镜检查。有证据表明PMS2或者MSH6突变携带者的外显率更低,发病年龄更晚,建议从30~35岁开始行结肠镜检查,每3年复查一次结肠镜[33]。然而,结肠镜检查并不能完全消除LS患者发生CRC的风险。据报道,LS监测中的10年CRC发生率为6%,高危个体为18%。这可能是由于一些结肠息肉被漏诊有关,特别是一些扁平的息肉和位于结肠黏膜皱襞深部的息肉。肠道准备情况,是否插镜至盲肠,退镜时间和腺瘤检出率是影响结肠镜检查质量的重要因素,对于未插镜至盲肠和肠道准备差的患者,要相应地调整复查结肠镜的间隔。因此,结肠镜检查的质量对于LS的随访监测非常重要[34]。有学者建议,在LS 的筛查中使用染色结肠镜(CE),它可能对检出扁平腺瘤特别有帮助。与普通的结直肠腺瘤相比,LS 的腺瘤更可能是扁平的(43%vs.17%),合并高级别上皮内瘤变的比例更高,近端结肠更多见(58%vs.16%)。提高结肠镜检查的质量,可以显著增加扁平腺瘤的检出率,进而降低LS 患者异时性大肠多原发癌的发生率[34]。尽管目前的多中心随机对照临床研究(RCT)未能证实CE 的意义[35],这可能与对照组医师高质量的内镜检查水平有关。对于水平较低的内镜医师,采用CE对LS 患者进行随访监测,也许可以降低LS 患者再发CRC的概率。
8.2 EC和卵巢癌的监测
建议从30~35 岁开始,每1~2年行子宫内膜活检、经阴道超声和血清CA125 检测;加强对LS 女性患者的教育,出现可疑症状及时检查;没有生育要求的女性患者,可考虑行子宫和双附件预防性切除术。
8.3 胃癌和小肠癌的监测
建议从30~35岁开始,每1~2年行胃十二指肠镜检查。
9 LS相关肿瘤的预防
环境因素和生活习惯也会影响LS 相关肿瘤的发生率和发病年龄。通过减少各种危险因素(如肥胖、高蛋白高脂肪低纤维素饮食、吸烟、过量饮酒、缺乏体力活动),也可降低LS 患者CRC 的发生率。根据一项为期10年的RCT研究(CAPP2),共纳入861 例LS 患者,发现每天服用600 mg 阿司匹林,持续至少2年,可显著降低CRC 风险(由13%下降至9%)。阿司匹林并不能预防其他LS 相关肿瘤,长期大剂量服用阿司匹林可能还会增加老年人群消化道出血的风险[36]。CAPP3 正在探索阿司匹林预防LS相关性CRC的最佳剂量[36]。
10 遗传学阻断
LS 患者如果找到了明确的致病性胚系基因突变,可以通过生殖医学的手段(如产前基因诊断,胚胎植入前基因检测+试管婴儿技术),彻底阻止这个疾病遗传给下一代,从而改变一个家族的命运。
11 展望
目前,国际上LS 的相关临床研究及基础研究较多,但是我国LS的筛查和防治工作起步较晚,近年来才开始进行相关的研究。如何将LS筛查出来,最大程度地降低LS的漏诊率,然后有针对性地进行治疗和预防,不同突变基因引起的LS该如何管理,这些都是亟需解决的问题。在我国LS风险个体中,讨论、推荐和接受遗传咨询和基因突变检测的比例非常低。为了改变这一现状,需要加强LS的相关宣传和教育,努力提高医护人员和患者的相关意识,深入开展LS的相关临床和基础研究,进而降低LS的发生率和减小危害。
利益冲突声明全体作者均声明不存在与本文相关的利益冲突。