RAI14 高表达促进前列腺癌骨转移并与不良预后相关
2023-05-28范辉阳赖义明周杰陈勇明唐晨李凌峰吴永鑫郭正辉
范辉阳,赖义明,周杰,陈勇明,唐晨,李凌峰,吴永鑫,郭正辉
世界范围内,前列腺癌发病率在男性所有恶性肿瘤中位居第二,在美国,前列腺癌(PC)发病率超过肺癌到了第一的位置,亚洲发病率远低于欧美,但是整体处于上升趋势[1]。世界卫生国际癌症研究机构(IARC)发布的2020 癌症数据显示男性癌症新发病例中前列腺癌占比14.1%,仅次于肺癌[1]。前列腺癌早期的治疗选择广泛,主要包括手术治疗、内分泌治疗、放疗和化疗,且预后较好(五年生存率接近100%)[2],前列腺癌晚期治疗选择少且效果差(五年生存率降至28%)[3-5]。对于晚期前列腺癌,其转移病例中,骨转移占比超过80%[6]。前列腺癌骨转移的过程涉及许多通路的调控及外部环境的改变,包括PTEN 通路,AKT 通路等,以及细胞外基质的反应性,肿瘤微环境,免疫微环境,肿瘤细胞代谢异常均与肿瘤的进展密切相关[7]。但是缺乏具体深入的相关研究,因此,进一步地探究前列腺癌骨转移的相关调控机制,可为临床上治疗前列腺癌提供新的理论依据。
RAI14 也称为NORPEG,RAI13,是一种新颖的蛋白质编码基因,包含6 个锚蛋白重复序列和2 个线圈螺旋结构域[8]。研究表明,RAI14 在许多人体组织中表达,其功能与细胞骨架密切相关。近年来,越来越多的研究发现RAI14 可以在多种恶性肿瘤中高表达,包括胃癌[9-11],肺癌[12],卵巢癌[13]和前列腺癌[14],与肿瘤的恶性进展呈正相关。在这些恶性肿瘤中RAI14 的高表达与肿瘤药物的耐药性反应以及肿瘤细胞的增殖和侵袭显著相关。
本研究拟通过生信分析,统计分析以及相关体外实验探究RAI14 在前列腺癌骨转移中的作用以及相关通路、机制,以期找到前列腺癌进展的作用因素以及潜在的治疗靶点。
1 方 法
1.1 前列腺癌组织芯片和组织标本获取
从中国西安艾丽娜生物科技有限公司购买含有192 例组织标本的组织芯片(#PR1921c),其中包含160 例前列腺癌和16 例癌旁标本。从中山大学肿瘤医院收集103 例从2000 年至2018 年的前列腺癌石蜡包埋的组织,所有组织都是经根治性前列腺切除术或者经尿道前列腺电切术获取并经两位病理科医师确认,患者组织的获取和使用均与患者签署知情同意书,并通过中山大学伦理委员会的审核通过。对患者随访的信息包括:年龄、Gleason 评分、肿瘤TNM 分期(按2014 年中国泌尿外科指南)、生存状态等,严格保护患者信息和隐私。
1.2 实时荧光定量聚合酶链式反应(qPCR)
结果计算:根据所获得目标基因和内参GAPDH 的荧光信号值达到设定的阈值时所经历的循环数(CT 值),根据公式2-[(实验组目的基因CT—实验组内参CT)-(对照组目的基因CT—对照组内参CT)]计算相对表达量。
本研究所使用引物序列如表1 所示(试剂盒#RR820A,Takara)。
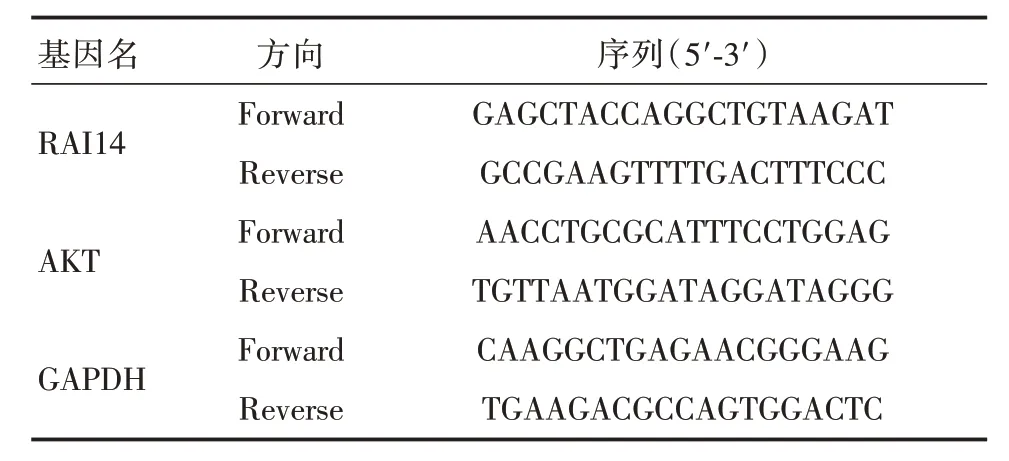
表1 本研究所使用引物序列
1.3 细胞小干扰RNA(siRNA)转染
实验所使用小干扰RNA 序列(siRNA)均购买于中国苏州泓迅公司。细胞密度在60%左右且贴壁良好,取2个1.5 mL离心管,A管加入5 μL siRNA(10 μmol/L)和95 μL 无血清培养基(optimen),B 管加入3 μL Lipofectamine RNAimax(13778150,Life Technologies,美国沃尔瑟姆)和97 μL optimen(31985-070,GIBCO);两者混合静置;将上述液体加入六孔板中,每孔加入800 μL optimen,继续培养48 h 提取RNA,用qRT-PCR 检测转染是否成功。(实验所用siRNA 序列:Si-RAI14-1:GAUGCCGUUACGGAAACAUTT;Si-RAI14-2:CACAAGAGAACAUCCCAGUTT;)
1.4 细胞迁移和侵袭实验
用无血清培养基润湿迁移小室(8 μm,353097,Falcon,中国上海)的基底膜,并将其置于有600 μL的完全培养基的专用24 孔板(3535040,Falcon)中;根据计数结果吸取DU145 4 万个细胞,PC3 6 万个细胞,用无血清培养基稀释成200 μL 加入迁移小室上;将培养板置于细胞培养箱中培养,DU145培养24 h 观察结果,PC3 培养48 h 后观察结果;使用4%多聚甲醛固定30 min;染色后进行观察计数
细胞侵袭实验步骤同上,不同点在于需要用基质胶(#354234,康宁,美国)包被迁移小室,步骤如下:将标准浓度8~11 mg/mL 的基质胶置于冰上融化,将标准基质胶加入预冷的无血清培养基稀释30 倍,将100 μL 稀释后的基质胶加入迁移小室里,将24 孔板放入37℃1 h。吸出培养板中残余液体即完成包被。
1.5 共培养实验
①处死八周龄裸鼠,取其肺及腿部长骨,碾磨至1 mm3大小;②使用24 孔板及相应小室,下层置入1 mL 已收集的碾磨好的肺、骨组织,上层置入20000 个用无血清培养基培养的DU145,PC3 细胞及敲低RAI14 后的DU145 及PC3 细胞;③培养48 h后取出小室,弃去上层培养液,放入提前准备好的24 孔板中,24 孔板内加入800 μL 多聚甲醛;④固定半小时后取出小室,放入提前准备好的24孔板中,24 孔板内加入800 μL;0.1%结晶紫;⑤染色半小时后取出小室,室温下风干后用显微镜观察记录。
1.6 蛋白质免疫印记(Western blot,WB)
配置SDS-PAGE 凝胶(#P0012A 碧云天):按说明书配制适量浓度的分离胶8 mL 和浓缩胶3 mL,蛋白样品电泳:将制胶玻璃板固定于电泳槽中,加入电泳液,开启电泳装置,待蛋白样品到达玻璃板底部时终止电泳。电转:,安装电转装置,倒入电转液,电转1.5~2 h。用封闭液(P0023B,碧云天)封闭PVDF 膜1 h;用一抗4℃孵育过夜。二抗室温慢速摇晃孵育1 h;接着用TBST 洗脱3 次,每次10 min。显影:将发光液滴加到PVDF 膜上并置于曝光机内进行曝光显影。本实验所用抗体如下:一抗为RAI14(Thermo Scientific 货号PA5-57887,1∶500)二抗为山羊抗兔(cw0103s)或者山羊抗鼠(cw0102s,1∶10,000,康为世纪)
1.7 统计分析
使用SPSS v.20.0(SPSS,Armonk,美国纽约)或GraphPad Prism 5.0(GraphPad,美国拉荷亚)软件进行统计分析。资料描述时:定量资料数据采用三次独立实验数据的均值±标准差表示,定性资料用每种分类的例数标书。统计分析时:两组独立样本间使用双边独立样本t检验;单因素多组定量资料使用单因素方差分析联合Dunnett′s 两两比较的方法;两因素的两组或多组定量资料使用析因分析进行比较;定量资料使用卡方检验进行比较。RAI14 与患者之间的采用Kaplan-Meier 生存分析,并且使用log-rank 检验进行分析。P值小于0.05 认为具有统计学差异。
2 结 果
2.1 通过前期研究及生信分析发现RAI14 与前列腺癌的进展密切相关
通过对各临床病理指标与前列腺癌组织中RAI14 的表达关系的探究,我们发现RAI14 在病理分期分级以及格里森评分较高的前列腺癌组织中表达明显上升,而与年龄、临床分期、人种等因素无明显关联,这提示我们RAI14 可能可以作为一个评判前列腺癌进展的优秀标记物,并且在各年龄段及各人种均适用(见表2)。

表2 各临床病理指标与前列腺癌组织中RAI14 的表达关系
我们对公共数据库中前列腺癌原位癌与癌旁组织、前列腺癌原位癌与前列腺癌骨转移灶、前列腺癌骨转移灶与癌旁组织的差异表达基因进行取交集(图1),发现RAI14、ZC3H15、LAMC1、THBS2、HOXC6、POSTN、LUM、COL4A1、PLOD2、NAA15 等基因在前列腺癌骨转移灶中表达量明显上升。而通过对上述基因进行生信分析及文献调研后,发现RAI14可能是调控的前列腺癌骨转移的基因之一。
2.2 体外实验证实RAI14 促进前列腺癌的骨转移
我们首先对RAI14 进行生存分析,发现低表达RAI14 的患者无病生存率更高(P=0.019)(图2A),之后我们对前列腺癌细胞系PC3,DU145 进行了RAI14的本底表达测量,发现RAI14在PC3及DU145中均高表达(图2B)。我们设计了5 个不同序列的小干扰RNA(siRNA)瞬时转染DU145 和PC3 两株前列腺癌细胞系。这些瞬转的细胞株都会通过qPCR 和Western blot 的方法验证敲低和过表达RAI14 的有效性,结果显示在DU145 和PC3 细胞系中,RAI14 的信使RNA(messenger RNA,mRNA)和蛋白水平明显下调(图2C)而我们最终选择了效率更高的si-1 以及si-2 进行后续的实验。随后我们进行了相关的功能实验。敲低RAI14 后的PC3,DU145 细胞系中进行迁移与侵袭实验,发现敲低RAI14 后,PC3,DU145 的迁移与侵袭能力均下降(P<0.01)(图2D,E)。随后我们将PC3,DU145 与肺,肝,骨的细胞培养上清进行共培养,观察不同组织对肿瘤细胞的趋化作用,我们发现敲低RAI14 后,肿瘤细胞对上清的趋化作用明显减弱(P<0.01)(图2F)。通过观察常见的骨转移灶-肝、肺、骨对前列腺癌肿瘤细胞的趋化作用,可以看出骨与肺对肿瘤细胞的趋化作用是明显更强的,在此基础上,我们进行了原代共培养,通过解剖小鼠,将其骨(Hfob1-19)与肺(Beas-2b)组织研磨至1 mm3大小置于下层,观察其对肿瘤细胞的趋化作用,发现敲低RAI14 后,肿瘤细胞的趋化作用减弱,且对骨的趋化作用的减弱明显多于对肺的趋化作用的减弱(见图2)。
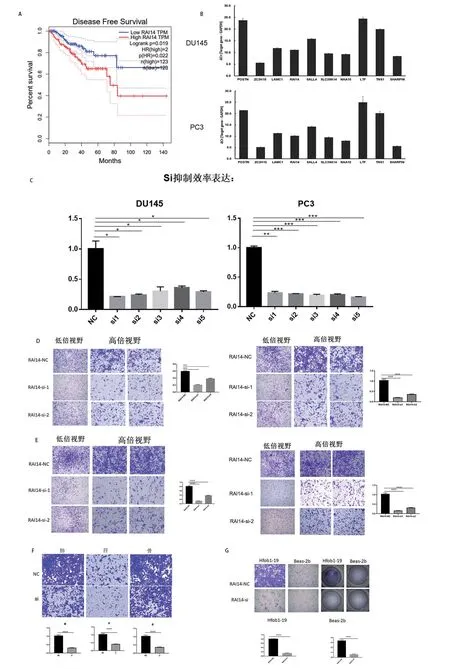
图2 体外实验证实RAI14 促进前列腺癌的骨转移
2.3 RAI14 可能通过激活AKT 通路发挥作用
通过体外功能实验证实了RAI14 对肿瘤细胞骨转移的促进功能后,我们进行了相关的文献检索,发现RA14 在其它癌症中可能通过AKT 信号通路促进肿瘤进展。我们敲低RAI14 后进行了全转录组测序,通路富集分析显示AKT 通路被过度激活,以及一些细胞外基质相关通路被激活。差异基因表达分析显示AKT 表达在敲低RAI14 后明显改变。(图3A、B)之后我们敲低RAI14 后进行WB实验,发现敲低RAI14 后,AKT 通路确实发生了改变,主要体现在AKT 蛋白表达量改变不明显,但是pAKT 的表达量明显下降。说明RAI14 通过促进AKT 的磷酸化导致AKT 通路的激活,进而发挥作用并调控前列腺癌的骨转移。(图3C)通过绘制ROC 曲线,可以发现以RAI14 作为前列腺癌的生物标记物的AUC 值大于0.5,对于预测及评估前列腺癌的进展有一定的价值。
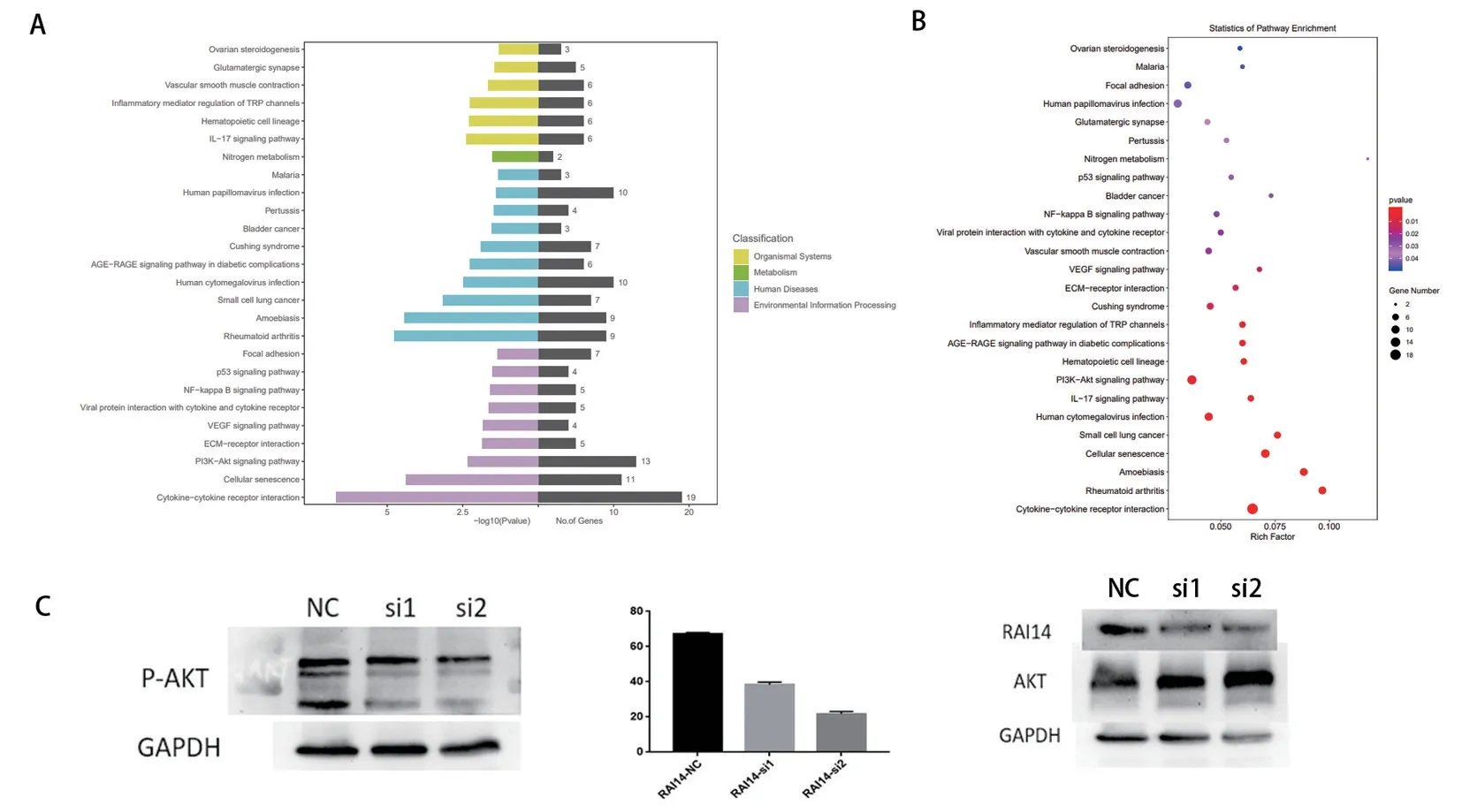
图3 RAI14 可能通过激活AKT 通路发挥作用
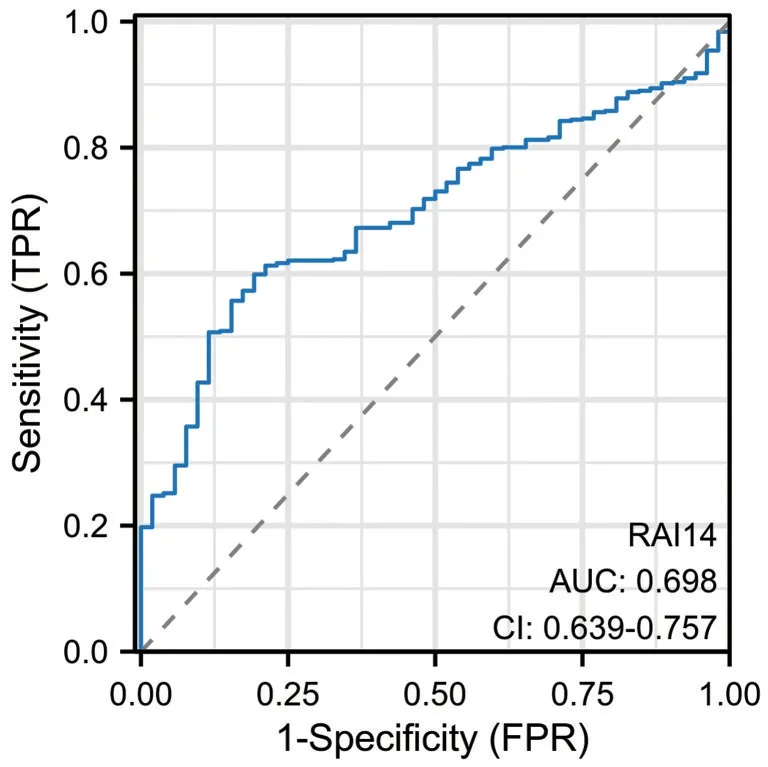
图4 ROC 曲线显示,以RAI14 作为前列腺癌的生物标记物的AUC 值大于0.5,对于预测及评估前列腺癌的进展有一定的价值
3 结 论
RAI14(维甲酸诱导基因14)是一种蛋白质编码基因。与RAI14 相关的疾病包括心肌病、婴儿组织细胞瘤和双胎输血综合征。既往研究显示在胞质特化(睾丸特有的一种细胞连接)的肌动蛋白调节中发挥作用。对建立精子极性和正常精子细胞粘附很重要。还可以促进血睾丸屏障处支持细胞紧密连接的完整性。RAI14 在体内主要通过影响细胞连接、黏附等功能来维持作用。在其他癌种研究中,有报道RAI14 可能通过AKT 通路影响肿瘤进展并推进骨转移的进程。AKT 通路在前列腺癌中过度激活可促进肿瘤生长及转移,诱导肿瘤耐药[15-17]。统计显示,42%的局限性前列腺癌患者存在AKT 信号通路改变,并且所有转移性前列腺癌患者中均可检测到AKT 通路有不同程度的激活[18-19]。我们敲低RAI14 后进行功能实验及WB实验,发现敲低RAI14 导致肿瘤转移能力降低,并且AKT 通路被过度激活。
我们通过对临床数据的分析,发现RAI14 在病理分期分级以及格里森评分较高的前列腺癌组织中表达明显上升,而与年龄、临床分期、人种等因素无明显关联,之后通过前列腺癌数据库的筛选,找出了与前列腺癌骨转移进程密切相关的RAI14。并且生信分析证明RAI14 与前列腺癌进展密切相关。我们的体外功能实验证实了RAI14调控前列腺癌肿瘤细胞的迁移侵袭能力,并且共培养实验结果提示我们RAI14 不仅影响着迁移侵袭,还对不同的组织有不同的趋化趋势,最后我们通过WB 实验初步探究了RAI14 的下游通路,发现下游的AKT 通路的磷酸化水平明显上升,结合文献调研中其他癌种的研究,我们考虑这可能是导致前列腺癌进一步的进展,推动骨转移的发生的重要途径。我们未来的工作将致力于继续探讨并验证RAI14 作用在AKT 的具体磷酸化位点以及构建相应的小鼠骨转移模型,并完善体内实验。
综上所述,本研究发现RAI14 可能通过磷酸化激活AKT 通路调控前列腺癌肿瘤细胞的迁移与侵袭能力,进而推动骨转移的发生发展。并且RAI14 本身有成为一个前列腺癌生物标记物的潜能。
