地高辛和欧夹竹桃苷抑制RNA病毒复制的功能研究
2023-05-27廖夏琳梁巍陈嘉雯刘坤鹏
廖夏琳?梁巍?陈嘉雯?刘坤鹏


【摘要】目的 研究强心苷类药物地高辛和欧夹竹桃苷的抗病毒能力。方法 采用人肺泡腺癌基底上皮细胞(A549细胞)和非洲绿猴肾细胞(vero细胞),利用细胞增殖-毒性检测试剂盒(CCK-8法)确定强心苷类药物地高辛和欧夹竹桃苷的细胞毒性,利用逆转录-实时荧光定量PCR(RT-qPCR)、蛋白免疫印迹法检测地高辛、欧夹竹桃苷对水疱性口炎病毒(VSV)和脑心肌炎病毒(EMCV)以及仙台病毒(SeV)和甲型流感病毒(H1N1)复制的影響。利用天然的IFN信号通路缺陷的vero细胞结合荧光显微技术、RT-qPCR、蛋白免疫印迹法分析地高辛、欧夹竹桃苷抗病毒的作用机制是否依赖IFN信号通路。在敲低钠钾腺苷三磷酸(ATP)酶α1亚基(ATP1A1-shRNA)的vero细胞中,通过RT-qPCR、蛋白免疫印迹法等检测细胞内病毒复制及细胞的抗病毒IFN反应。结果 地高辛和欧夹竹桃苷可抑制VSV、H1N1、SeV和EMCV基因表达;结合使用IFN缺陷的vero细胞证明地高辛和欧夹竹桃苷发挥抗病毒作用不依赖于IFN信号通路;在敲低ATP1A1的vero细胞中,地高辛和欧夹竹桃苷不再有明显的抗病毒作用。结论 地高辛、欧夹竹桃苷等强心苷类药物具有较广谱的抗病毒能力,主要通过抑制细胞膜内外钠/钾离子转运蛋白发挥抗病毒作用。
【关键词】地高辛;欧夹竹桃苷;抗病毒;先天免疫;钠钾腺苷三磷酸酶;水疱性口炎病毒;甲型流感病毒;呼吸道病毒;脑心肌炎病毒
Function of inhibition of RNA virus replication by digoxin and oleandrin Liao Xialin, Liang Wei, Chen Jiawen, Liu Kunpeng. Biotherapy Center, the Third Affiliated Hospital of Sun Yat-sen University, Guangzhou 510630, China
Corresponding author, Liu Kunpeng, E-mail: liukp5@mail.sysu.edu.cn
【Abstract】Objective To evaluate the antiviral ability of cardiac glycosides of digoxin and oleandrin. Methods Human adenocarcinoma alveolar basal epithelial cell line (A549) and African green monkey kidney cell line (vero) were used for subsequent experiment. The cytotoxicity of cardiac glycosides of digoxin and oleandrin was assessed by CCK-8 assay. The effects of digoxin and oleandrin on the replication of vesicular stomatitis virus (VSV), encephalomyocarditis virus (EMCV), Sendai virus (SeV) and influenza A virus (H1N1) were determined by reverse transcription-real-time quantitative PCR (RT-qPCR) and Western blot. Vero cells with natural interferon (IFN) signaling pathway defects combined with fluorescence microscopy, RT-qPCR and Western blot were employed to analyze whether the antiviral mechanism of digoxin and oleandrin depended on IFN signaling pathway. In vero cells with ATP1A1 (sodium potassium ATPase protein 1) (ATP1A1-shRNA) knockdown, intracellular virus replication and antiviral IFN response were detected by RT-qPCR and Western blot. Results Digoxin and oleandrin could inhibit the expression levels of VSV, H1N1, SeV and EMCV mRNA. The combination of IFN-deficient vero cells demonstrated that digoxin and oleandrin played an antiviral role independent of IFN signaling pathway. Meantime, digoxin and oleandrin exerted no antiviral effect in vero cells with ATP1A1 knockdown. Conclusion Digoxin, oleandrin and other potent cardiac glycosides have a broad spectrum of antiviral capability mainly through the inhibition of Na+/K+ ion transporters intra- and extra-cell membrane.
【Key words】Digoxin; Oleandrin; Antivirus; Innate immunity; Na+/K+-ATPase; Vesicular stomatitis virus; Influenza A virus; Respiratory virus; Encephalomyocarditis virus
目前已知强心苷是一类具有加强心肌收缩力、减慢心率作用的苷类有机化合物,其家族部分化合物常用于心力衰竭等慢性心功能不全的治療,包括地高辛、洋地黄毒苷等[1]。强心苷的作用机制主要是抑制钠离子/钾离子(Na+/K+)通道蛋白的活性,进而减少心肌细胞膜内外Na+/K+交换。细胞内Na+增多可激活心肌细胞钠离子/钙离子(Na+/Ca2+)交换系统,促使细胞内Na+外流同时促进Ca2+转移入细胞膜内[2]。心肌细胞内游离Ca2+浓度升高,能够增强心排出量、增加回心血量,缓解心力衰竭[3]。强心苷类药物在心血管系统的强心活性已广为人知,近年有研究显示强心苷类药物可以调节免疫系统,具有一定的抗肿瘤活性[4-5]。也有报道认为强心苷类化合物有抗病毒应用潜力[6]。在抗新型冠状病毒(新冠病毒)的药物筛选研究中,有学者发现欧夹竹桃苷等强心苷类药物有较强的抑制新冠病毒复制能力[7-8]。已知下调细胞中钠钾腺苷三磷酸(ATP)酶α1亚基(ATP1A1)蛋白表达对宿主细胞内的病毒复制有很强的抑制作用。但是强心苷类药物是否具有广谱的抗病毒能力,目前笔者尚未查及有相关的研究。本研究立足于探索强心苷类药物的抗RNA病毒复制能力,使用临床上最广泛使用的强心苷类药物地高辛和已知有一定抗病毒能力的欧夹竹桃苷处理经RNA病毒感染的细胞,检测细胞内病毒复制情况及细胞的抗病毒IFN反应,从而探讨地高辛和欧夹竹桃苷这两种强心苷药物的广谱抗RNA病毒活性,为强心苷类药物的抗病毒研究和应用提供科学依据。
材料与方法
一、细胞与病毒
所有实验均于本实验室(生物安全防护二级)中开展。人肺泡腺癌基底上皮细胞(A549细胞)和非洲绿猴肾细胞(vero细胞)购自美国模式菌种收集中心(ATCC),均采用富含10%胎牛血清(FBS)、1%双抗的高糖DMEM培养基,于
37 ℃、5%CO2细胞培养箱培养。ATP1A1蛋白敲低vero细胞(ATP1A1-shRNA vero)由本实验室构建(shRNA序列:5′-TACCGAGCTCGGATCCtctagtctccagcaacagga-3′),携带绿色荧光蛋白的水疱性口炎病毒(VSV-GFP)、水疱性口炎病毒(VSV)和脑心肌炎病毒(EMCV)以及仙台病毒(SeV)和甲型流感病毒(H1N1)由本实验室保存,病毒扩增后置于?80 ℃保存,病毒使用滴度即感染复数(MOI)值为0.1[9-10]。
二、主要试剂与仪器
地高辛、欧夹竹桃苷购自成都普思生物科技股份有限公司。Gibco DMEM高糖培养基,转染试剂Invitrogen Lipofectamine 3000购自美国Thermo Fisher Scientific公司。FBS购自美国PEAK公司;SYBR Green PCR Master Mix Kit购自Genstar公司;超敏化学发光底物(ECL)发光液购自美国Advansta公司;细胞增殖-毒性检测试剂盒(CCK-8法)购自美国APExBIO有限公司;山羊抗兔IgG-HRP抗体购自美国CST公司;VSV-G抗体购自美国Abcam公司;β-actin抗体购自美国Santa Cruz公司。
LC480荧光定量PCR仪为瑞士Roche公司产品;Proflex 96型PCR仪为美国Thermo Scientific公司产品;Biofuge pico 17微量离心机为美国Thermo Scientific公司产品;Eclipse Ti2-U型荧光倒置显微镜为日本Nikon公司产品;SW-CJ-1F超净工作台为上海安泰分析仪器有限公司产品;PowerPac型基础电泳仪为美国Bio-Rad公司产品;1285 Series A2 型生物安全柜为美国Thermo Scientific Forma公司产品。
三、方 法
1. 药物制备
地高辛10 mg直接加入0.256 mL的二甲基亚砜(DMSO)溶液,振荡至澄清状态,即为
50 mmol/L母液,分装后储存于?80 ℃备用。欧夹竹桃苷10 mg直接加入0.346 mL的DMSO水溶液,然后充分振荡至液面完全澄清,即为50 mmol/L母液,分装后储存于?80 ℃处备用。
2. 细胞活力检测
采用CCK-8法,于96孔板中每孔细胞按照1.5×104密度接种,放置于培养箱中至完全贴壁;将地高辛、欧夹竹桃苷母液(50 mmol/L)用DMEM高糖培养基稀释至相应摩尔浓度(0、1、10、25、50 ?mol/L),按照每孔100 ?L溶液体积缓慢加入细胞中,每组设3个复孔,培养24 h后吸弃上清,再往每孔中加入配好的CCK-8混合溶液,孵育1.5 h,待培养基变至橙黄色,立即用酶标仪检测450 nm处光密度(OD)值,细胞存活率(%)=[(OD实验组?OD空白组) /(OD对照组?OD空白组)]×100%。
3.逆转录-实时荧光定量PCR(RT-qPCR)
于6孔板中,以每孔约1.2×106的密度接种A549细胞或vero细胞,至细胞完全贴壁后,再以MOI为0.01的VSV病毒、H1N1病毒、SeV病毒、EMCV病毒等分别对细胞进行感染,设对照组、病毒模型组、1 ?mol/L地高辛组、10 ?mol/L地高辛组、1 ?mol/L欧夹竹桃苷组和10 ?mol/L欧夹竹桃苷组(在检测ATP1A1-shRNA vero细胞中VSV-GFP病毒复制的影响时,增设DMSO组),共孵育24 h后,然后在每孔中添加500 ?L的TRIzol 试剂以收集细胞,再进行RNA提取,根据试剂盒说明书进行逆转录,RT-qPCR分析:采用SYBR Green PCR Master Mix Kit反应体系,数据归一化为18S基因,并根据2-ΔΔCt法计算出mRNA相对表达量。扩增引物序列见表1。
4.蛋白免疫印迹法
于24孔板中以每孔2.4×105密度接种A549细胞,过夜培养后以MOI为0.005的VSV病毒感染A549细胞24 h,同时加入1、10 ?mol/L的地高辛或欧夹竹桃苷共同培养,同时设置对照组和病毒模型组。共孵育24 h后收集样品,使用BCA法进行细胞蛋白定量,然后进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)。经过湿法转膜、5%脱脂牛奶封闭后,与稀释好的一抗于4 ℃孵育过夜,次日取出用TBST缓冲液洗3次,再与山羊抗兔二抗(1∶5 000)室温下孵育1 h,最后显影观测目的条带的变化趋势。
5.免疫荧光检测
细胞按前述方法设组,经药物和病毒处理到达收样时间后,用4%多聚甲醛固定15 min,磷酸盐缓冲液清洗2次,置于倒置荧光显微镜下,使用明场视野拍摄细胞图像(曝光时间15 ms,10倍镜)。使用395 nm激发光波长激发荧光,曝光时间200 ms,10倍物镜下检测细胞内荧光。
四、统计学处理
使用GraphPad Prism 5.0软件进行统计分析。正态分布的计量资料采用 表示,2组间比较采用t检验,多组比较使用单因素方差分析,两两比较采用LSD-t检验。P < 0.05为差异有统计学意义。
结果
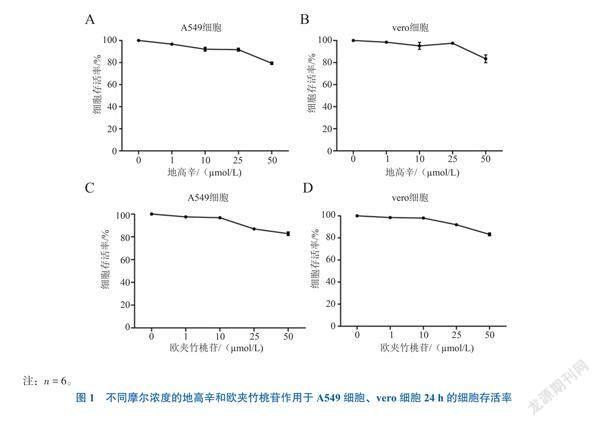
一、地高辛和欧夹竹桃苷对A549细胞、vero细胞无毒浓度的确定
地高辛和欧夹竹桃苷在最高摩尔浓度为
50 ?mol/L时,细胞存活率仍达到80%左右,见图1。后续选取两种药物对细胞无明显细胞毒性的低浓度1 ?mol/L、中浓度10 ?mol/L进行研究。
二、地高辛和欧夹竹桃苷对A549细胞中VSV、H1N1、SeV和EMCV 病毒复制的影响
免疫荧光结果显示,与对照组比较,病毒模型组GFP阳性细胞比例较高;与病毒模型组比较,1、10 ?mol/L的地高辛组和欧夹竹桃苷组中的GFP阳性细胞比例较低,见图2A。RT-qPCR结果显示,6组的VSV mRNA相对表达量比较差异有统计学意义(F = 1 670.000,P < 0.001),病毒模型组VSV mRNA表达较高(P < 0.001);地高辛组和欧夹竹桃苷组VSV mRNA相对表达量较低(P < 0.001),且10 ?mol/L 地高辛组和欧夹竹桃苷组抑制效果明显(P < 0.001),见图2B。蛋白免疫印迹法结果显示,病毒模型组抗VSV病毒G(VSV-G)蛋白表达强度高于对照组,在分别加入了1、10 ?mol/L
地高辛和10 ?mol/L欧夹竹桃苷后,抗VSV-G蛋白表达强度均减弱,其中以10 ?mol/L地高辛组和
10 ?mol/L欧夹竹桃苷组抑制效果更为明显,见图2C。利用VSV结合H1N1、SeV、EMCV共同感染A549细胞后,6组的H1N1、SeV、EMCV mRNA相对表达量比较差异均有统计学意义(F分别为872.700、254.800、639.500,P均< 0.001),病毒模型组的病毒mRNA相对表达量比对照组升高(P < 0.001);而加入地高辛和欧夹竹桃苷后病毒mRNA相对表达量均降低(P均< 0.001),见图2D。
三、地高辛和欧夹竹桃苷对vero细胞中VSV、H1N1、SeV和EMCV病毒复制的影响 荧光成像结果表明,1 ?mol/L地高辛组和
1 ?mol/L欧夹竹桃苷组中GFP阳性的vero细胞明显减少,见图3A。故后续选1 ?mol/L地高辛和1 ?mol/L欧夹竹桃苷进行实验。RT-qPCR结果显示,4组的VSV mRNA相对表达量比较差异有统计学意义(F = 1 859.000,P < 0.001),与病毒模型组比较,1 ?mol/L地高辛组和1 ?mol/L欧夹竹桃苷组的病毒mRNA相对表达量均降低(P均< 0.001),见图3B。vero细胞感染H1N1、SeV和EMCV等RNA病毒时,4组的H1N1、SeV、EMCV mRNA相对表达量比较差异均有统计学意义(F分别为568.200、427.600、471.900,P均 < 0.001),地高辛和欧夹竹桃苷具有良好的抗病毒功能,并且这2种药物在低浓度时(1 ?mol/L)也有較强的抗病毒效果,见图3C。
四、地高辛和欧夹竹桃苷对ATP1A1-shRNA vero细胞中VSV-GFP病毒复制的影响
经验证,本实验室成功构建ATP1A1慢病毒敲低的vero细胞(ATP1A1-shRNA vero)(t = 21.600,P < 0.001),见图4A。荧光结果显示,与病毒模型组比较,下调ATP1A1蛋白的表达与加入地高辛和欧夹竹桃苷后的GFP阳性细胞明显减少,见图4B。RT-qPCR显示,5组的VSV、EMCV、H1N1 mRNA相对表达量比较差异有统计学意义(F分别为643.700、426.500、322.900,P均< 0.001),与病毒模型组比较,ATP1A1-shRNA vero细胞组病毒mRNA相对表达量下降(P < 0.001),地高辛和欧夹竹桃苷对于缺失ATP1A1的vero细胞抑制VSV、EMCV和H1N1病毒感染无明显影响(P均> 0.05),见图4C。
讨论
RNA病毒具有高变异频率的特性,较难通过靶向性药物针对单个病毒进行治疗,近年出现的人畜共患起源的新冠病毒证明了这一点,目前仍缺乏针对冠状病毒感染的强力抗病毒药物[11]。因此,寻找广谱的强效抗病毒药物,是靶向治疗RNA病毒感染性疾病的有效策略。由ATP1A1编码Na+/K+-ATP酶的催化α亚基能够参与多种病毒在宿主细胞内的复制过程,如新冠病毒感染和细胞内复制;通过基因沉默靶向ATP1A1可抑制病毒在宿主细胞内的复制阶段,提示靶向抑制Na+/K+通道蛋白可能是一种有效的广谱抗病毒策略[12]。
目前已有的强心类药物大多靶向抑制Na+/K+通道蛋白。本研究使用强心苷性类药物地高辛和欧夹竹桃苷,通过RT-qPCR、蛋白免疫印迹等技术,证明了地高辛和欧夹竹桃苷单独处理可在细胞水平显著抑制VSV、EMCV、H1N1和SeV病毒复制。由于vero细胞不能分泌IFN,因此受到病毒感染时可直接反映宿主细胞的抗病毒免疫状态[13]。本研究进一步通过在vero细胞中感染不同种RNA病毒,得出强心苷药物并非作用于IFN信号通路来发挥抗病毒功能。已知敲低Na+/K+通道蛋白ATP1A1能够显著抑制病毒在宿主细胞内的复制[14-15]。本研究显示,在ATP1A1敲低的vero细胞中,地高辛和欧夹竹桃苷的抗病毒作用不明显,说明由ATP1A1可能在地高辛和欧夹竹桃苷增强宿主抗病毒反应中发挥重要的作用。本研究进一步揭示了强心苷类药物发挥抗病毒效应的部分分子机制,为地高辛和欧夹竹桃苷的抗病毒研究提供科学依据。
综上所述,强心苷类药物可能是一种较为有潜力的RNA病毒包括冠状病毒感染治疗方法,其通过抑制Na+/K+通道蛋白进而发挥抗病毒活性的具体分子机制将是下一步研究的重点。
参 考 文 献
[1] Bandara V, Weinstein S A, White J, et al. A review of the natural history, toxinology, diagnosis and clinical management of Nerium oleander (common oleander) and Thevetia peruviana (yellow oleander) poisoning. Toxicon, 2010, 56(3):273-281.
[2] Bodemann H H. The Current concept for the cardiac glycoside receptor. Clin Cardiol, 1981, 4(5): 223-228.
[3] Prassas I, Diamandis E P. Novel therapeutic applications of cardiac glycosides. Nat Rev Drug Discov, 2008, 7(11): 926-935.
[4] ?kubník J, Pavlí?ková V, Rimpelová S. Cardiac glycosides as immune system modulators. Biomolecules, 2021, 11(5): 659.
[5] Ayogu J I, Odoh A S. Prospects and therapeutic applications of cardiac glycosides in cancer remediation. ACS Comb Sci, 2020, 22(11): 543-553.
[6] Yang C W, Chang H Y, Hsu H Y, et al. Identification of anti-viral activity of the cardenolides, Na+/K+-ATPase inhibitors, against porcine transmissible gastroenteritis virus. Toxicol Appl Pharmacol, 2017, 332: 129-137.
[7] Plante K S, Dwivedi V, Plante J A, et al. Antiviral activity of oleandrin and a defined extract of Nerium oleander against SARS-CoV-2. Biomed Pharmacother, 2021, 138: 111457.
[8] Takase S, Kurokawa R, Arai D, et al. A quantitative shRNA screen identifies ATP1A1 as a gene that regulates cytotoxicity by aurilide B. Sci Rep, 2017, 7(1): 2002.
[9] Liu K, Qiu D, Liang X, et al. Lipotoxicity-induced STING1 activation stimulates MTORC1 and restricts hepatic lipophagy. Autophagy, 2022, 18(4): 860-876.
[10] Sharma A, Ahmad Farouk I, Lal S K. COVID-19: a review on the novel coronavirus disease evolution, transmission, detection, control and prevention. Viruses, 2021, 13(2):202.
[11] 尉秀清,吴晓瑛. 新型冠状病毒肺炎及在适宜患者中试用甘草甜素治疗的建议. 新医学, 2020, 51(3): 168-172.
[12] Burkard C, Verheije M H, Haagmans B L, et al. ATP1A1-mediated Src signaling inhibits coronavirus entry into host cells. J Virol, 2015, 89(8): 4434-4448.
[13] Kiesslich S, Kamen A A. Vero cell upstream bioprocess development for the production of viral vectors and vaccines. Biotechnol Adv, 2020, 44: 107608.
[14] Lingemann M, McCarty T, Liu X, et al. The alpha-1 subunit of the Na+, K+-ATPase (ATP1A1) is required for macropinocytic entry of respiratory syncytial virus (RSV) in human respiratory epithelial cells. PLoS Pathog, 2019, 15(8): e1007963.
[15] Iwasaki M, Minder P, Caì Y, et al. Interactome analysis of the lymphocytic choriomeningitis virus nucleoprotein in infected cells reveals ATPase Na+/K+ transporting subunit Alpha 1 and prohibitin as host-cell factors involved in the life cycle of mammarenaviruses. PLoS Pathog, 2018, 14(2): e1006892.
(收稿日期:2023-03-03)
(本文編辑:林燕薇)
