食管癌致食管-气管瘘患者多次心脏骤停内镜介入治疗1例报告并文献复习
2023-05-26赵倩付爱双李球兵任泓沁杨文姜姣戈艳蕾
赵倩 付爱双 李球兵 任泓沁 杨文 姜姣 戈艳蕾
华北理工大学附属医院呼吸内科 河北唐山 063000
目前恶性食管-气管瘘(tracheo-esophageal fistula, TEF)的治疗手段主要有手术治疗、内科保守治疗和支架介入治疗。具备外科手术条件患者首选手术切除病变,封堵瘘口,但恶性TEF患者多处于肿瘤中晚期,身体状况较差,基本不适合该治疗方案。内科保守治疗是对于身体情况差无法耐受手术治疗的食管气管瘘患者的基本治疗方案,主要包括应用抗生素抗感染、营养支持及对症治疗。部分患者存在多重耐药菌感染或合并真菌感染,需选择合适抗生素治疗感染,以减少多重耐药的发生。支架介入治疗是基于目前不适合手术的TEF患者的主要治疗方案,可以最大程度减轻甚至消除患者的症状,明显改善生活质量。支架介入治疗是经支气管镜、胃镜或在影像引导下于气道和/或消化道置入支架,以及镜下药物注射、烧灼、置入金属夹等。目前认为介入支架中气道支架为首选,特殊情况下可选择消化道支架或联用消化道支架。恶性TEF患者多营养差、体质差、存在严重感染,内镜介入治疗风险高。支架介入治疗的主要并发症有咳嗽、痰液潴留、肺部感染、支架再狭窄及支架移位等,因此支架介入术后需严格管理及规范随诊。因此,对我院收治1例食管癌伴TEF多次心脏骤停并经内镜介入消瘤支架置入患者的病历情况汇报如下,旨在提高医务人员对内镜介入治疗恶性TEF患者的诊治经验及风险评估。
1 病历报告
患者,男,61岁,主因食管癌伴TEF2月余,咳嗽伴喘息5d于2020年5月11日收入我院肿瘤科。患者2020年2月28日因无明显诱因出现饮水呛咳伴进食哽咽感,就诊于当地医院,行上消化道造影提示:上段食管癌,TEF,胃炎。给予抗炎、抑酸等综合治疗,效果差。2020年3月8日患者出现进食后呛咳,伴喘息4d,就诊于我院急诊科,就诊途中突发意识丧失,呼吸、心脏骤停,立即给予心肺复苏、气管插管、呼吸机辅助通气等综合治疗,10min后患者恢复自主心律,神志转清后转入我院重症医学科。2020年3月16日消化内镜提示存在TEF,同时胸部影像学提示:主气管中下段狭窄。遂在全麻下行经支气管硬镜插管下主气道消瘤+支架置入治疗。术后病情平稳转入肿瘤外科。术后患者无明显进食呛咳,2d后行上消化道造影示:(1) 食管中上段占位性病变伴食管纵隔瘘;(2)气管内支架影,见图1。2020年3月20日肿瘤外科给予多西他赛d1+顺铂d1-3化疗一次,化疗后患者一般情况良好,继续肠内营养支持治疗。2020年4月18日再次入我院肿瘤外科行第二次食管癌化疗及营养支持治疗,患者一般状态好转,生活基本自理,但置入支架后未规范复查支气管镜评估支架情况及痰液引流情况,且未规范进行雾化。2020年4月18日复查胸部正位X线示:(1)右上肺点片状密度增高影;(2)右侧胸膜粘连;(3)右锁骨陈旧性骨折,内固定术后改变。2020年5月6日患者出现咳嗽、咳痰困难,喘息,就诊于当地医院,诊断为“肺炎”,给予抗炎、化痰等治疗,但效果差。2020年5月11日 转入我院肿瘤外科,入院后急查血常规白细胞11.7×109/L,嗜中性粒细胞:6.92×109/L;电解质、肝功能:血钠125.9mmol/L,血钾3.8mmol/L,白蛋白34g/L;肾功能及心肌酶大致正常,心电图未见明显异常;凝血系列:纤维蛋白原4.39g/L,D-二聚体694.48ng/mL;降钙素原1.09ng/mL,C反应蛋白42mg/L。胸部CT示两肺下叶及右肺中叶炎性病变,两侧胸膜粘连。入院后留置鼻胃管,给予抗炎、化痰对症治疗。2020年5月11日 15:00患者出现血氧进行性下降至末梢血氧50%(鼻导管吸氧10L/min),后由肿瘤外科转入重症医学科,给予气管插管、呼吸机辅助通气,抗感染、平喘、化痰、抗凝等综合治疗。2020年5月13日床旁纤维支气管镜检查可见支架上缘位于隆突上约6cm支架表面少许分泌物,气管支架远端可见息肉样肿物,将右主支气管完全堵塞,表面附着大量血性脓痰。2020年5月15日喉罩插管麻醉后行支气管镜检查,可见支架下缘主气管内菜花样肿物,黏膜出血伴充血、水肿,触之易出血,主气管3、4区肿物生长,3区气管狭窄约90%,支气管5区开口完全阻塞,支气管7区气管狭窄约75%,应用电圈套器、冷冻冻取主气管肿瘤,3区气道狭窄较前减轻,镜下取出气道支架。瘤体完全阻塞主气道,患者出现血氧无法维持,二氧化碳分压140mmHg以上,潮气量50mL,再次心脏骤停,给予心肺复苏气管插管(6.5号),后患者逐渐恢复稳定,转回重症医学科病房。2020年5月16日 11:00 纯氧呼吸机通气下末梢血氧68%左右。2020年5月16日 12:00 患者右侧胸廓饱满,出现张力性气胸,X线胸片检查提示右侧气胸,行右侧胸腔引流术。2020年5月16日 12:50 行床旁支气管镜检查+气道内肿瘤消瘤术+气道支架置入术,术中拔出气管插管,放入硬镜,可见主气道梗阻明显,主气管3、4、5、7区肿物,3区气管狭窄约90%,5区气管狭窄约100%,7区气管狭窄约75%,应用电圈套器、冷冻冻取、氩气刀充分消除主气道肿瘤,气管狭窄经治疗后较前减轻。后置入Y型支架,应用球囊扩张支架,支架释放良好,拔除硬镜后更换7.5号气管插管,术后患者血氧饱和度98%,血压112/55mmHg左右,给予羟乙基淀粉500mL扩容。2020年5月17日 7:00 患者突发意识丧失、心脏骤停,立即予以心肺复苏,7:07心电监护示室颤,予以360J电除颤一次,7:09恢复自主心律,心率168次/min,有创血压132/62mmHg,末梢血氧饱和度98%,神志朦胧。14:50 患者病情平稳,成功脱机拔管。2020年5月19日病情平稳转入呼吸科,继续给予止咳平喘、抗炎、营养支持治疗。2020年5月26日复查支气管镜检查示:主气管下段及左右主支气管气管支架支撑良好,表面大量白色分泌物,较稀薄,予以充分吸引,右主支气管支架下缘可见少许肉芽组织增生,余左右主支气管开口通畅,黏膜充血,无水肿,见图2。2020年5月29日复查胸部CT示两肺炎症较前吸收。于2020年5月30日病情好转后出院。

图1 气管支架术后上消化道造影
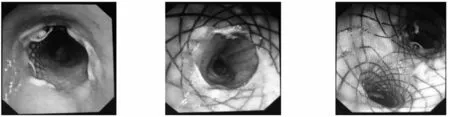
图2 患者支气管镜检查+气道内肿瘤消瘤术+Y型气管支架植入术后
2 讨论
TEF是一种临床上少见的疾病,包括气管食管瘘与支气管食管瘘,其发病分为先天性和后天获得性,一般以后者居多[1]。TEF是食管与气管或支气管之间形成瘘管交通,致使气道与呼吸道内的气液互通。患者多表现为进食后剧烈呛咳、并伴有反复复发的肺部感染,如果患者治疗不及时,则可能在短期内死亡,且绝大多数死于肺部感染。因该病病因复杂,治疗难度高,且病死率极高,属消化内科、呼吸内科、胸外科、介入科、肿瘤科等多学科共同关注和研究的一种危重症疾病[2-3]。获得性食管气管瘘(acquired tracheo-esophageal fistula, ATEF)根据起病原因可分为良性疾病导致和恶性疾病导致。其中良性TEF多见于长期气管插管呼吸机辅助通气、外科术后、食管支架置入术后、严重车祸外伤致颈胸部损伤、食管或气管憩室、食管或气管异物穿孔等,但发病率很低;恶性TEF常见,多继发于食管癌、肺癌、纵膈肿瘤等[4]。
TEF通过临床表现、体格检查、各种影像学检查及内镜检查即可诊断,其典型的临床表现为反复的吞咽或饮水时呛咳、化脓性支气管炎、肺炎和吞咽困难等[5],有部分患者会出现“卧位烧灼样呛咳综合征”,表现为剧烈的烧灼样呛咳,平卧位加重,坐立位可减轻或消失;患者多有大量白色黏痰、脓性痰或血性痰等[2-3],症状的严重程度和持续时间取决于瘘管的大小和位置[6]。通过上消化道造影观察造影剂走行可判断瘘口位置,但对于瘘口较大的患者,需谨慎行造影检查,因为在服用造影剂时可能出现误吸。胸部CT或MRI也作为常规检査项目用来评估胸部(气道、食管、胸腔及纵膈等)整体状况,而且可以明确瘘口与周围组织的关系,为之后选择合适的支架类型及置入方式提供帮助[2-3]。目前认为气管镜和/或内窥镜是诊断TEF的金标准[7],内镜下可直接观察瘘口大小,确认瘘口位置,并可以查看瘘口及周围黏膜的情况,同时活检可明确病因,为今后的治疗方案提供依据[8]。
目前TEF的治疗主要以手术治疗、内科保守治疗及介入治疗为主。目前手术治疗方案主要有气管支气管瘘修补术、食管瘘修补术、筋膜肌瓣植入术、肺叶切除术等。但需做好充分的术前准备:禁食水、胃肠减压、给予营养支持、抗感染治疗等,经治疗患者病情平稳后行择期手术[4]。出现恶性TEF的患者多已为肿瘤晚期,一般情况差,无法耐受手术,一般不选择手术治疗。
内科保守治疗是最基础的治疗方案,主要采取抗生素控制感染、营养支持及对症治疗[9],多适用于恶性TEF患者,此类患者多为晚期食管癌导致,一般情况差,无法行手术治疗。近十余年中,内镜介入技术得到极大的发展,尤其是支架的使用在TEF管理中起着关键作用[10]。内镜治疗已被证明是一种安全有效的治疗TEF的方法,与手术干预相比发病率和病死率更低[11]。支架置入能够封堵食管与气管之间的瘘口,恢复正常生理结构,同时可以进行镜下药物注射、烧灼、置入金属夹等治疗。对于不适合手术的患者,特别是食管癌合并TEF的患者,内镜下支架置入则成为重要治疗手段[2],成功的支架置入可立即缓解咳嗽、误吸等症状,显著提高患者生活质量,同时也为后续抗肿瘤争取治疗时间,进而延长患者生存期[12-13]。
目前认为介入支架中气道支架为首选,只有在特殊情况下才会选择消化道支架或联用消化道支架[3]。气管支架置入的适应证主要包括以下方面:(1)结构性气道狭窄:如缓解恶性气道疾病的外在压迫和腔内内在病变及良性气道狭窄的治疗;(2)功能性气道狭窄:如气道软化症,复发性多软骨炎等原因引起的气道塌陷[14];(3)治疗气道消化道瘘和气道裂开等;(4)肺移植术后吻合口并发症的处理;(5)小儿气道狭窄的处理[15]。禁忌证主要包括:(1)同支气管镜检查的禁忌证;(2)用于治疗良性疾病时,禁止使用不可回收的金属裸支架;(3)中央气道管内型病变慎用金属裸支架;(4)因肿瘤累及声门引起声门及声门下狭窄为相对禁忌证;(5)气道黏膜炎症如结核等未控制,或远端气道闭塞或伴肺不张,均不宜放置支架[14]。支架置入术前需要评估病情,根据瘘管的位置和气道狭窄选择合适的支架置入术,包括选择食管支架置入、气管支架置入、食管气管双支架置入及支架材料类型、长度等,要做好充分术前准备及积极术后评估,术后需要评估气道损伤程度、支架开放、支架迁移和分泌物滞留情况[16]。本例患者符合气道消化道瘘指征,且无其他禁忌证,术前通过行气管镜及消化道造影检查对患者的瘘口位置、瘘口大小及气管支气管狭窄程度进行充分评估,认为适于行气管支架置入术;术后行上消化道造影检查显示支架放置位置合适,无偏差。
支架置入的常见并发症及处理措施:(1)痰液潴留:湿化气道及口服祛痰药以促进分泌物排出,痰液较多者给予气管镜下吸痰[14,17];(2)出血:支架放置不当可造成气道损伤而引起出血,若出血量大可给予止血治疗,必要时气管镜下治疗[14,17];(3)支架移位:多由支架不适引起剧烈咳嗽导致支架移位或肿瘤组织放化疗后体积缩小导致相对管腔扩大而发生支架移位。若发生移位,应行支气管镜检查,决定支架复位或取出、置入新支架[14,17]。(4)再狭窄:肿瘤和/或肉芽组织增生覆盖支架引起支架腔内再狭窄,常需要采取腔内近距离放疗、冷冻或高频电烧灼等治疗[14,17]。对于上述常见并发症,我们需要内镜随访干预以保持气道通畅并防止进一步的并发症。Hans J. Lee等[18]研究认为支架置入后4~6周内的支气管镜监测可能有助于早期发现并发症及其后续处理。本例在支气管支架置入2个月后,复查支气管镜示主气管3、4区肿物生长,3、5、7区重度狭窄。患者支架置入后未规范随访及支气管镜监测,因此未及早预防并发症的出现,导致患者主气道内重度狭窄。
我国专家共识指出支架取出指征主要包括:(1)患者出现剧烈咳嗽或发生严重支架相关感染;(2)出现支架断裂、破损、反复移位、严重肉芽或肿瘤组织过度增生;(3)气管支气管管腔增宽任务已完成[14]。本例主气管内肿物生长,再次支架内狭窄,但二次消瘤效果差,支架阻塞,无法畅通,导致气道内重度狭窄,需立即取出气管支架。在喉罩插管麻醉下,支气管镜下取出气道支架后,瘤体完全阻塞主气道,患者出现血氧急速下降无法维持,心脏骤停。考虑发生严重并发症的原因:(1)气管镜取出后,瘤体完全阻塞主气道,致患者严重缺氧,诱发心脏骤停;(2)气管镜操作过程中患者的会厌、咽喉及舌根部受到气管镜的剧烈刺激,进而引起舌咽神经、颈动脉窦张力增加,导致迷走神经强烈刺激反射,引起心脏传导功能障碍及心脏舒缩功能障碍;(3)严重感染后机体会产生心肌细胞抑制因子,直接抑制心肌舒张及收缩功能[19-20]。因此对于病情危重的患者行支气管镜检查时,首先评估患者病情,应考虑到支架取出后气管塌陷的可能,做好相应预案。同时严格掌握适应证及禁忌证,备好急救药品,在操作过程中保持高度警惕,密切观察患者情况,避免此类严重事件再次发生[21]。
