动脉瘤蛛网膜下腔出血后迟发性脑缺血患者血清水通道蛋白4、神经元特异性核蛋白水平及意义
2023-05-25丁大冬
丁大冬, 蒋 宽, 吴 达, 储 亮
(江苏省宜兴市人民医院 神经外科, 江苏 宜兴, 214200)
动脉瘤蛛网膜下腔出血(aSAH)是一种脑血管疾病。临床研究[1]报道,颅内动脉瘤首次破裂率高达30%,再次破裂率接近60%。动脉瘤破裂后4~8 d, 约30%的aSAH患者会发生迟发性脑缺血,迟发性脑缺血是aSAH的主要并发症,严重时导致aSAH患者发生神经功能损伤及不良预后[2]。因此,早期预测aSAH后迟发性脑缺血在临床上有重要意义。水通道蛋白(AQP)4是小分子细胞膜蛋白,具有维持细胞内外平衡的作用[3-4]。研究[5]报道,脑缺血后常并发脑水肿,脑水肿的发生与AQP4表达水平上升有关, AQP4敲除后,大鼠脑缺血后脑水肿程度显著缓解。研究[6]显示,急性脑梗死溶栓后出血性转化患者血清AQP4水平显著高于非出血转化患者, AQP4水平升高可影响溶栓后出血性转化。李明月等[7]研究报道,大鼠脑出血后表现出严重神经功能缺损,免疫组化检测显示,神经元特异性核蛋白(NeuN)阳性细胞数显著减少,但血清中AQP4、NeuN与患者迟发性脑缺血的关系如何还未可知。本研究检测aSAH患者血清中AQP4、NeuN的表达水平,分析两者与迟发性脑缺血的相关性,以期为预测临床aSAH迟发性脑缺血提供指导。
1 资料与方法
1.1 一般资料
选取2017年2月—2022年2月aSAH患者100例为研究对象,其中男55例,女45例; 年龄37~80岁,平均(59.11±10.01)岁; 体质量指数(BMI)20~26 kg/m2, 平均(23.42±2.32) kg/m2; Hunt-Hess分级为Ⅰ~Ⅱ级54例, Ⅲ~Ⅳ级46例。纳入标准: ① 符合aSAH相关诊断标准者[8]; ② 临床资料齐全者; ③ 初次发病,且发病至入院时间<24 h者; ④ 单发颅内动脉瘤者。排除标准: ① 肿瘤性卒中继发aSAH者; ② 入院7 d内死亡者; ③ 伴有严重肝、肾肺功能障碍者; ④ 伴有颅内感染、自身免疫疾病或血液系统疾病者。本研究通过医院伦理委员会批准,符合《世界医学协会赫尔辛基宣言》。收集患者基础资料,包括性别、年龄、BMI、Hunt-Hess分级、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、世界神经外科联盟(WFNS)分级、总胆固醇(TC)、甘油三酯(TG)水平。迟发性脑缺血诊断标准[9]为患者出现局灶性神经功能缺损体征(如肢体瘫痪、失语等),持续时间>1 h, 头部CT可见新的梗死灶。排除脑积水、发烧、癫痫、脑水肿、药物效应等其他原因导致的神经功能缺损者。根据aSAH后4~14 d内迟发性脑缺血发生情况将患者分为无迟发性脑缺血组(n=68)和迟发性脑缺血组(n=32)。
1.2 血清中AQP4和NeuN表达水平
aSAH患者入院时收集静脉血6 mL, 4 ℃, 4 000转/min, 离心10 min, 留上清,冻存于-80 ℃冰箱中待测。血清中AQP4和NeuN水平采用酶联免疫吸附(ELISA)法检测,操作步骤严格依据AQP4 ELISA试剂盒(货号: RAB3026, 购自美国Sigma公司)、NeuN ELISA试剂盒(货号EH2454, 购自武汉菲恩生物科技有限公司)进行。于490 nm处测量样本光密度值,根据标准曲线换算样本浓度。
1.3 统计学分析
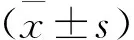
2 结 果
2.1 迟发性脑缺血组和无迟发性脑缺血组患者
一般资料比较
与无迟发性脑缺血组相比,迟发性脑缺血组WFNS分级为Ⅲ~Ⅳ级患者占比、Hunt-Hess分级为Ⅲ~Ⅳ级患者占比较高,差异有统计学意义(P<0.05), 见表1。
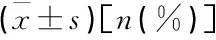
表1 2组基本资料比较
2.2 无迟发性脑缺血组、迟发性脑缺血组血清AQP4和NeuN水平比较
与无迟发性脑缺血组相比,迟发性脑缺血组患者血清AQP4水平较高,血清NeuN水平较低,差异均有统计学意义(P<0.05), 见表2。
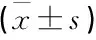
表2 血清AQP4和NeuN水平比较
2.3 aSAH患者血清AQP4和NeuN相关性分析
Pearson法分析显示,血清AQP4与NeuN呈负相关(r=-0.592,P<0.001)。
2.4 Logistic回归分析aSAH后迟发性脑缺血的影响因素
以aSAH后是否发生迟发性脑缺血为因变量(无迟发性脑缺血=0, 迟发性脑缺血=1), 以WFNS分级、Hunt-Hess分级、NeuN、AQP4为自变量,进行Logistic回归分析。结果显示, Hunt-Hess分级、AQP4是aSAH后迟发性脑缺血的危险因素(P<0.05), NeuN是aSAH后迟发性脑缺血的保护因素(P<0.05), 见表3。

表3 Logistic回归分析aSAH后迟发性脑缺血的影响因素
2.5 血清AQP4和NeuN水平对aSAH后迟发性脑缺血的预测价值
ROC曲线显示, AQP4预测aSAH后迟发性脑缺血的曲线下面积(AUC)为0.862(95%CI: 0.781~0.942), 敏感度为76.50%, 特异度为83.82%, 截断值为1.19 ng/L; NeuN预测aSAH后迟发性脑缺血的AUC为0.771(95%CI: 0.672~0.870), 敏感度为78.10%, 特异度为76.50%, 截断值为0.47 μg/mL; AQP4联合NeuN预测aSAH后迟发性脑缺血的AUC为0.879(95%CI: 0.811~0.948), 敏感度为90.60%, 特异度为75.00%; 两者联合诊断的AUC值高于NeuN单独诊断(Z=2.476,P=0.013), 见图1。

图1 血清AQP4和NeuN水平对aSAH后迟发性脑缺血的预测价值
3 讨 论
迟发性脑缺血是aSAH患者严重神经功能缺损的重要原因。研究[10]发现,迟发性脑缺血发生机制与微血栓形成、早期脑损伤、炎症反应等因素密切相关。研究[11]显示,炎症因子刺激aSAH后神经血管损伤,可进一步引发神经功能障碍,且在神经功能损伤中扮演关键角色。aSAH发病后,大量血液涌入蛛网膜下腔,出血部位沉积红细胞代谢产物(如血红蛋白等); 血红蛋白可通过激发活性氧释放引起神经组织内氧化应激反应,并促进炎症级联反应,诱导血管内皮功能受损,诱导迟发性脑缺血[12]。临床上采用神经系统监测、颅脑多普勒超声、临床检查等预测迟发性脑缺血,但检查方法繁琐,敏感性低。因此探讨较为便捷的检查方法预测aSAH后迟发性脑缺血风险对临床有重要价值。
急性脑水肿可通过影响脑组织微血管循环而诱导迟发性脑缺血[13]。研究[14]证实,缺血性中风患者中,血栓的形成阻碍了脑动脉,降低细胞代谢,引发细胞毒性水肿,增加血脑屏障渗透而形成脑水肿。AQP是细胞膜上跨膜蛋白,对水分子具有高效选择透过性,可调控水分子进出细胞膜,并维持细胞对水分子的吸收与排泄,参与细胞的病理过程[15]。AQP4是位于脑组织的水通道蛋白,可调控水分子在细胞膜上双向转运,维持大脑中水平衡、细胞代谢,并影响缺血后脑水肿,在中枢神经系统的星形胶质细胞中呈高表达[16]。目前, AQP4参与脑水肿的病理过程。研究[17]发现,亚低温可通过抑制p38丝裂素活化蛋白激酶信号通路的激活而降低大鼠脑组织AQP4水平,具有减轻脑水肿的作用。研究[18]表明,AQP4高表达时,能改善血管性脑水肿,加重细胞毒性脑水肿。AQP4表达水平的早期上升会影响星形胶质细胞肿胀及脑水肿的形成, AQP4可通过影响K+形成的渗透作用驱动水分子进行跨膜运动,影响水的稳态[19]。本研究发现,迟发性脑缺血组患者血清AQP4水平显著高于无迟发性脑缺血组, AQP4是aSAH后迟发性脑缺血的危险因素,提示AQP4可能参与aSAH后迟发性脑缺血。
NeuN是一种可溶解的核蛋白,是神经系统特异性核调节分子。研究[20]证实,小鼠模型中海马CA1区NeuN阳性细胞数量显著下降,神经功能缺损程度严重,意味着小鼠脑缺血再灌注损伤模型构建成功。研究[7]报道,脑出血大鼠脑组织NeuN表达水平明显下降。本研究发现,迟发性脑缺血组患者血清NeuN水平明显低于无迟发性脑缺血组,NeuN是aSAH后迟发性脑缺血的保护因素,提示NeuN可能影响aSAH后迟发性脑缺血。本研究还发现,血清AQP4与NeuN有显著负相关性,提示血清AQP4与NeuN共同影响aSAH后迟发性脑缺血。本研究中,迟发性脑缺血组患者WFNS分级为Ⅲ~Ⅳ级占比、Hunt-Hess分级为Ⅲ~Ⅳ级占比较无迟发性脑缺血组高,且Hunt-Hess分级是aSAH后迟发性脑缺血的危险因素,提示评估Hunt-Hess分级对发现aSAH后迟发性脑缺血有一定帮助; Logistic回归分析发现, WFNS分级不是aSAH后迟发性脑缺血的危险因素,考虑可能与本研究纳入的病例数较少有关。ROC曲线分析发现, AQP4预测aSAH后迟发性脑缺血的AUC为0.862,NeuN预测aSAH后迟发性脑缺血的AUC为0.771, AQP4联合NeuN预测aSAH后迟发性脑缺血的AUC为0.879, 提示AQP4联合NeuN对aSAH后迟发性脑缺血有良好的预测价值。血清aSAH后迟发性脑缺血检测可能是临床上评估aSAH后迟发性脑缺血的重要参考指标。
