MRI 及甲胎蛋白对原发性肝细胞癌射频消融术后疗效的评估价值
2023-05-25张刘璐刘迎春揭平平尧麒汪静刘勇
张刘璐,刘迎春,揭平平,尧麒,汪静,刘勇
原发性肝细胞癌(hepatocellular carcinoma,HCC)是肝脏最常见的恶性肿瘤,发病率和死亡率分别居全部恶性肿瘤的第2 位和第3 位[1]。HCC 按照大体病理可分为巨块型、结节型、小肝癌和弥漫型。HCC 治疗一直是临床关注的问题,对HCC 术后随访、疗效评估以及关注残留病灶至关重要[2],对小肝癌治疗最为关键[3]。射频消融术(radiofrequency ablation,RFA)是近年来临床治疗肝癌的一种成熟的微创方法,主要利用特制的电极探针在超声等影像学引导下经皮穿刺肝癌病灶,通过射频电流发射器发出电流并产生热量使癌细胞凝固坏死和灭活[4]。RFA 具有创伤小、肝功能损伤小、恢复快等优点,对小肝癌治疗尤为有价值,但也存在大病灶或病灶深面操作困难、灭活不彻底及肿瘤易复发等问题[5]。目前的研究主要采用超声、CT、MRI 检查对RFA 治疗HCC 的疗效进行评价,少见采用MRI 与AFP 结合对RFA 疗效的评估。本研究对41 例经RFA 治疗的HCC 病人的术前术后MRI 与甲胎蛋白(alpha fetoprotein,AFP)检查结果进行回顾性分析,旨在探究其在HCC 术后疗效评价中的作用。
1 资料与方法
1.1 一般资料 回顾性纳入2019 年1 月—2021年6 月西南医科大学附属中医医院收治的HCC 病人41 例,男38 例,女3 例,年龄42~71 岁,中位年龄58 岁。纳入标准:(1)HCC 诊断符合《原发性肝癌诊疗规范(2019 年版)》指南[6];(2)明确诊断后在本院行RFA 及中西医综合治疗;(3)MRI 检查与AFP检查资料完整,包括术前1 次、术后6 次(术后1、3、6、9、12、15 个月复查,每次2 种检查间隔时间<7 d);(4)临床资料完整。排除标准:(1)术前MRI 检查病灶长径≥4 cm、多发病灶、转移性肝癌;(2)合并其他恶性肿瘤或严重心、肾等重要脏器功能不全者;(3)孕期或哺乳期。
1.2 设备与方法 采用西门子Skyra 3.0 T MRI 设备,12 通道腹部线圈。扫描范围自膈肌上缘平面至双肾下极。扫描序列及参数:(1)横断面T1WI。TR 186 ms,TE 1.23 ms,FOV 296 mm×380 mm,矩 阵200×256,层厚6 mm,层间距1.2 mm,翻转角70°。(2)横断面T2WI。TR 1 100 ms,TE 87 ms,FOV 296 mm×380 mm,矩阵200×320,层厚6 mm,层间距1.2 mm,翻转角160°。(3)冠状面T2WI。TR 1 200 ms,TE 87 ms,FOV 380 mm×380 mm,矩阵256×256;层厚5 mm,层间距1 mm,翻转角154°。(4)脂肪抑制T2WI。TR 1 600 ms,TE 98 ms,FOV 296 mm×380 mm,矩阵208×320,层厚6 mm,层间距1.2 mm,翻转角160°。(5)DWI。b 值取0、400、800 s/mm2,TR 6 400 ms,TE 56 ms,FOV 306 mm×380 mm,矩阵108×134,层厚6 mm,层间距1.2 mm。(6)动态增强扫描采用横断面脂肪抑制T1WI 序列。TR 4.31 ms,TE 2.1 ms,FOV 337 mm×400 mm,矩阵211×384,层厚3 mm,层间距0.6 mm,翻转角9°。增强检查前经静脉团注对比剂钆特酸葡胺(质量浓度为5.654 g/15 mL,恒瑞医药),注射剂量0.2 mL/kg 体质量,流率1.5~2.0 mL/s,于对比剂注射后20~25 s、50~60 s、180~240 s 分别行动脉期、静脉期、延迟期扫描。
1.3 影像分析 由2 名从事影像诊断工作经验5年与7 年的医师进行MRI 影像评估,意见不一致时由1 名10 年以上工作经验的影像医师判定。(1)病灶大小:测量病灶最大层面长径。(2)完全灭活:术区未见强化,其边缘有或无炎性强化(炎性强化呈术区边缘光滑、均匀环状或线样强化)。(3)残留:术区边缘可见小结节状病灶,呈“快进快出”式强化。(4)复发/转移:复发为残留病灶增大和/或术区边缘可见呈“快进快出”式强化的新发病灶;转移为术区以外的肝区或其他部位出现新发病灶,呈不规则环状强化或不均匀强化。
1.4 AFP 检测 用AFP 检测试剂盒(电化学发光法,Elecsys AFP,上海Roche 制药),体外定量检测人体血清中的AFP 值。根据AFP 值分为阳性(AFP≥7.0 ng/mL)和阴性(AFP<7.0 ng/mL)。
1.5 统计学方法 采用SPSS 25.0 软件进行数据分析。符合正态分布的计量资料以均数±标准差(±s)表示,非正态分布的计量资料以中位数[M(P25,P75)]表示。采用Spearman 秩相关分析术前病灶长径大小与AFP、术后复发转移发生率的相关性,r<0.4 表示弱相关,0.4≤r≤0.6 表示中度相关,r>0.6 表示强相关。采用Fisher 确切概率检验比较术后有无复发/转移肿瘤的术前AFP 差异。P<0.05 为差异有统计学意义。
2 结果
2.1 MRI 检出率分析 术前MRI 共检出41 个病灶,检出率为100%(41/41)。术后第1 次复查MRI显示病灶完全灭活39 例,残留2 例;第2~4 次复查显示残留病灶稳定。术后第5 次复查发现复发/转移病灶,2 例残留病灶均复发。第6 次复查发现复发/转移11 例。详见图1、2。术后第1~4 次复查,MRI 对病灶的检出率持续在较低水平(4.88%);第5、6 次MRI 检出率随复发/转移例数增加而上升。详见表1。

图1 病人男,46 岁。肝右叶小肝癌横断面MRI 影像。A-G 图为术前影像。A 图,T1WI 上病灶呈结节状稍低信号。B、C 图分别为T2WI 和脂肪抑制T2WI,病灶均呈稍高信号。D 图,DWI(b=800 s/mm2)上病灶呈高信号。E-G 图分别为动脉期、门静脉期和延迟期影像,病灶呈“快进快出”式强化,并见包膜强化。H 图为术后9 个月复查时的动脉期影像,术区未见强化,边缘炎性强化呈光滑、均匀线样强化影。
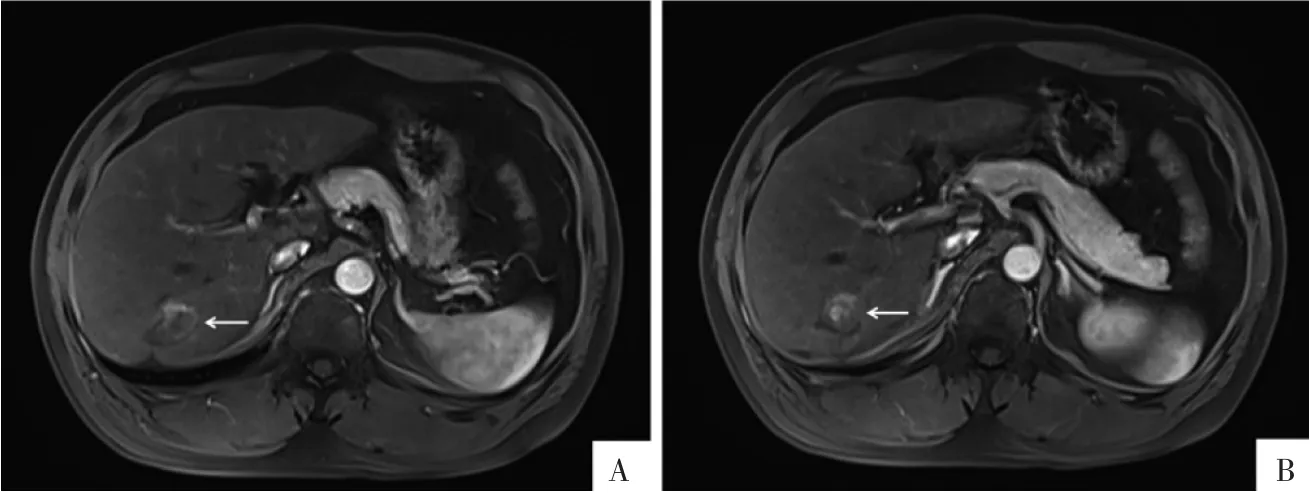
图2 病人男,61 岁。肝右叶小肝癌术后12 个月复查横断面MRI 影像。A、B 图分别为动脉期和动脉晚期影像,术区边缘复发病灶呈结节状“快进快出”式强化。

表1 HCC 术后复查MRI 及AFP 检测结果
2.2 AFP 阳性率分析 术前AFP 阳性率为78.05%(32/41 例),阴性率21.95%(9/41 例)。术后第1、2 次AFP 阳性率逐渐降低,第3、4 次复查时为0。术后第5 次复查,AFP 阳性率增加;第6 次复查,AFP 阳性率为34.15%,详见表1。
2.3 术前病灶长径与术前AFP 及术后复发/转移率的相关性分析 术前病灶长径1.0~3.6 cm,平均(2.61±0.57)cm。术前AFP 阳性病人32 例,AFP 值为8.08~1 210 ng/mL,中位值18.27(8.34,45.34)ng/mL。术前平均病灶长径与AFP 中位值呈弱相关(r=0.381,P=0.014);与术后复发/转移率(26.83%,11/41)呈中度相关(r=0.537,P<0.001)。
2.4 术后复发/转移肿瘤的术前AFP 比较 术后有无复发/转移病人的术前AFP 差异无统计学意义(P=0.083)。详见表2。
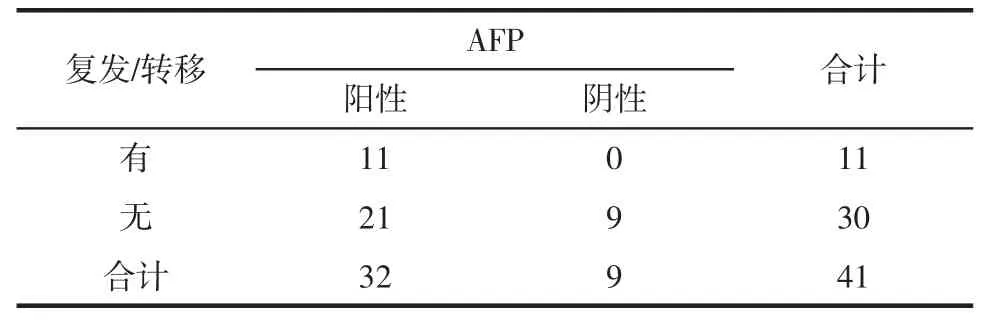
表2 术后有无复发/转移肿瘤与术前AFP 对照 例
3 讨论
MRI 具有无创、无辐射、多序列成像等优点,能够清晰显示HCC 病灶。AFP 是一种特殊糖蛋白,癌变的肝细胞具有合成AFP 的能力,AFP 升高是HCC 发生的危险因素。MRI 和AFP 值能够从不同角度反映HCC 病灶变化,对术前术后HCC 病灶评价具有重要的价值。
3.1 MRI 的应用价值 由于HCC 与正常肝细胞供血迥异,HCC 动态增强表现为典型的“快进快出”式强化。这一强化特征是判断HCC 的重要依据,有研究[7-8]表明增强MRI 可作为无创诊断肝癌的主要或一线成像方法。RFA 治疗后,完全灭活的病灶在增强MRI 上无强化,而残留、复发病灶由于富血供仍然会出现强化[9]。术后病灶边缘可存在炎性改变,强化比较常见,可持续数月,其原因是嗜中性粒细胞、活化肌成纤维细胞和巨噬细胞在坏死区周围大量积累,炎性水肿和肉芽增生,由于内部血管通透性较高、压力较大,血液循环受阻,潴留时间延长,呈持续性强化趋势[10-11]。需要注意的是,炎性强化要与术后残留、复发进行鉴别,前者呈术区边缘环状、光滑、均匀线样强化影,而残留或复发病灶呈结节样强化。
3.2 术后残留与首次复发转移危险期分析 本研究41 例肿瘤中,术后2 例病灶残留。术后1~9 个月(前4 次)复查病灶稳定,可能与消融术后肿瘤遭受破坏损伤,大部分供血血管破坏,其新生血管再生需要一定时间,残留血供不足有关[12]。而9~12 个月时(第5 次)复查发现复发/转移病灶,并且2 例残留病灶均复发,提示术后9~12 个月期间为术后首次复发/转移的危险期,尤其要注意残留病灶是否复发。
3.3 MRI 与AFP 对病灶变化的评价 MRI 可从解剖层面客观反映HCC 情况,清楚显示病灶部位、形态大小、信号、强化程度,反映灭活、残留、复发转移等情况。AFP 变化与肝癌细胞的活性和浓度有关,治疗后AFP 大幅度下降说明治疗有效,若下降后再次反转升高,预示有复发、转移可能[13-14]。本研究中,术后第1、2 次AFP 阳性率逐渐降低,第3、4 次复查时为0。第5、6 次MRI 检查上可见复发/转移病灶,同时AFP 阳性率逐渐升高。因此,AFP 变化对病灶稳定、进展动态观察具有预测价值[15-16]。然而,AFP升高也可能是由其他少数肿瘤性病变(如女性附件区肿瘤等)引起,因此单一应用AFP 评估HCC 可能有偏差。因此,本研究将MRI 与AFP 相结合,对病灶变化进行分析。但研究结果显示,手术前后MRI检出率、AFP 阳性率变化不完全一致。术前MRI 检出率为100%,而AFP 阳性率为78.05%,两者并不相符。术后1~9 个月时,病灶处于稳定时期,MRI 检出率持续在较低水平(4.88%),AFP 阳性率却仍旧持续下降。MRI 检出率、AFP 阳性率变化不完全一致的原因是MRI 及AFP 2 种方法揭示HCC 的侧重点不同,MRI 重在显示形态学方面的客观信息,AFP从生化角度反映癌细胞的情况,两者均是衡量HCC的重要指标,其指标变化对HCC 评价具有“晴雨表”的作用,结合应用能够获得更为准确的信息,从而有助于临床治疗[17]。
本研究结果还显示术前肿瘤长径大小与血清AFP 值呈弱相关。Nasteho 等[18]研究也显示两者呈弱关性(r=0.198,P=0.000 1),本研究结果与之基本一致。本研究中术前肿瘤长径大小与术后复发/转移发生率呈中度相关,与文献[19]报道的结果相符。提示肿瘤越大,其复发/转移的风险越大。尤其采用RFA 治疗时,病灶消融不彻底的风险会更高,因此对较大病灶治疗后定期随访很关键。本研究还显示,术后有无复发/转移病人的术前AFP 阳性、阴性差异无统计学意义,这与文献[20]报道的结果有差异。分析原因主要与纳入条件设置的肿瘤大小有关,本研究纳入病灶大小长径为1.0~3.6 cm,以小肝癌较多,而文献[20]中没有限制病灶的大小,较大肿瘤可能使AFP表达水平更高。
3.4 小结 MRI 能够从形态学、解剖学方面客观反映HCC 病灶情况,AFP 可从生化角度揭示癌细胞的活性。本研究采用2 种检查方法结合分析,揭示了HCC 术前术后指标变化,从而为HCC 病人个性化治疗方案制定、RFA 疗效评价、动态观察及预后评估提供佐证。但本研究存在一定的局限性,随访时间不够长,纳入病灶偏小且为单发病灶。今后可以进一步扩大样本量,纳入多种类型病灶,并结合更多检查及评价指标丰富研究内容,进行更深层次的研究。
