超声引导下胸椎旁神经阻滞应用于肺肿瘤消融手术的临床效果研究
2023-05-25丁晶晶
程 权,周 平,周 媛,丁晶晶
(1 南通大学附属医院麻醉科,南通 226001;2 南通大学医学院;3 南通大学附属医院疼痛科)
肺癌是一种严重威胁人类健康和生命安全的疾病,2020 年全球肺癌诊断率仅次于乳腺癌,位居第二,死亡率位居第一[1-2]。局部消融治疗肺肿瘤是近10 年来国内外研究的热点,该技术具有创伤小、操作简便、治疗后恢复快、并发症少等优点,常用的消融技术有射频消融和微波消融等[3-4]。临床上对一些肿瘤位置毗邻胸膜的患者实施肺肿瘤消融手术时,常会出现患者不能耐受的剧烈疼痛,多需加深麻醉深度,这无疑会增加手术风险,同时加重患者的痛苦。胸椎旁神经阻滞(thoracic paravertebral block,TPVB)是一种简单、安全的阻滞方法,通过向胸椎旁间隙注射局麻药来阻滞脊神经根和交感神经链,从而产生同侧、节段、躯体和交感神经阻滞的效果,且不会造成严重的血流动力学改变[5-6],已被广泛应用于各类胸腹壁镇痛,如胸科以及乳腺等手术的镇痛。国内外也有将其成功应用于肝肾肿瘤消融手术中的案例[7-8]。本研究旨在对比TPVB 和静脉麻醉用于肺肿瘤消融手术中的有效性以及安全性,探索TPVB 的优势。
1 资料与方法
1.1 一般资料 选择2021 年10 月—2022 年3 月期间在南通大学附属医院择期行肺肿瘤消融手术的患者60 例,其中男33 例,女27 例;年龄36~85 岁,平均(70.0±9.7)岁;BMI 17.3~32.7 kg/m2,平均(23.9±3.5)kg/m2;ASA 分级为Ⅰ~Ⅲ级。排除有精神病史、慢性疼痛史或胸壁畸形、严重凝血障碍及全身感染患者。按照随机数字表法分为观察组和对照组,各30 例,两组患者年龄、性别、BMI、ASA 分级及肿瘤直径差异均无统计学意义(均P>0.05),见表1。本研究经南通大学附属医院伦理委员会批准(伦理号:2021-K145),患者对本研究知情并同意。
表1 两组患者一般资料的比较[,n,M(Q1,Q3)]
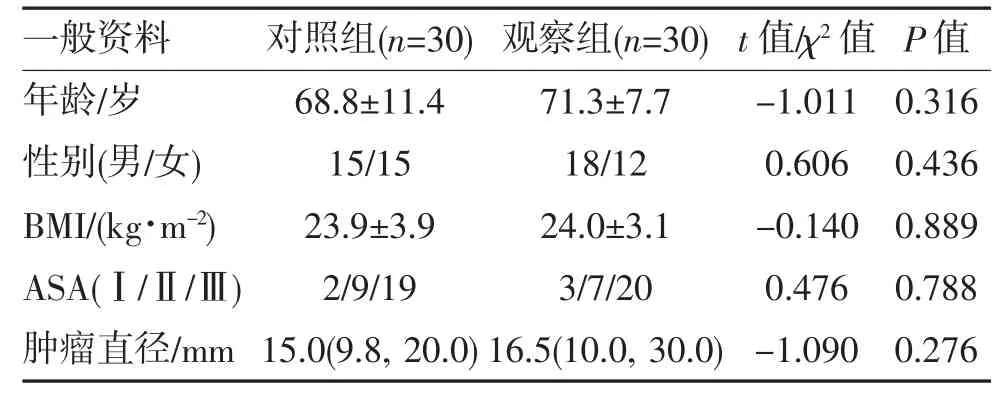
表1 两组患者一般资料的比较[,n,M(Q1,Q3)]
1.2 麻醉方法 两组患者术前常规禁食、禁饮,均不予任何术前麻醉用药。患者进入CT 透视室后进行常规监测,包括心电图、SpO2、心率(heart rate,HR)以及无创动脉血压(noninvasive blood pressure,NIBP)和呼吸频率(respiration rate,RR)监测,均采用鼻导管以3 L/min 的速度吸氧。观察组患者在术前20 min由具有丰富神经阻滞操作经验的麻醉医师实施超声引导下TPVB。患者取俯卧位,在超声引导下进行两点穿刺,每个穿刺点分别注入0.375%罗哌卡因15 mL。采用冷觉法(酒精棉球)测定麻醉阻滞平面。对照组患者在肿瘤定位开始时先静脉推注地佐辛0.1 mg/kg,接着在CT 影像引导下完成对肺部肿瘤的定位,当确认消融针到达目标位置,消融针开始升温时每位患者再静脉推注丙泊酚1~2 mg/kg。待患者呼之不应后开始消融。依据两组患者术中的镇痛情况,给予地佐辛2~3 mg/次作为补救镇痛。若重复追加镇痛后,患者依旧无法忍受疼痛,手术无法继续进行,则改行气管插管全麻。若消融过程中患者出现心率过缓(HR<55 次/min)或低血压(SBP 下降>基础值的30%)则分别给予阿托品和麻黄碱;术中若出现呼吸抑制(SpO2<90%)则暂停手术,予麻醉面罩辅助通气,必要时行气管插管。消融手术结束后,将患者转移至观察区,监测生命体征30 min。术后若患者感觉疼痛则给予对乙酰氨基酚作为术后镇痛。
1.3 观察指标(1)记录两组患者入室(T0)、消融针穿刺(T1)、消融开始时(T2)和消融开始后1 min(T3)以及消融结束后(T4)时的HR、RR 及平均动脉压(mean arterial pressure,MAP)变化情况;(2)记录两组患者术中补救镇痛和使用血管活性药物情况;(3)统计两组患者围术期不良反应发生情况。
1.4 统计学方法 数据分析采用SPSS 24.0 统计软件。符合正态分布的变量数据采用表示,使用t检验;偏态分布的数据以M(Q1,Q3)表示,采用Wilcoxon 秩和检验;计数资料以频数(百分比)表示,使用χ2检验或Fisher 确切概率法。P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者围术期临床监测指标的比较 对照组患者T1、T2 和T3 时的HR 和RR 均较T0 时明显下降(P<0.05),而观察组患者与T0 时比较差异无统计学意义(P>0.05);对照组患者T1、T2 和T3 时的HR 和RR 明显低于观察组(P<0.05)。两组患者在T0、T1 和T4 时MAP 差异无统计学意义(P>0.05),对照组患者T2 和T3 时MAP 明显低于观察组(P<0.05),见表2。
表2 两组患者围术期临床监测指标的比较(,n=30)
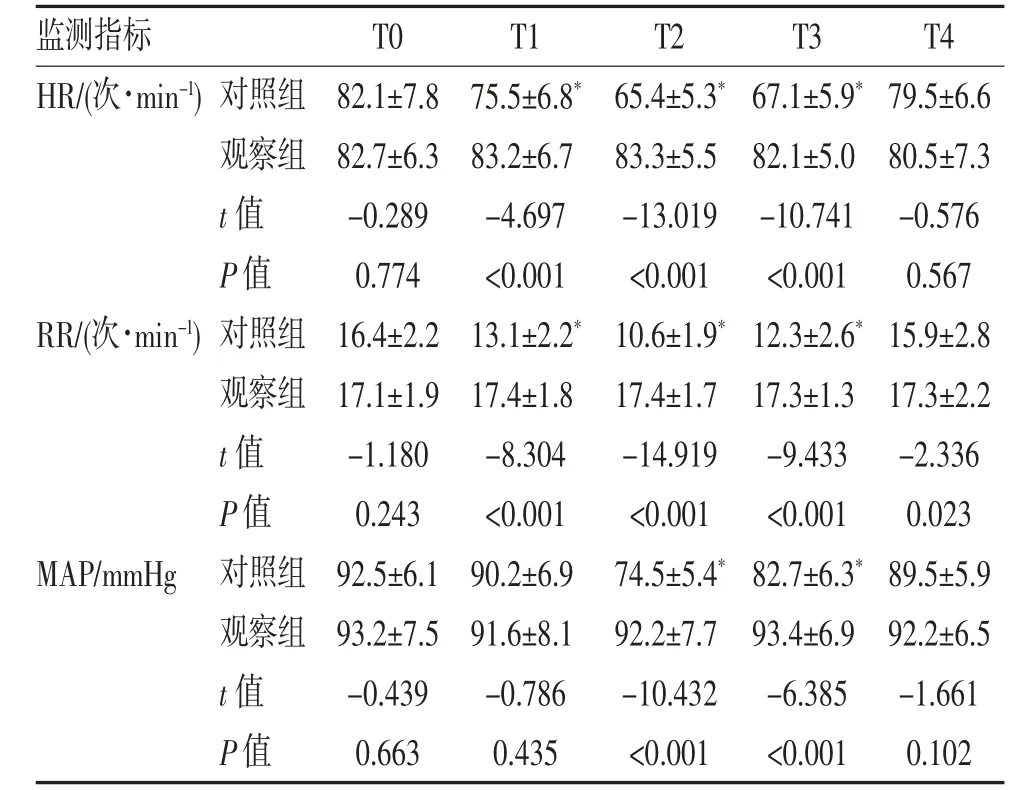
表2 两组患者围术期临床监测指标的比较(,n=30)
注:与T0 比较,*P<0.05。
2.2 两组患者术中追加镇痛和使用血管活性药物情况 两组患者术中追加阿托品者差异无统计学意义(P>0.05);但观察组术中追加使用地佐辛和麻黄碱者少于对照组(P<0.05),见表3。
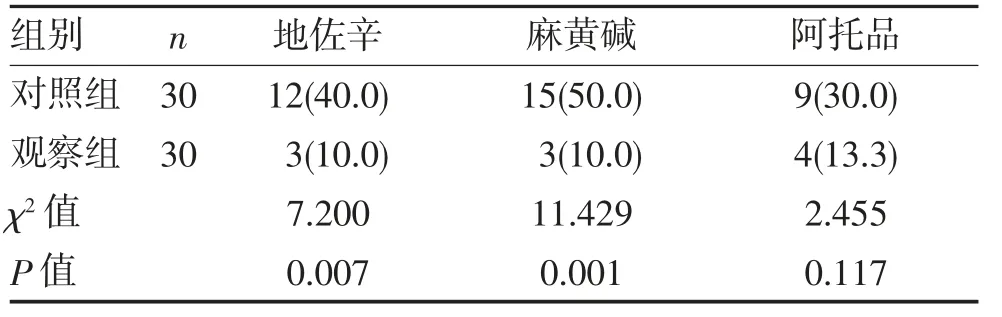
表3 两组术中追加药物情况(n,%)
2.3 两组患者围术期不良反应发生情况 两组患者围术期间均发生不同程度的不良反应,观察组患者体动、呼吸抑制、低血压及恶心呕吐等不良反应发生率均明显低于对照组(均P<0.05),见表4。
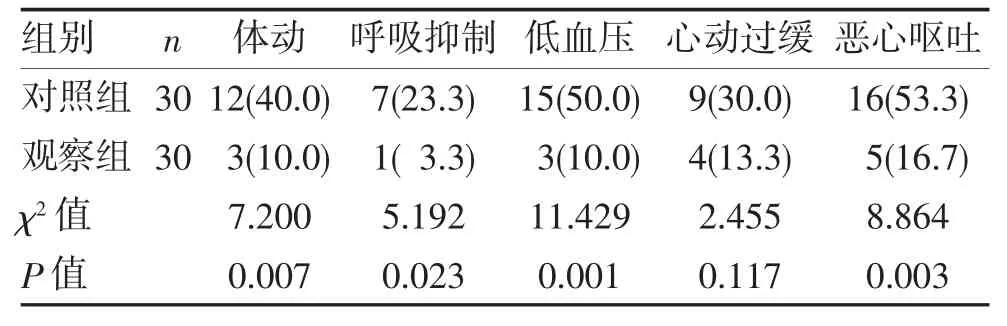
表4 两组患者不良反应发生情况对比(n,%)
3 讨论
介入性诊疗操作技术在放射科变得越来越普遍,这类新型的诊疗技术往往在手术室外开展,这一特点对麻醉支持提出了新的要求,因此需要麻醉医师有特定的思维和策略[9]。疼痛是肺肿瘤消融术最常见的不良反应之一,据统计约46%的患者在治疗过程中发生了难以忍受的疼痛,特别是距离胸壁1 cm以内的肿瘤[10]。这种疼痛来源于消融过程中消融针产生的热量对于壁层胸膜的刺激,壁层胸膜受臂丛和肋间神经支配,和胸壁之间分布着大量肋间神经的分支[11]。对毗邻胸膜的肿瘤进行消融时会损伤肋间神经,刺激产生的疼痛沿肋间神经传入,导致术中和术后的持续疼痛。
目前临床常用的局部麻醉复合阿片类镇痛或阿片类药物复合丙泊酚的静脉麻醉方法常不能满足手术的镇痛需求。本研究中对照组接受静脉麻醉者中12 例需在术中追加地佐辛作为补救镇痛。在镇痛不充足的情况下,患者无法耐受疼痛,导致肿瘤的不完全消融,增加了肿瘤的复发率。而观察组接受TPVB麻醉中仅3 例需追加地佐辛。这一结果说明TPVB可提供较静脉麻醉更好的镇痛效果,大大减少了镇痛药物的使用量。
TPVB 在提供满意镇痛效果的同时,相关禁忌证和不良反应更少,血流动力学更稳定,安全性更高。在本研究中,对照组患者使用地佐辛和丙泊酚后,循环及呼吸系统的波动非常剧烈,术中HR、RR 和MAP 较术前下降幅度较大;而观察组患者生命体征稳定,未发生明显变化。在不良反应方面,观察组患者术中体动、呼吸抑制、低血压以及术后恶心呕吐发生率均明显低于对照组。因此,超声引导下TPVB 用于肺肿瘤消融术最大的优势是减少了阿片类药物和镇静药物的用量,减少了不良反应的发生,大大提高了手术的安全性。考虑到接受肺肿瘤消融手术患者年龄多较大,基础情况较差,因此TPVB 的这一优势具有非常重要的意义[12]。
TPVB 相较于静脉麻醉的另一个重要优势是患者在术中可充分保留自主意识,能很好地配合手术医师做出吸气或屏气的动作以便于肿瘤的定位,或单次手术中多处肿瘤需消融时变换体位。此外,患者常需在侧卧位或俯卧位下接受消融手术,静脉麻醉不利于患者紧急情况下的气道管理及处置抢救。对于这类体位要求较高的手术,相较于静脉麻醉,TPVB 更有优势。
TPVB 的不足之处是不能阻断迷走神经,在消融过程中会发生胸膜反应,主要表现为HR 下降。本研究结果显示,两组患者使用阿托品的情况差异无统计学意义。有研究[13]建议充分麻醉附近胸膜,并适当应用镇静药物,缓解患者的紧张情绪,可能有助于减少胸膜反应的发生。
综上所述,超声引导下TPVB 可以满足肺肿瘤消融术镇痛的需求,相较于静脉麻醉,其安全性更高,不良反应较少,可以作为一种理想的麻醉方式推广使用。
