CYP1B1 抑制剂在心力衰竭细胞模型中缓解铁死亡的机制研究*
2023-05-25苏忆玲周嘉彬史嘉玉
王 力,苏忆玲,周嘉彬,俞 涛,陈 楚,陆 齐*,史嘉玉*
(南通大学附属医院心血管内科,南通 226001)
心力衰竭是一种高度异质性疾病,是各种心血管疾病包括冠心病、心肌病、瓣膜病和高血压等发展到晚期的共同最终结果[1],而受调节的细胞死亡在心血管病理生理学中发挥着重要作用。在诸如高血压的血流动力学应激下,代偿的心脏表现出心肌细胞肥大,继而导致进行性细胞程序性死亡并最终进入心力衰竭,故如何有效地应对这种细胞死亡,可作为心力衰竭早期干预的新思路[2]。铁死亡是一种新型的非凋亡形式的程序性死亡,它的本质是亚铁催化作用下脂质过氧化物堆积所诱导的细胞死亡[3]。众多研究[4]已表明铁死亡在心力衰竭的发生发展中起重要作用,但其分子机制并不完全明确。
细胞色素P4501B1(cytochromeP4501B1,CYP1B1)是一种血红素硫醇单加氧酶,在病理性心血管组织及多种不同类型的癌症中过度表达[5]。越来越多的证据[6-7]表明CYP1B1 在心血管疾病和癌症中的有害作用,包括扰乱内源性化合物的代谢、致癌代谢物的产生、DNA 加合物的形成、活性氧的产生等,而在心血管疾病中被证明与高血压、心脏肥大、冠心病的关系尤为密切,但对铁死亡的调控尚无报道。研究[8-10]发现,多类CYP1B1 抑制剂,诸如黄酮类、多芬类、芪类、蒽醌类化合物,均可通过特异性抑制CYP1B1 的表达,改善上述心血管疾病及癌症的预后,但目前暂无研究报道其与心力衰竭间的联系。
核因子E2 相关因子2(nuclear factor-erythroid 2-related factor 2,Nrf2)在体内被视为主要抗氧化转录因子,可被Kelch 样ECH 关联蛋白1(Kelch like ECH associated protein 1,Keap1)在细胞质内稳定结合而限制其核转位,Nrf2 下游许多靶基因与铁死亡的关系密切,已经发现它可通过调节铁/血红素代谢、参与烟酰胺腺嘌呤二核苷酸磷酸氧化酶(nicotinamide adenine dinucleotide phosphate oxidase,NADPH)的再生、谷胱甘肽(glutathione,GSH)的合成和代谢等途径影响铁死亡[11]。已有研究[12]表明铁蛋白重链1(ferritin heavy chain 1,FTH1)及溶质载体家族7 成员11(recombinant solute carrier family 7 member 11,SLC7A11)可预防心肌细胞死亡所致的心力衰竭,也有报道[13]发现谷胱甘肽过氧化酶4(recombinant glutathione peroxidase 4,GPX4)在心脏中的保护作用,其均为Nrf2 的下游靶标。近来,有研究[14]对CYP1B1基于CiteSpase 的研究现状进行了网络分析,关键词类聚结果提示其发挥损伤的机制与Nrf2 信号转导通路密切相关,但在心脏疾病中对两者的研究暂未见报道。因此,Nrf2 作为对铁死亡调控的关键分子,与CYP1B1 直接的关系有待阐明。
本课题组通过胸主动脉结扎模型构建了压力负荷型心力衰竭小鼠模型,8 周后取心肌组织行RNA测序,与假手术组相比共发现了73 个差异表达的基因,其中包括CYP1B1,鉴于此前对CYP1B1 的研究多集中于心肌肥大和高血压而并未提及心力衰竭。本研究通过体外实验调控CYP1B1 表达,探索其调控铁死亡的具体作用机制。
1 材料与方法
1.1 材料 C57BL/6 乳鼠(3 日龄)、C57BL/6 小鼠(8周,雄性)购自南通大学实验动物中心(动物伦理号:S20220310-010)。Nrf2 抗体(ABclonal,武汉),β-actin抗体、山羊抗兔二抗IgG(ABcam,武汉),F12 培养基(Hyclone,美国),胎牛血清(Gibco,美国),Ferrostatin-1试剂(Selleck,美国),铁测定试剂盒(ABcam,英国),α-萘黄酮试剂(MedChemExpress,美国),丙二醛(malondialdehyde,MDA)检测试剂盒、GSH 检测试剂盒(碧云天,上海),CPY1B1 检测试剂盒(瑞番,上海)。
1.2 检测方法
1.2.1 小鼠心肌组织RNA 测序 分别取假手术处理、主动脉弓结扎处理8 周后小鼠的心肌组织,提取总RNA 后,去除其中的核糖体RNA,将得到的RNA随机打断成为短片段,以此RNA 片段为模板,用引物合成cDNA 第一链;随后加入缓冲液、dNTPs、RNase H 和DNA polymeraseⅠ合成cDNA 第二链,经过纯化并加厄尔平衡盐溶液洗脱经末端修复、加碱基A,加测序接头,然后通过尿嘧啶-N-糖基化酶降解第二条链。用琼脂糖凝胶电泳进行片段大小选择,进行PCR扩增。最后建好的测序文库用Illumina HiSeqTM 4000 进行测序,得到心力衰竭中差异表达的基因。
1.2.2 原代心肌细胞的提取 在超净工作台内操作,所有器械高压蒸汽灭菌,75%乙醇擦拭乳鼠胸壁,剪出心脏,在PBS 中挤出血细胞和多余组织,后将心脏组织剪成米糊状,用胶原酶反复消化,将消化后的上清液加入有完全培养基的15 mL 离心管中,离心后,弃上清加入适量完全培养基,差速贴壁完成后,继续在培养箱中培养孵育。
1.2.3 实时荧光定量PCR(quantitative real-time PCR,qPCR)从NCBI 中寻找对应的基因CDS 区,由吉玛基因公司提供所合成的引物。CYP1B1:上游5′-AATCCATGCGATTCACCAGC-3′,下游5′-TGTTTGAGGGCTCGTTTTGG-3′;心房钠尿肽(atrialnatriureticpeptide,ANP):上游5′-TCTGAGGTGCCTCCCTGGAC-3′,下游5′-CGCAAGGCTTGGGATCTTTT-3′;B 型钠尿肽(B-natriuretic peptide,BNP):上游5′-TTTGGGCAGAAGATAGACCG-3′,下游5′-TGGCAAGTTTGTGCTGGAA-3′;肌球蛋白重链7(myosin heavy chain 7,Myh7):上游5′-ATGTGCCGGACCTTGGAAG-3′,下游5′-CCTCGGGTTAGCTGAGAGATCA-3′;GAPDH:上游5′-AGTGCCAGCCTCGTCTCA-3′,下游5′-AGGGGCCATCCACAGTCTTC-3′;Nrf2:上游5′-CACATCCAGTCAGAAACCAGTGG-3′,下游5′-GGAATGTCTGCGCCAAAAGCTG-3′。提取各组RNA 后逆转录为cDNA,上机行扩增反应后跟据CT 值测算各组相应mRNA 的表达量。
1.2.4 铁死亡指标测定(1)GSH 测定:用PBS 重悬后取原代心肌细胞沉淀或取心肌组织研磨成粉末,加入蛋白去除试剂,冻融2 次后离心(4 ℃,10 min,10 000 r/min)取上清,按要求加入检测工作液于96孔板,封板后室温孵育,测吸光度值(optical density,OD 值),5 min/次,至30 min,绘制标准曲线并计算GSH 含量。(2)MDA 含量测定:用PBS 重悬后取原代细胞沉淀或取心肌组织匀浆,通过超声裂解后离心(600 r/min,10 min)并取上清,按要求加入检测工作液于96 孔板,置于95 ℃沸水浴15 min,冷却后离心(1 000 r/min,10 min)得上清,测定其在532 nm 波长处的OD 值,绘制标准曲线并计算MDA 含量。(3)Fe2+测定:将原代心肌细胞均匀接种于96 孔板中,按照不同分组给予染色液钙黄绿素乙酰氧基甲酯和2,2′-联吡啶处理,各30 min,根据两者荧光强度的比值测算出各组Fe2+含量。
1.2.5 CYP1B1 测定 取去氧肾上腺素(phenylephrine,PE)刺激后的心肌细胞超声破碎,离心后收集上清,用纯化的抗体包被微孔板制成固相载体,依次加入标本、标准品、生物素化的抗CYP1B1 抗体、HRP 标记的亲和素,经过彻底洗涤后用底物3,3′,5,5′-四甲基联苯胺(3,3′,5,5′-Tetramthylbenzidine,TMB)显色。TMB 在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成黄色。用酶标仪在450 nm 波长下测定OD 值,计算样品浓度。
1.2.6 Western Blot 分析 完成干预后,取各组心肌细胞充分裂解,离心后行二奎啉甲酸法测定蛋白浓度,取等量蛋白加入预先配置的SDS-PAGE 胶后行电泳并转膜,此后封闭2 h,加入Nrf2 一抗(1∶1 000)4 ℃孵育过夜,行充分漂洗后二抗孵育1 h,暗室中完成条带曝光扫描并分析。
1.2.7 免疫荧光染色 将6 孔板使用预冷的PBS漂洗后,加入1 mL 4%的甲醛,室温下固定30 min,充分洗涤,室温阴暗处封闭10 min 后吸净。滴加Nrf2 一抗(1∶50)稀释液,锡纸完全包裹,4 ℃过夜,取出湿盒,洗净后滴加二抗(1∶100)稀释液,37 ℃避光,30 min,充分洗净后封片,共聚焦荧光显微镜观察。
1.3 统计学方法 利用SPSS 23.0 进行数据分析和处理,Graphpad Prism 软件进行绘图。所有结果均以表示,多组间比较采用单因素方差分析,两组间比较采用t 检验,P<0.05 表示差异有统计学意义。GraphPad 分析IC50,R2>0.95 代表曲线拟合度好。
2 结果
2.1 小鼠心力衰竭的细胞模型中CYP1B1 和铁死亡指标表达升高 前期研究通过主动脉弓结扎与假手术组对照,8 周后心超验证手术成功(图1A),并取小鼠心肌组织行RNA 测序,发现CYP1B1 的表达升高(图1B)。使用10 mmol/L PE 刺激小鼠原代细胞72 h 后,与对照组相比,PE 组的CYP1B1 基因表达量明显上升(1C)。此后,进行了铁死亡指标的检测,发现MDA、Fe2+明显升高,而GSH 含量降低,这些都是心肌细胞发生铁死亡时的典型改变,与心力衰竭基因标志物ANP、BNP、Myh7 的表达趋势一致,在经100 nmol/L 铁死亡保护剂Ferrostatin-1 处理后的细胞中可改善(图1D~E)。
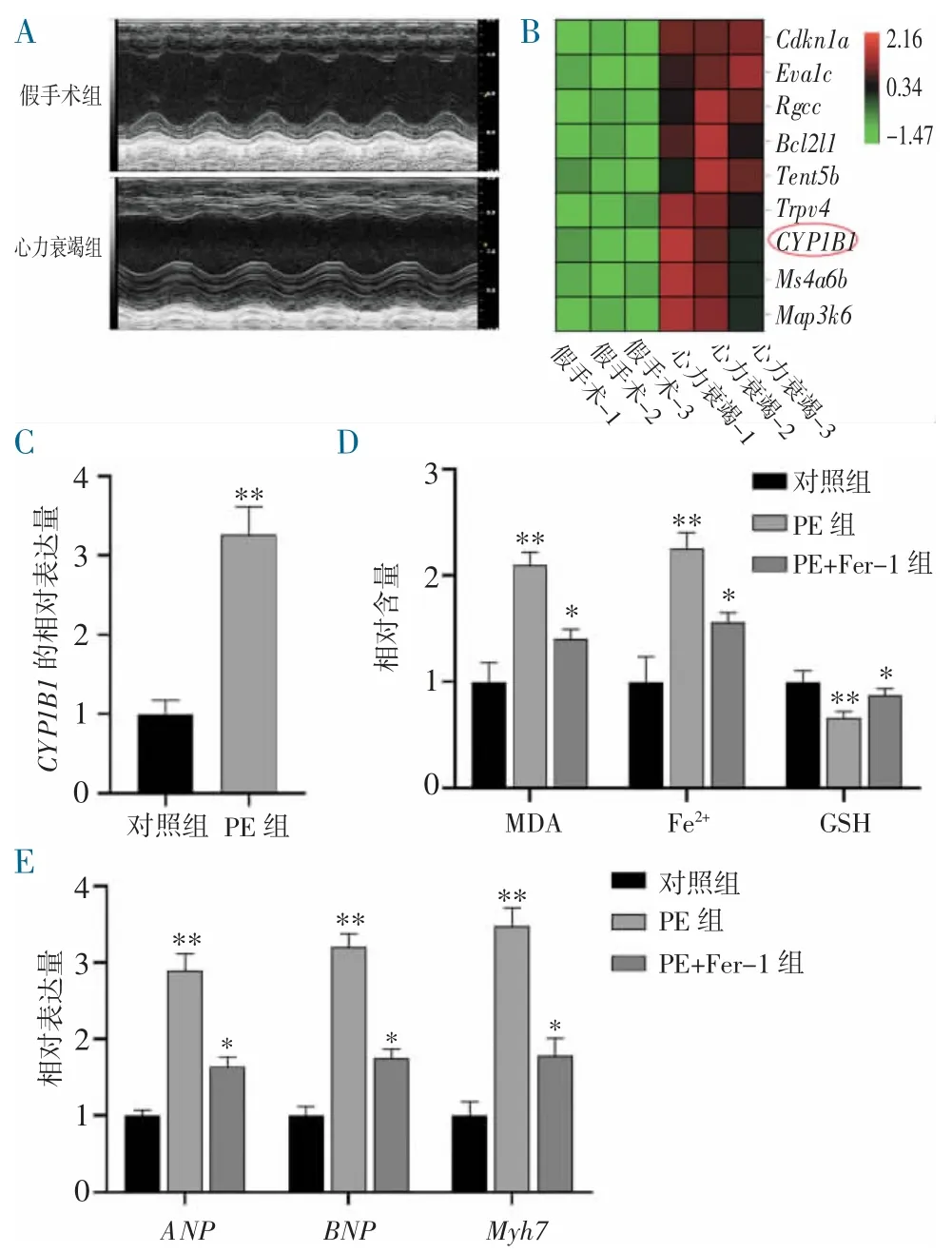
图1 小鼠心力衰竭的细胞模型中CYP1B1、铁死亡和心力衰竭基因表达情况
2.2 CYP1B1 抑制剂可有效改善心肌细胞的铁死亡分别使用0.01、0.1、0.5、1、5、10 nmol/L 的α-萘黄酮(CYP1B1 抑制剂)处理原代心肌细胞后再行PE 刺激,绘制抑制曲线,在5 nmol/L 浓度处可达到对CYP1B1 显著抑制的效果(图2A)。接着,使用不同浓度的α-萘黄酮预处理原代心肌细胞1 h 后,再行10 nmol/L PE 刺激72 h,相较PBS 预处理的PE 组,表现出呈α-萘黄酮浓度依赖性的铁死亡指标MDA、Fe2+下调和GSH 上升(图2B),且心力衰竭基因标志物ANP、BNP、Myh7 下降(图2C),上述结果表明CYP1B1 抑制剂能有效增加心肌细胞的铁死亡抗性。
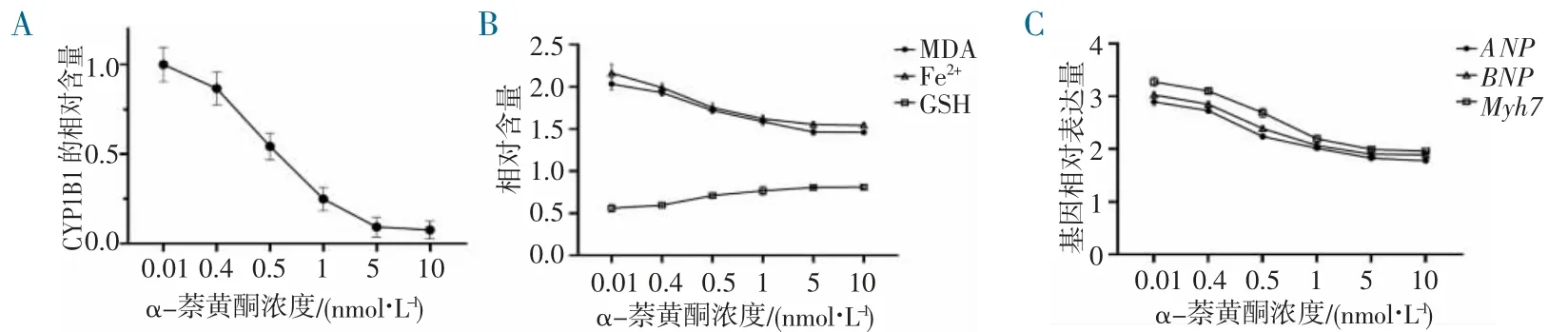
图2 不同浓度α-萘黄酮处理后对心肌细胞的影响
2.3 CYP1B1 抑制剂可回调细胞中Nrf2 的表达分别使用5 nmol/L α-萘黄 酮、100 nmol/L Ferrostatin-1、PBS 预处理心肌细胞后行PE 刺激,结果显示抑制CYP1B1 后能回调细胞中Nrf2 的蛋白表达量但不影响基因表达量(图3A~B),并显著增强了Nrf2 的免疫荧光结果(图3C),这提示了CYP1B1 抑制剂的对铁死亡保护作用可能是通过上调Nrf2 蛋白水平实现,但Ferrostatin-1 处理组并无这种改变。
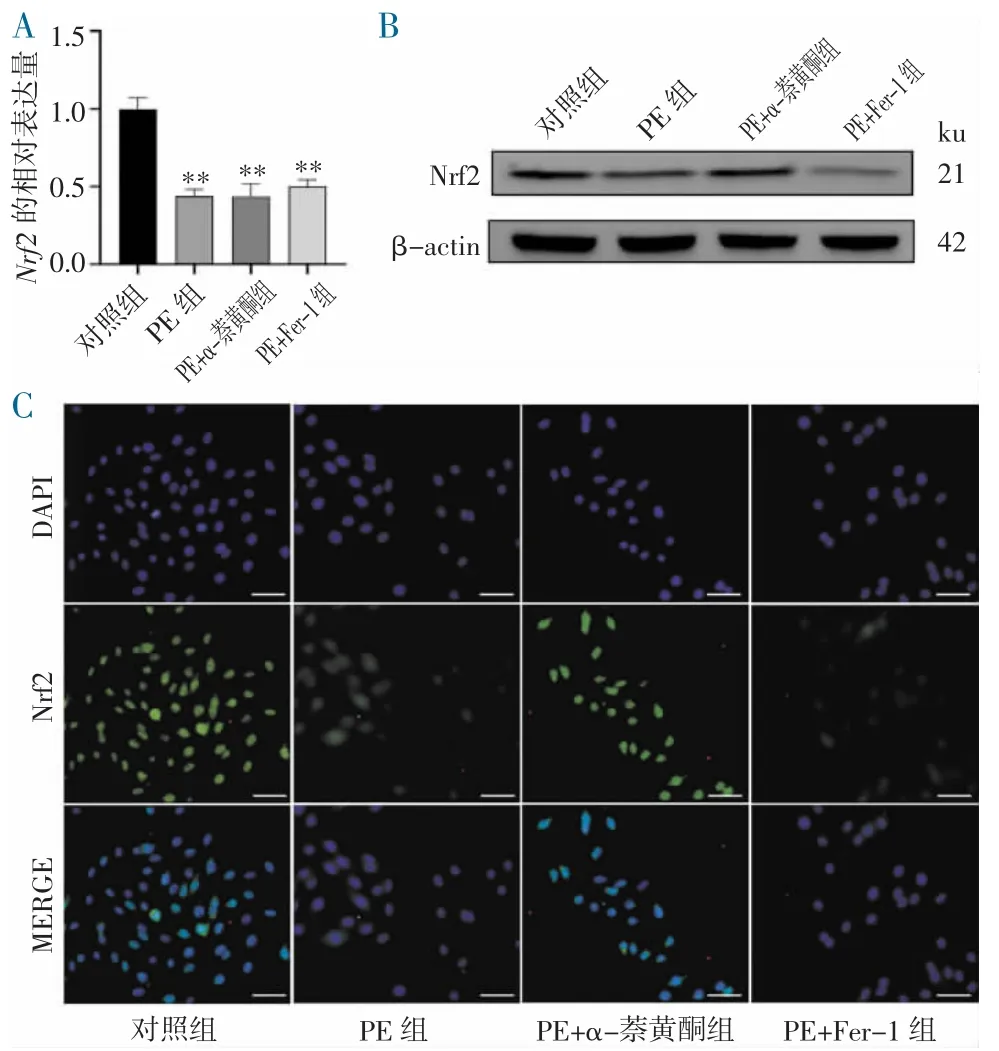
图3 CYP1B1 对Nrf2 的表达影响
3 讨论
CYP1B1 是一种肝外酶,在心血管及多种癌组织中过表达,主要负责内源性和异源性生物的NADPH 依赖性代谢。已有研究[7,15-16]发现,CYP1B1在几种心脏肥大的模型中被诱导,包括异丙肾上腺素、血管紧张素Ⅱ、体内的压力超负荷模型等,其中抑制CYP1B1 介导的中链羟基二十碳四烯酸(hydroxyeicosatetraenoic acids,HETEs)产生已被证明可以预防雄性大鼠的心脏肥大。本研究首次在压力超负荷心力衰竭模型的测序中发现了CYP1B1 的升高,并通过PE 刺激的体外模型中成功验证,这表明CYP1B1可能在压力负荷型心力衰竭中起一定的致病作用。而既往多项研究[6-7,17]发现CYP1B1 可作为活性氧产生的启动分子之一。众所周知,活性氧的生成是细胞发生铁死亡的关键步骤,通过MDA 检测验证了通过抑制CYP1B1 能有效改善脂质氧化物的聚积,这一定程度上增加了心肌细胞的铁死亡抗性。
目前研究[17]已经鉴定了包括黄酮类、香豆素、芪类、蒽醌类、生物碱等多类CYP1B1 的特异性抑制剂,其中黄酮类是饮食中抗氧化剂的主要来源。在黄酮类家族中,α-萘黄酮被认为是Cyp1 类酶的有效抑制剂,尤其对CYP1B1 具有很强的抑制作用,其多种衍生物已被证明在前列腺癌、脂肪肝、乳腺癌等疾病模型中的治疗效应[18-19],但目前对于心力衰竭的作用尚未见报道。本研究发现α-萘黄酮呈浓度依赖性地增强了心肌细胞对铁死亡的抵抗力,且明显回调了心力衰竭基因标志物的表达,因此本研究也为黄酮类在心脏疾病的治疗提供了一定的指导思路。
Nrf2 作为抗铁死亡的关键转录因子,在多种应激状态下可在心肌细胞中发挥其抗氧化活性,其中镉蓄积引起的心脏损伤可同时引起CYP1B1 与Nrf2 的表达改变,但未进一步论证两者关系[20]。此外,P.BOSE等[10]发现在肝癌中可通过调节CYP1B1-Nrf2 抑制肝癌发生。通过CYP1B1 已有的研究行聚类分析[14],提示了Nrf2 可作为铁死亡发生潜在的中间分子,在此基础上,本研究通过抑制剂下调CYP1B1,发现了Nrf2在蛋白水平的表达增加,但基因水平无明显改变,这符合课题组的预期,即CYP1B1 对Nrf2 的调控可能是通过改变其蛋白水平的稳定性实现,而两者是否直接作用及其具体的分子机制有待于往后进一步研究验证。传统的铁死亡抑制剂Ferrostatin-1 并未对Nrf2的表达产生影响,这可能是由于Ferrostatin-1 作为高效的脂质过氧化物清除剂,其铁死亡保护效应并不倚赖于对Nrf2 的靶向调节。此外,在PE 刺激的心力衰竭细胞模型中,Nrf2 的回调是否直接影响铁死亡指标的表达,有待通过靶向Nrf2 调控的研究进一步验证,且上述研究基于心力衰竭的体外模型,而在小鼠体内的作用需后续更多研究来探索。
综上所述,CYP1B1 抑制剂回调了Nrf2 表达量,并增强了心肌细胞的铁死亡抗性,提示CYP1B1 可能作为调节心肌细胞铁死亡的干预靶点,为心力衰竭治疗提供了新的见解。
