腺性膀胱炎的临床及MR表现⋆
2023-05-25黄玲芳黄才胜
陈 炯 黄玲芳 黄才胜 尹 华 陈 江 丁 可,*
1.南宁市第二人民医院放射科(广西 南宁 530031)
2.广西卫生职业技术学院护理学院(广西 南宁 530000)
3.南宁市第二人民医院泌尿外科(广西 南宁 530031)
腺性膀胱炎(cystitis glandularis,CG)是一种少见良性病变,属于膀胱黏膜化生性病变。以往对于CG认识不全面,有部分学者将所有类型的CG均视为癌前病变,继而行无差别电灼、电切、化疗药物灌注等类似肿瘤治疗,有过度治疗之嫌[1],不同类型的CG应有不同的转归。CG确诊需靠膀胱镜检查和病理,病理是金标准,然活检无法反应病变的整体情况;CG临床表现无特异性,尤其与膀胱癌(bladder cancer,BCa)在临床及影像上存在重叠,治疗前对两者进行鉴别至关重要。然鉴别CG与BCa对于病理科医生仍是一个巨大挑战[2],若影像学能对其良恶性进行鉴别可为病理诊断提供有力的依据。关于CG影像学诊断,以往文献多集中在CT和超声,磁共振文献报道较少。本文收集我院7例经病理证实CG患者资料,对其MR表现分析,旨在提高对CG的MR表现认识。
1 资料与方法
1.1 一般资料回顾性分析2015年5月至2022年6月,经病理证实、术前有MRI检查CG患者7例,男6例,女1例,年龄41~78岁,平均年龄59.1岁。临床症状为血尿、尿频、排尿困难等。
1.2 检查方法采用Siemens Magnetom Verio 3.0T超导MRI扫描仪,选择体部相控阵线圈,患者仰卧位。扫描序列包括平扫、动态增强(dynamic contrast-enhanced,DCE)和DWI:平扫SET1WI(TR/TE 450~600ms/12~24ms,层厚5mm,间隔0.5mm)、SET2WI(TR/TE 1000~1600ms/90~95ms,层厚5~6mm,间隔0.5~1.2mm),FSET2WI+脂肪抑制(TR/TE 4400~4900ms/70~95ms,层厚5~6mm,间隔0.5~1.2mm);MRU(TR/TE 4500ms/850~900ms,层厚5~6mm,间隔0.5~1.2mm);DWI扫描采用多B(b=50、500、1000)值横轴位+矢状位。增强前先扫描1期为蒙片后以高压注射器经手背静脉注射钆喷酸葡胺(Gd-DTPA)15mL,注射速率3.0mL/s,剂量0.2mL/kg,同时开始扫描,连续扫11个时相,每个时相扫描时间为16S。
1.3 图像分析观察病灶部位、大小、形态、信号、强化,以膀胱肌层为参考分为明显强化(强化高于肌层)、中等度强化(与肌层相当)、轻度强化(强化低于肌层);5例绘制时间-信号强度曲线(time intensity curve,TIC),TIC曲线类型分为Ⅰ型(渐增型)、Ⅱ型(平台型)、Ⅲ型(流出型)。5例手绘测量病灶表观扩散系数(ADC值),每个病灶测量3次并取平均值。
2 结果
7例CG MR表现为:病灶位于膀胱三角区3例,其中2例同时累及膀胱颈(图1A、1D),顶壁3例,前壁1例;形态上结节增厚型5例、片状增厚型1例、结节型1例,本组无弥漫增厚型;大小为0.3cm×0.3cm×0.4cm~2.4cm×3.8cm×1.2cm;T1WI呈等信号、T2WI(图1A、图2A)及T2压脂呈稍高于肌层信号;DWI等(图2C)或稍高信号(图1B),ADC值范围(1.40~2.09)×10-3mm2/s(图1C、2D),平均值约1.69×10-3mm2/s;5例行动态增强扫描4例明显强化(图1E),病灶早期强化信号明显高于肌层,中晚期持续强化,与肌层相当,1例中度强化(图2B),病灶各期强化与肌层相当,TIC均呈渐增型(图1F、2F)。
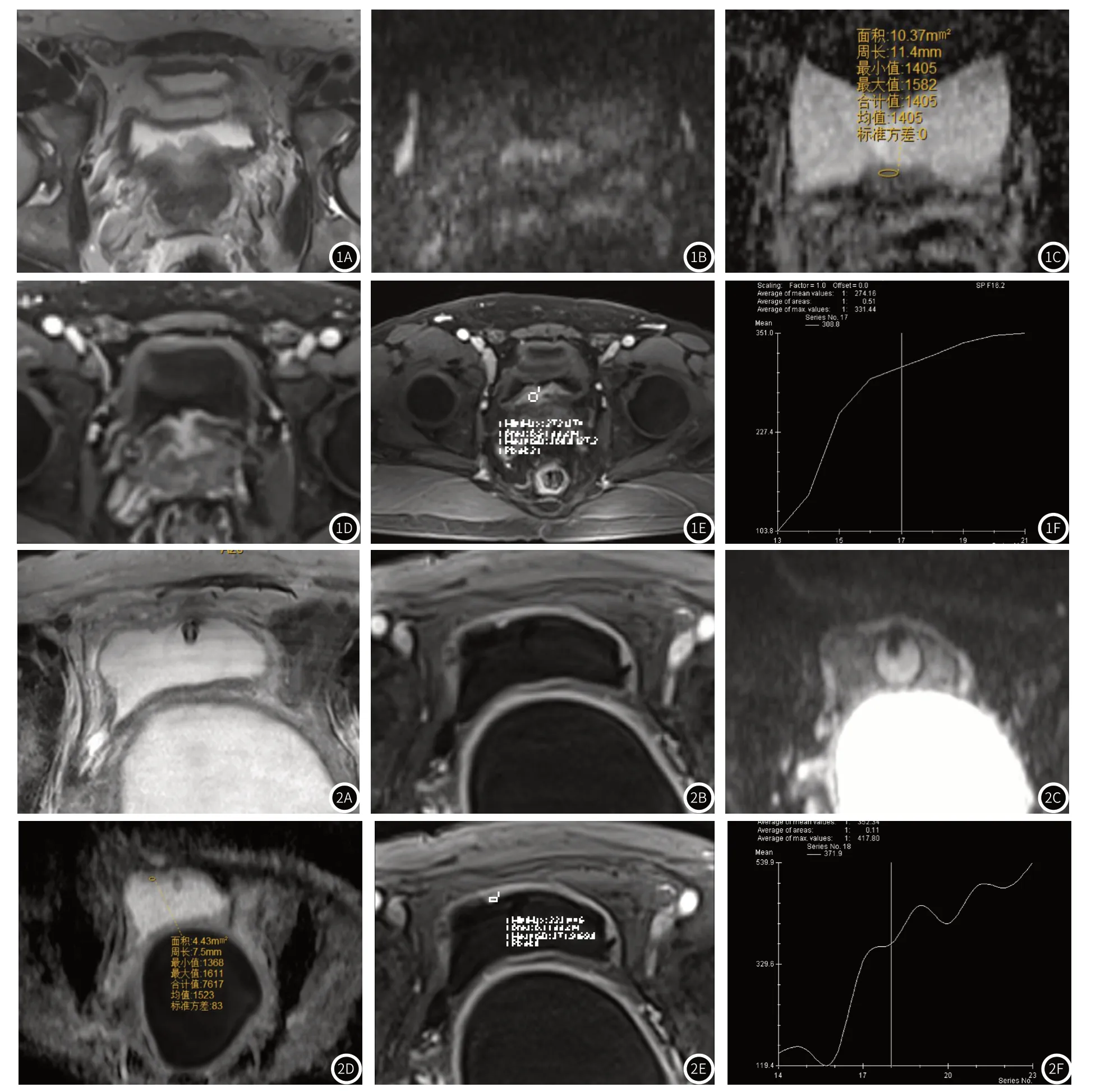
图1A~图1F 男,41岁,解肉眼血尿10余天,膀胱三角-颈部局部黏膜扁平状增厚并结节样隆起(结节增厚型),T2WI稍高信号,DWI(b=1000)稍高信号,ADC值约1.4×10-3mm2/s,TIC为渐增型,膀胱外壁光整。图2A~图2F 女,69岁,尿潴留,宫腔大量积液,膀胱右前壁见局部小结节样隆起(结节型),T2WI稍高信号,DWI(b=1000)等信号,ADC值约1.52×10-3mm2/s,TIC为渐增型,膀胱外壁光整。
3 讨论
3.1 概述
3.1.1 病因及发病机制 CG的病因目前尚未完全明确,一般认为[3-4]与感染、结石、梗阻等慢性刺激有关,也可能与维生素缺乏、变应原、代谢毒性物质、激素分泌紊乱有关[5]。CG是一种病理学概念,目前多认为CG发展和形成是由移行上皮—单纯增生—Brunn’s芽—Brunn’s巢—囊性膀胱炎—腺性膀胱炎一个渐变的过程。
3.1.2 临床表现 常表现为血尿、尿频、尿急、尿痛等,但无特异性,本组3例为解肉眼血尿,2例为前列腺增生相关症状,1例为宫腔大量积液引起尿潴留,1例无自主不适、体检超声发现膀胱病变。
3.1.3 CG与肿瘤之间的关系 目前仍存在争议,有文献报道[6-9]CG可发展为膀胱腺癌(bladder adenocarecinoma,BA),而膀胱癌主要为尿路上皮癌(urothelial carcinoma,UC),其次为鳞状细胞癌(squamous cell carcinoma,SCC),不足2.0%为BA[10-11],而BA多为转移或其他肿瘤浸润,极少为原发,提示CG转化为BA的可能性极低。
3.1.4 临床分型 国内外根据膀胱镜下表现临床分为慢性炎症型、滤泡型、乳头型、黏膜无显著改变型,Yong等[12]报道了肠腺瘤型,亦称红润型,膀胱镜下为鲜红色占位病变;病理分为移行上皮型、肠上皮型、前列腺上皮型。张剑飞[13]等认为临床分型中乳头型、肠腺瘤型及病理分型中肠上皮型、前列腺上皮型应视为癌前病变,移行上皮型并非癌前病变,若病理分型为肠上皮型或前列腺上皮型,慢性炎症型、滤泡型也应视为癌前病变,而临床分为乳头型、肠腺瘤型同时病理分型为肠上皮型、前列腺上皮型恶变概率可能更大。陈志强[1]及王宁[14]等推荐将慢性炎症型、小范围滤泡增生型、黏膜无显著改变型归为低危型,将乳头型、肠腺瘤型、广泛滤泡增生型归为高危型。
3.1.5 发病率及诊疗 CG的发病率仍不清楚,有研究[15-16]显示CG的发病率可能被严重低估,可能与膀胱镜检率、活检率过低有关。诊断依赖超声、MRI、CT及膀胱镜检查+活检,确诊依靠膀胱镜检查+活检。笔者收集近7年内我院有经膀胱镜+活检病理证实为CG的仅有21例,其中行MRI检查的仅7例并均能发现病灶,检出率为100%,而CT及超声均有不同比例的病灶未能检出,本组7例当中有2例CT未能检出病灶,可能与膀胱内血块干扰有关,而MR组织分辨率高、不受此影响。因此当临床怀疑CG而CT及超声又无阳性发现时,建议行膀胱MRI平扫+DWI+动态增强和/或膀胱镜+组织活检。朱光标等研究[17]认为CG的治疗应先去除病因,然后根据病理类型、病变部位、临床表现制定治疗方案,对于药物等保守治疗效果不佳、症状反复发作的患者建议行经尿道病灶电切术。
3.2 MR表现特征MRI具有良好的软组织分辨率,可多方位、多参数成像,无电离辐射,DWI功能成像可ADC值定量,增强扫描对于发现病变、显示病灶具体范围有独特优势,是膀胱病变的重要影像学检查方法。本组病例结合以往文献报道显示,CG的MR表现有一定的特征性。根据以往文献[18-20]影像学将CG分为以下4种类型:结节型,局部膀胱壁结节状隆起;结节增厚型,膀胱壁局部增厚伴结节状隆起;片状增厚型,局部膀胱壁草坪样增厚;弥漫型,累及全膀胱黏膜;本组病例片状增厚型及结节型各1例,主要以结节增厚型居多(5例,占71%),结节增厚型可认为较具特征性形态表现,与倪晓琼等的研究[21]类似;动态增强扫描早期多呈明显强化(4例),强化信号明显高于肌层,中晚期持续强化,与肌层相当,倪晓琼等的研究[21]发现24例CG中有2例于CT增强静脉期出现明显强化,增强前后CT值差均值达107HU,考虑伴有平滑肌组织增生及上皮增生活跃有关;与以往文献报道[18,20]多为轻度强化不同,考虑可能与以往CT增强以测量平扫及增强CT值对比为依据,而本组MR图像以膀胱肌层为参照对比有关,也可能与本组样本量小有关。TIC曲线均呈渐增型,与炎性病变相符,与恶性肿瘤的流出型不同。DWI呈等或稍高信号,ADC值范围(1.40~2.09)×10-3mm2/s,平均值约1.69×10-3mm2/s,与以往文献[18,22]报道相符。CG可发生于膀胱任何部位,以往文献报道病灶多发生于膀胱三角区,本组病例未提示明确的好发部位,考虑可能与本组样本量小有关;T1WI呈等信号、T2WI及T2压脂呈稍高信号,表现无特异性。
3.3 鉴别诊断临床上CG主要与BCa鉴别。CG属良性病变,BCa属恶性肿瘤,治疗方式和预后明显不同。两者的临床表现相似,影像学表现亦存在重叠;可从以下几点进行鉴别:(1)形态,CG多为局部增厚伴结节样隆起,宽基底,而BCa多为菜花样、可带蒂,两者均极少为小结节样或弥漫增厚,形态学可为两者鉴别的重要依据;(2)DWI及ADC,CG在DWI呈稍高或等信号,而BCa为高信号,BCa的ADC值明显低于CG,马普能等研究[23]显示BCa的ADC平均值为0.758×10-3mm2/s,明显低于CG的1.338×10-3mm2/s,两者无交叉,为两者鉴别的重要依据,Wang[22]等研究CG的平均ADC值更高,为1.66×10-3mm2/s,本组与文献报道相符;(3)强化情况,BCa的强化较CG更明显,TIC本组CG均呈渐增型,而BCa的TIC多为平台型,杨甜等研究[24]表明BCa的强化CT值及相对强化CT值均高于CG,与BCa为恶性肿瘤血供丰富有关,而CG内存在Brunn's巢、腺体及囊,仍属于炎症;(4)BCa为恶性病变,可出现区域淋巴结转移、侵犯邻近组织、骨盆转移等,而CG为良性病变,无上述改变,与张晓丹等的研究[25]一致;(5)膀胱壁外缘,由于CG一般不累及浆膜层,外缘光整,而BCaT3≧期时由于肿瘤浸润外缘毛糙或累及周围结构,T2期时由于癌灶牵拉亦表现为外缘凹陷不规整,然而T1期时外缘光整,此时需要根据前面几点鉴别。两者均可发生于膀胱任何部位并好发膀胱三角区,T1WI两者均为等信号,T2WI、T2压脂两者均为稍高信号,CG较BCa稍高,但无法定量,因此部位及平扫信号难以鉴别。
3.4 MR扫描技术膀胱是空腔器官,良好的扫描技术是发现病灶、诊断及鉴别诊断、分期的基础,翟凤仪等研究显示[26]检查前1小时排尿后禁水禁排尿使膀胱适度充盈仰卧位有助于提高膀胱MR图像质量。笔者认为膀胱MR扫描应做到以下几点:(1)扫描前4~6小时禁饮禁食;(2)检查前1小时排尿后禁水禁排尿至扫描结束,导尿管留置者扫描前1小时夹闭导管或检查前经导尿管向膀胱内注水200mL,使膀胱适度充盈,充盈不佳易漏诊小、扁平病灶,而过度充盈易使患者烦躁从而增加运动伪影,还可出现尿液流动伪影,亦会把病变拉平,失去病灶原有形态,易漏诊及给鉴别诊断、累及深度的判断带来影响;(3)采取仰卧位,因俯卧位会使患者呼吸不畅而加剧呼吸运动及体部不适导致不自主运动,增加运动伪影;(4)除T1WI、T2WI及T2压脂序列外,动态增强、DWI序列是重要序列,动态增强扫描应根据平扫情况选择横轴位或矢状位,当病灶位于膀胱顶、底壁时选择矢状位扫描,当病灶位于两侧壁及前后壁时选择横轴位扫描,DWI序列扫描建议横轴位+矢状位均扫描,为了避免增强扫描所致膀胱内造影剂的干扰,DWI序列扫描应在平扫后、动态增强扫描前完成。
3.5 不足之处本研究存在样本量小,亦未能对CG的临床分型与影像进行对照研究;王玉婷等[27]研究提示CT及超声表现为结节样增厚型病例中乳头型占比高,片状增厚型病例中多为滤泡型,弥漫型病变中滤泡型稍多,给今后的研究提供了参考。
综上所述,MRI可清楚显示CG的部位、大小、形态、信号、强化、膀胱壁及壁外情况,在形态、强化、ADC值及膀胱壁外缘具有一定的特征,治疗前可做出较准确诊断,为下一步治疗提供重要依据,确诊还需膀胱镜检查+组织活检。
