脑部MRI联合CT在首发精神分裂症诊断中的应用价值研究⋆
2023-05-25周莉萍孙玉涛
周莉萍 孙玉涛 王 卓
1.唐山市第五医院功能科CT室(河北 唐山 063000)
2.唐山市第五医院心理科(河北 唐山 063000)
3.唐山市开滦总医院核磁室(河北 唐山 063000)
精神分裂症(schizophrenia,SZ)是常见严重脑部疾病,主要特征为基本个性改变、精神活动与环境不协调及情感、思维与行为分裂[1-2]。首发精神分裂症(firstepisode schizophrenia,FES)指首次发作或首次经抗精神药物治疗的SZ,相较于慢性SZ,其具有病程短、不受长期药物治疗及环境因素改变影响等特点,是早期研究SZ脑异常的最佳时机[3]。SZ患者脑形态改变研究已有三十余年历史,取得了很大进展,大量研究证实,FES患者脑结构存在器质性异常,表现为大脑皮层萎缩、脑室扩大等[4-5]。另研究显示,FES患者额叶结构变化,可导致相应区域CT值改变[6]。随磁共振成像(magnetic resonance imaging,MRI)可从分子水平反映机体疾病进展过程,近年来,应用MRI技术研究FES脑损害已引起国外学者广泛关注[7]。基于此,本研究首次探讨脑部MRI联合CT在FES诊断中的应用价值,以期为临床诊治提供依据。报道如下。
1 资料与方法
1.1 一般资料本研究经医院医学伦理委员会审核通过。选取2021年5月至2021年11月唐山市第五医院FES患者83例为观察组,同期选取83例健康体检者为对照组。
纳入标准:观察组均符合《精神障碍诊断与统计手册》[8]中FES诊断标准;对照组为体检志愿者,无精神病史;入组对象均可配合相关检查及调查;入组对象及家属知情同意。排除标准:脑血管病史;合并其他精神疾病;合并器质性疾病;颅内肿瘤;震颤麻痹、亨廷顿病、长期酗酒等;孕妇、哺乳期妇女。
1.2 方法(1)CT检查:采用东软NeuViz 6 In CT扫描仪,行头部轴位扫描(颅底至颅顶),以眶耳线为基准线。参数:管电流170mAs,管电压120kV,层厚、层距=5mm,矩阵512×512,层数24~32,窗位35HU,窗宽80HU。由2名高年资CT诊断医师盲法阅片,分析脑结构CT表现,意见分歧时协商一致,并测量额叶CT值,各自测量,取平均值。(2)MRI检查:采用GE Discovery MR750w 3.0T磁共振超导型扫描仪,标准32通道头线圈,T1WI参数:采用FFE3D,TE=5ms,TR=2000ms,Nex=5,FOV=220×220 mm,FA=150°,矩阵=512×512,层厚1.5mm,无间隔。MRS参数:PRESS序列,感兴趣区选择前扣带皮质区(Anterior Cingulate Cortex,ACC),体素2 cm×2 cm×2 cm,TE=30 ms,TR=1700ms,FA=90°;通过波谱图及数据来反映N-乙酰天冬氨酸(N-acetylaspartate,NAA)、谷氨酸(Glutamate,Glu)相对水平,以Cr为参照物,计算NAA/Cr、Glu/Cr。T2WI参数:FSE序列,TE=94ms,TR=4500 ms,Nex=5,FOV=220×220 mm,FA=90°,矩阵=512×512,层厚2.0mm,无间隔;测量左、右侧ACC T2信号值。(3)认知功能:采用MCCB中文版[9]认知功能评价量表测定认知功能水平,包括信息处理速度、工作记忆、注意/警觉性、视觉学习、词语记忆、社会认知、推理与问题解决7个维度,各维度得分求和再取平均分为最终得分。
1.3 观察指标(1)两组一般资料及MRI、CT参数。(2)FES影响因素的多因素分析。(3)脑萎缩与无脑萎缩FES患者认知功能评分。参考Sato S等[10]报道中脑萎缩检测方法评估脑萎缩情况,CT扫描仪测量两额角最大间距与相同水平颅内最大横径比,额角指数越大则脑萎缩越严重。(4)FES患者额叶CT值、ACC NAA/Cr、Glu/Cr、T2信号值与认知功能评分的相关性。(5)MRI、CT参数对FES的诊断价值。
1.4 统计学处理采用统计学软件SPSS 22.0处理数据,额叶CT值、ACC NAA/Cr、Glu/Cr、T2信号值为计量资料,采取Bartlett方差齐性检验与夏皮罗-威尔克正态性检验确认具备方差齐性且近似服从正态布,以()描述,两组间比较采用独立样本t检验;计数资料用n(%)表示,χ2检验;采用Pearson系数分析FES患者额叶CT值、ACC NAA/Cr、Glu/Cr、T2信号值与认知功能评分的相关性;FES影响因素采用Logistic回归分析;MRI、CT参数对FES的诊断价值采用受试者工作特征(receiver operating characteristic curve,ROC)曲线分析,获取AUC、置信区间、敏感度、特异度及cut-off值,联合预测实施Logistic二元回归拟合,返回预测概率logit(p)作为独立检验变量。均采用双侧检验,α=0.05。
2 结果
2.1 两组一般资料及MRI、CT参数两组年龄、性别、体质量指数、饮酒、吸烟、文化程度、合并症比较,差异无统计学意义(P>0.05);观察组认知功能评分、额叶CT值、ACC Glu/Cr低于对照组,脑萎缩比例、ACC NAA/Cr、ACC T2信号值高于对照组(P<0.05),见表1。

表1 两组一般资料及MRI、CT参数比较
2.2 FES影响因素的多因素分析以FES为因变量(赋值见表2),将表1中差异有统计学意义的项作为自变量(赋值见表2),应用Logistic回归模型分析,结果显示,脑萎缩、额叶CT值、ACC Glu/Cr、认知功能评分降低及ACC NAA/Cr、ACC T2信号值升高均为FES独立危险因素(P<0.05)。见表3。

表2 赋值

表3 FES影响因素的多因素分析
2.3 脑萎缩与无脑萎缩FES患者认知功能评分脑萎缩FES患者认知功能评分(44.18±6.07)分,无脑萎缩FES患者认知功能评分(49.87±7.26)分。脑萎缩FES患者认知功能评分低于无脑萎缩患者(t=3.874,P<0.001)。
2.4 FES患者额叶CT值、ACC NAA/Cr、Glu/Cr、T2信号值与认知功能评分的相关性FES患者额叶CT值、ACC Glu/Cr与认知功能评分呈正相关,ACC NAA/Cr、T2信号值与认知功能评分呈负相关(P<0.05),见表4。

表4 FES患者额叶CT值、ACC NAA/Cr、Glu/Cr、T2信号值与认知功能评分的相关性
2.5 MRI、CT参数对FES的诊断价值以FES患者MRI、CT参数作为阳性样本,以健康体检者MRI、CT参数作为阴性样本,绘制各指标诊断FES的ROC曲线,结果显示,脑萎缩、额叶CT值、ACC NAA/Cr、Glu/Cr、T2信号值诊断AUC分别为0.783、0.815、0.839、0.732、0.758、0.727,应用SPSS软件的联合应用ROC理论模式,构建各指标联合诊断的ROC模型,结果显示,联合诊断AUC最大,为0.933。见图1、表5。
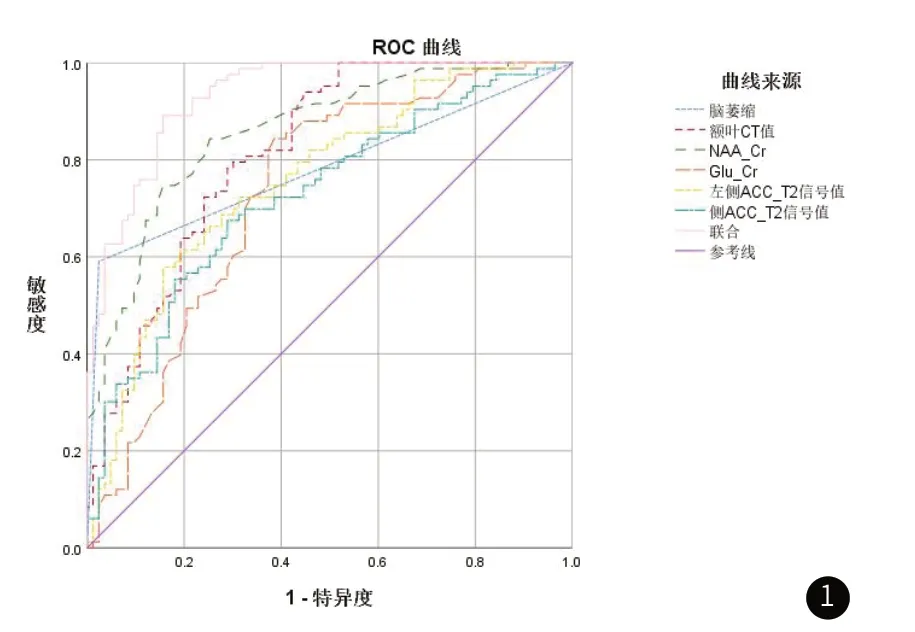
图1 MRI、CT参数对诊断FES的ROC曲线

表5 MRI、CT参数对FES的诊断价值
3 讨论
目前,FES发病机制尚未完全阐明,主要包括神经递质异常、神经发育异常、免疫异常、基因位点与表观遗传学等。FES是导致中重度精神残疾的主要来源,可使患者丧失劳动力,给家庭带来沉重负担,严重者可出现自伤、伤人、冲动、自杀等行为,给社会带来极大危害[11]。因此,FES早期诊断尤为关键。近年来,随脑部CT及MRI技术不断进步,为观察FES患者脑区异常提供条件,逐渐广泛用于FES临床诊断中。
FES患者脑形态异常是大脑广泛区域异常综合的结果[12]。本研究支持这一观点,表明FES患者存在心室扩大和大脑结构异常。从类型来看,皮质型是FES患者最常见脑萎缩类型,与李蓉等[13]报道一致。CT的产生及临床上广泛应用为无创研究脑形态学提供了有效手段。近年来,相关报道日渐增多,多项研究显示,脑部CT扫描可有效发现FES患者脑部结构病变,如脑室扩大、脑体积减小、脑萎缩等异常改变[14-16]。研究指出,阿尔茨海默病、震颤麻痹、亨廷顿病、长期酗酒等均为脑萎缩诱发因素[17]。本研究中排除合并以上疾病的患者,可推断,脑萎缩与FES有直接关系。Logistic回归分析也显示,脑萎缩为FES独立危险因素(P<0.05)。本研究还显示,额叶CT值降低与FES有关,与既往研究[18]一致。大脑额叶是人类新皮质最发达区域,由白质和灰质构成,其中白质由大量有髓纤维组成,灰质由大量神经元相互联系所构成,在判断、运动、情绪感受中发挥特殊作用,并与远期预见及行为控制有关[19]。因此,FES患者大脑额叶皮层变化可能引起该部位CT值发生改变。
1HMRS是研究活体组织代谢的非侵袭技术,敏感度高、稳定性好,用于脑研究可提供神经元功能、能量代谢及神经胶质增生等信息,已在临床研究得到广泛应用[20]。ACC作为边缘系统重要组成部分,功能涉及情感、认知处理过程,在SZ神经生物学研究中备受关注[21]。本研究显示,ACC Glu/Cr降低、NAA/Cr升高为FES独立危险因素。NAA几乎在所有神经元中均存在,被认为是神经元完整性的标志物。Glu是神经系统中作用最广泛、含量最高的氨基酸,对神经活动决策密切相关[22]。Glu高表达,可引起细胞突触后膜Glu受体过度激活,钙离子大量内流,促发酶联反应,诱导神经元凋亡[23]。因此,推测Glu水平升高可能是FES患者脑萎缩的重要因素。另外,NAA被认为是Glu的生物储存器,二者通过三羧酸循环进行生物学链接[24]。推测Glu高表达引起NAA过度消耗可能是FES患者NAA水平降低的重要原因。研究显示,MRI T2信号较T1信号对组织病理改变更为敏感,而组织中含水量变化是最重要病理改变,如神经胶质增生、组织囊性变等[25]。本研究测量FES患者ACC双侧T2信号值改变,FES患者ACC双侧T2信号值均升高。提示FES患者ACC区含水量升高。结合1HMRS研究,推测原因可能为,FES患者ACC区Glu高表达引起NAA水平降低,神经元完整性损害,进而引起胶质增生、细胞水肿等病理改变,同时,病理改变反向损害Glu神经递质功能,形成恶性循环,最终导致ACC结构损害。
认知功能障碍是FES核心症状之一,且伴随其发生发展的整个过程[26]。本研究还发现,脑萎缩的FES患者认知功能评分显著降低,且脑萎缩单独诊断FES的特异度达93.59%。分析主要是因额叶、ACC均是大脑认知功能的关键脑区,随其病理改变可出现认知损害,临床可针对不明病因的认知功能降低患者检测脑萎缩情况以早期发现FES危险群体,但单一指标检测难免存在片面性。本研究进一步构建多指标联合诊断的ROC模型,结果显示,MRI、CT参数联合诊断FES的AUC值为0.933,高于单独诊断,提示脑部MRI联合CT在FES早期诊断有重要价值。但本研究不足之处在于首次对此项内容进行研究,样本来源单一,所得结论在人群中的典型代表性仍需继续探讨。
综上可知,脑萎缩、额叶CT值、ACC Glu/Cr降低及ACC NAA/Cr、ACC T2信号值升高均为FES独立危险因素,可为FES早期诊断提供新的思路,且各参数均与认知功能损伤密切相关。
