基于农杆菌介导法将CP4-EPSPS基因转入玉米自交系B73的研究
2023-05-24韩平安唐宽刚李晓东王力伟梁亚晖石海波吴新荣
韩平安,常 悦,唐宽刚,李晓东,王力伟,梁亚晖,杨 静,石海波,吴新荣
(1.内蒙古自治区农牧业科学院,内蒙古 呼和浩特 010031;2.内蒙古自治区甜菜品种遗传改良与种质创制重点实验室,内蒙古 呼和浩特 010031)
玉米是世界第一大粮食作物,其产量占全球总谷物产量的37.2%[1]。玉米也是我国重要的粮食、饲料与工业原料,在我国农作物生产中占有重要地位。统计数据表明,玉米已成为我国播种面积最大的主要粮食作物[2-3],玉米产量对确保我国粮食安全至关重要。杂草是玉米生产上的主要危害之一,也是严重影响玉米产量的重要因素。传统的人工除草劳动强度大,工作效率低。随着玉米产业化发展及劳动力短缺问题的出现,目前杂草防治主要依赖除草剂进行化学防治,具有高效、经济、省力等优点[4-5]。
草甘膦凭借其广谱、高效、成本低等特点,被广泛用于防治各种一年生或多年生杂草,是世界上销售量最大的除草剂[6]。草甘膦属于非选择性除草剂,也被称为灭生性除草剂,在灭杀杂草的同时也会非选择性地灭杀农作物[7],因此,培育抗除草剂作物是防治杂草最为经济、有效的措施,既能解决杂草问题,又能避免除草剂对作物产生的毒害作用。根据草甘膦的抑制作用原理,能使作物获得草甘膦抗性的途径主要有作物内源抗草甘膦基因(CP4-EPSPS)的过量表达、外源抗草甘膦基因的转入表达、降解修饰解除草甘膦毒害作用[8-11]。目前,主要通过转入抗性的CP4-EPSPS基因培育抗除草剂作物,采用该方法已培育出水稻[12-13]、棉花[14]、大豆[7]、玉米[15]等多种抗草甘膦作物。
玉米自交系B73具有优异的组培特性,是一种广泛用于转基因研究的受体品种。为了开发具有自主知识产权的抗除草剂玉米品种,本研究以玉米自交系B73幼胚为受体材料,利用甜菜分子育种课题组前期构建的含抗草甘膦基因(CP4-EPSPS)的植物表达载体,通过农杆菌介导法进行遗传转化,获得草甘膦抗性植株,通过PCR、qRT-PCR、ddPCR和草铵膦抗性鉴定,获得转基因植株T1代种子,为培育抗除草剂玉米新品种奠定基础。
1 材料和方法
1.1 试验材料
玉米自交系材料B73种子,由内蒙古自治区农牧业科学院玉米研究所提供。质粒pBWA(V)BUEPEPS(结构简图见图1)、农杆菌EHA105由甜菜分子育种课题组保存。培养基组分见前期研究[16],引物由南京市金斯瑞公司合成,引物序列见表1。

图1 质粒结构简图Figure 1 Plasmid structure diagram

表1 引物信息Table 1 Primer information
1.2 试验方法
1.2.1 遗传转化与植株再生
取授粉后10~15 d的玉米果穗,用75%酒精进行表面消毒后,剥取1.0~1.5 mm大小的幼胚进行农杆菌侵染,果穗消毒以及侵染转化方法参考韩平安等[16]、FRAME等[17]。将侵染后的幼胚转移到灭菌滤纸上吸去多余菌液,放入共培养基中,使盾片向上,置于25℃条件下暗培养3 d。之后转入恢复培养基上,28℃暗培养7 d。随后转入含有2 mg/L植物筛选标记草铵膦(PPT)的筛选培养基Ⅰ中,培养14 d。转入筛选培养基Ⅱ中培养2轮,每轮14 d,进行愈伤组织分化。将筛选后长势良好的抗性愈伤转入到再生培养基上,进行不定芽分化,培养条件为28℃,光照时间为18 h/d。当不定芽长到1.5~2.0 cm时将其移入生根培养基中进行生根培养,获得抗性植株。
1.2.2 转基因植株PCR检测
为验证外源基因是否插入到B73基因组中,剪取抗性植株与野生型植株幼叶,采用试剂盒法提取植株基因组DNA。利用CP4-EPSPS基因特异性引物(1F/1R)进行PCR扩增。PCR扩增体系(12.5滋L):2×Taq PCR Master Mix 6.25 滋L,上、下游引物各为0.5 滋L(10 滋mol/L),模板 0.5 滋L,4.75 滋L ddH2O 补足体系。PCR扩增程序为94℃ 5 min;94℃ 30 s,58 ℃ 45 s,72 ℃ 1 min,30个循环;72 ℃ 10 min。1%琼脂糖电泳检测扩增结果。
1.2.3 转基因植株qRT-PCR检测
取PCR检测阳性植株叶片提取总RNA并反转录成 cDNA,RNA的提取和 cDNA的合成按照TakaRa公司RNA试剂盒和M-MLV反转录试剂盒说明书进行。将cDNA稀释成200 ng/μL做模板,以玉米18S为内参基因对引物特异性进行实时荧光定量PCR(qRT-PCR)检测。反应体系(20 μL):2×SYBR Premix Ex Taq 10 μL,上下游引物(10 μmol/L)各0.5 μL,模板(cDNA)2 μL,ddH2O 7 μL。PCR 扩增反应在Light Cycler 480(Roche,瑞士)上进行。扩增曲线反应条件:95 ℃ 5 min,95 ℃ 10 s,60 ℃ 30 s,循环40次,72℃单点检测信号。溶解曲线反应条件:95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s,连续检测信号。采用2-ΔΔCt法分析EPSPS相对表达量,并进行差异显著性分析。
1.2.4 转基因植株ddPCR检测
采用探针法对经过qRT-PCR检测合格的阳性植株进行数字PCR(ddPCR)检测。以玉米单拷贝蜡质基因Waxy为内参基因,对转基因植株进行CP4-EPEPS基因拷贝数检测。反应体系(20 μL):ddPCR Supermix for Probes(No dUTP)10 μL,上下游引物(10 μmol/L)各 0.9 μL,探针(10 μmol/L)0.5 μL,模板 DNA 1 μL,ddH2O 4.4 μL。反应程序:95 ℃ 10 min;94 ℃ 30 s,60 ℃ 60 s,40个循环;98 ℃ 10 min,4 ℃保存。PCR扩增反应在QX200数字PCR仪(Bio-Rad)上进行。反应完毕后,将PCR产物放入微滴读取仪中,依据荧光信号的有无对阳性微滴和阴性微滴进行判定读值,通过最终绝对定量结果筛选单拷贝植株。
1.2.5 转基因植株的草铵膦抗性鉴定
将阴性植株以及ddPCR检测为低拷贝的阳性植株组培苗炼苗2~3 d,移栽到装有灭菌营养土的花盆里保湿培养5~7 d。在五叶一心期,用棉签蘸有120 mg/L草铵膦(PPT)涂抹第4片叶距离尖端1/3处,涂抹长度为2 cm,观察植株受害情况。
1.2.6 转基因植株T1代种子的获得
将PPT抗性植株转移到步入式培养箱(Percival PR-1218)继续培养,培养箱温度为25℃,光照18 h/d,相对湿度60%。花期进行人工套袋自交授粉,种子成熟后,收获转基因植株T1代种子。
2 结果与分析
2.1 抗性植株的获得及PCR鉴定
通过农杆菌介导法对玉米自交系B73幼胚进行遗传转化,双丙氨膦抗性筛选获得181株转化植株(图2)。利用CP4-EPSPS基因特异性引物进行PCR扩增检测,其结果见图3,181株转化植株中共有12株扩增出片段大小为521 bp,与阳性对照片段大小一致,初步证明目的基因已经整合到B73染色体基因组中,转化率为6.6%。

图2 B73幼胚遗传转化Figure 2 Genetic transformation of young embryo B73
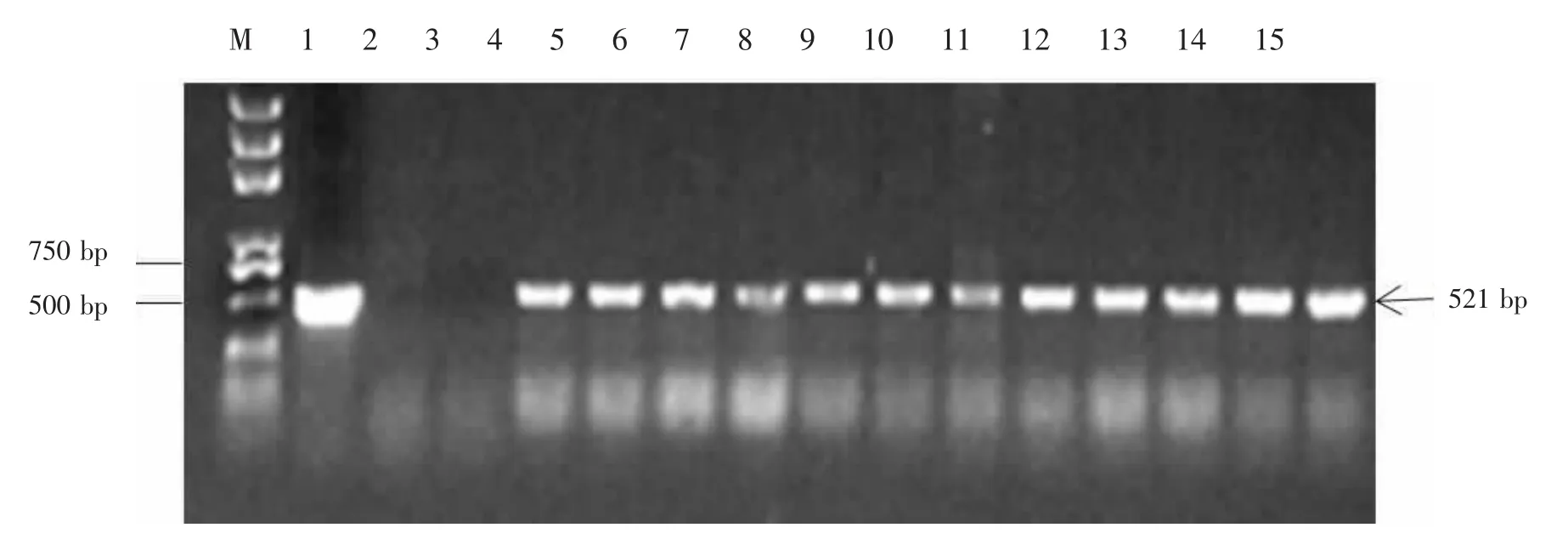
图3 转基因植株PCR检测Figure 3 PCR detection of transgenic plants
2.2 转基因植株qRT-PCR分析
对PCR检测为阳性的植株进行qRT-PCR检测。结果表明,12株转基因植株中CP4-EPSPS基因均能在转录水平正常表达(图4),其中,2、6、8 和 9号株系中,CP4-EPSPS的相对表达量较高。

图4 转基因植株qRT-PCR检测Figure 4 RT-PCR detection of transgenic plants
2.3 转基因植株ddPCR分析
采用探针法对12株转基因植株进行CP4-EPSPS拷贝数检测。以玉米单拷贝Waxy基因为内参基因,对CP4-EPSPS基因引物特异性和扩增体系进行检测。结果表明,本研究设计的引物探针内外源基因都能正常扩增且两种荧光信号彼此不干扰,内外源基因可在同一反应体系中进行,且阴性反应孔和阳性反应孔的荧光信号能明显区分(图5),说明引物特异性和反应体系均满足ddPCR分析要求。通过对12株转基因植株进行拷贝数分析,表明转基因植株中CP4-EPSPS基因插入拷贝数在1~5,其中低拷贝(拷贝数低于2)植株5株(表2),且3号和5号植株为单拷贝植株。

图5 引物二维散点图Figure 5 Two-dimensional scatter plot of primers

表2 转基因植株CP4-EPSPS基因拷贝数分析Table 2 CP4-EPSPS gene copy number analysis of transgenic plants
2.4 转基因植株的草铵膦(PPT)抗性鉴定
对ddPCR检测为低拷贝的5株转基因植株进行PPT抗性试验。结果表明,涂抹PPT(120 mg/L)7 d左右,对照(非转基因苗)叶片涂抹PPT的部位呈现焦枯状态,而转基因植株叶片依然保持绿色,几乎没有任何影响(图6)。综合分子检测和苗期抗性鉴定分析,可以确定目的基因已经整合到玉米基因组中,且正常表达。

图6 转基因植株PPT抗性鉴定Figure 6 Identification of PPT resistance of transgenic plants
2.5 转基因种子的获得
将PCR检测为阳性的B73植株全部放入步入式培养箱中培养(图7),待花期对转基因植株进行人工套袋自交授粉,收获低拷贝T1代种子5份(图8)。

图7 步入式培养箱中的转基因植株Figure 7 Transgenic plants in walk-in incubator

图8 低拷贝转基因植株T1代种子Figure 8 T1seeds of low copy transgenic plants
3 讨论与结论
杂草是玉米生长过程中影响产量的主要因素之一,利用转基因技术培育抗除草剂玉米材料已成为控制玉米杂草危害的一种重要手段。本研究在玉米B73中转入CP4-EPSPS基因的同时引入了抗草铵膦基因BAR,一方面可以作为转化的筛选标记基因,另一方面可以赋予转基因作物除草剂耐受性,便于田间管理[18]。在进行遗传转化时,首先通过BAR基因筛选获得抗性植株,之后通过分子检测获得CP4-EPSPS转基因植株,最后对转基因植株进行PPT抗性鉴定。结果发现,转基因植株对PPT有抗性,表明检测方法有效,且能更方便快捷开展转基因植株的筛选工作。
玉米是单子叶植物,并不是农杆菌的天然宿主,农杆菌介导的玉米遗传转化一直存在转化效率低的问题[19]。郭春艳等[20]以玉米自交系Y423幼胚为材料,农杆菌介导法的转化效率为5.9%。曹爽等[21]以玉米自交系W9816幼胚为受体,农杆菌介导法的转化效率为4.3%。本研究基于甜菜分子育种课题组前期研究基础,以玉米自交系B73幼胚为外植体,转化效率为6.6%,与已报道的玉米自交系转化效率差距不大,后期将对转化体系进一步优化,以提高转化效率。
关于转基因植株中外源基因拷贝数的检测方法主要有早期的Southern印迹杂交和qRT-PCR以及近年来兴起的ddPCR方法。Southern印迹方法杂交试验周期长,杂交过程繁琐,耗时费力[22]。qRT-PCR方法需要建标准曲线,摸索反应体系反应条件比较繁琐[23],且qRT-PCR是相对定量,检测结果可能不准确[24]。ddPCR方法属于一种目的基因的绝对定量技术,其最大的优点就是无须依赖标准品构建标准曲线来实现目的基因的定量[25],具有更好的准确度、精密度和重复性,可用于精确测定靶基因的拷贝数[22]。本研究分子检测结果表明,EPSPS基因已成功插入玉米基因组中,5个株系为低拷贝植株且有2个植株以单拷贝形式插入,确保了CP4-EPSPS基因表达稳定性。低拷贝数是确保转基因事件中外源基因稳定的一个重要条件,避免多拷贝插入产生“共抑制”[26]。
本研究采用农杆菌介导法对玉米自交系B73的幼胚进行CP4-EPSPS遗传转化,通过对目的基因进行PCR、qRT-PCR、插入拷贝数以及草铵膦抗性鉴定,获得转基因植株12株,转基因植株中外源基因在转录水平上均能正常表达,获得低拷贝株系5个,获得T1代转基因植株低拷贝种子5份。建立了以玉米自交系B73为受体的遗传转化体系,对我国抗草甘膦除草剂玉米的研究具有一定的参考价值,为培育高产优质的玉米新种质具有重要意义。
