背侧胰腺发育不全、MODY5一例临床及HNF-1β基因变异分析
2023-05-23曹冰燕陈永兴卫海燕
吴 雪 杨 威 曹冰燕 陈永兴,* 卫海燕
1.郑州大学附属儿童医院河南省儿童医院郑州儿童医院内分泌遗传代谢科(河南 郑州市 450053)
2.首都医科大学附属北京儿童医院国家儿童医学中心内分泌遗传代谢科(北京 100045)
背侧胰腺发育不全(agenesis of dorsal pancreas,ADP),是一种罕见的先天畸形[1-2],可合并糖尿病、胰腺炎等多种并发症,且可伴随多种器官发育畸形[1,3]。截至目前,国内外报道的ADP有一百例左右,但仅有小部分合并糖尿病[4]。现对河南省儿童医院内分泌遗传代谢科诊治的一例人类肝细胞核因子1β基因(Hepatocyte Nuclear Factor 1β,HNF-1β)新变异引起的ADP、青少年起病的成人型糖尿病(maturity-onset diabetes of the young,MODY,OMIM#137920)5型患儿,进行临床及遗传学特点分析,以提高临床医生对本病的早期识别,避免漏诊。
1 对象与方法
1.1 对象患儿,女,11岁,以“多饮半年”入院,无明显多尿、多食、易饥、消瘦等糖尿病的典型症状。患儿系G1P1,母孕33周因“妊娠高血压”剖宫产,出生体重1.8kg,Apgar评分不详,否认窒息抢救史。生后母乳喂养,6月添加辅食,8月断奶,生长发育与同龄儿基本相仿,1年前月经初潮,现月经规律,周期28天左右,经期6-7天,月经量正常,无痛经。家族史:外祖母“高血压、糖尿病”,口服药物治疗中(具体不详),家族中无其他糖尿病病人。
体格检查:身高155cm,体重55.6kg,BMI:23.14kg/m2,神志清,精神可,体型偏胖,全身皮肤无紫纹,黑棘皮征阴性,皮肤弹性正常,腹壁皮下脂肪厚度约2cm。心肺腹、脊柱四肢、神经系统查体无异常。双侧乳房B4期,大小阴唇发育正常,阴毛PH3-4期。
辅助检查:血、粪常规:无异常。尿常规:尿微量白蛋白弱(+),余正常。血生化:镁偏低0.53mmol/L(参考范围0.7-1.0),余正常。静脉血浆葡萄糖升高16.93mmol/L(参考范围3.8-6.1),同期胰岛素9.43uU/mL(参考范围2.6-24.9),C肽1.94ng/mL(参考范围1.1-4.4)。糖化血红蛋白明显升高10.25%(参考范围<6.5%)。血清抗谷氨酸脱羧酶抗体、胰岛素自身抗体都是阴性的。肾早损:尿微量白蛋白偏高23.4mg/L(参考范围0-20),尿β2微球蛋白偏高320.0ug/L(参考范围0-300),余正常。25-羟基维生素D偏低8.4ng/mL(参考范围>20)。血气分析、血氨、血尿淀粉酶、血脂肪酶、甲状腺功能和抗体、性激素、ACTH-Cor、IGF-1、免疫功能、肿瘤标志物:无明显异常。血糖平稳后,停止应用胰岛素,完善馒头餐试验,对胰岛素分泌功能进行评估(表1)。心电图、甲状腺+心脏+子宫附件彩超:无明显异常。腹部彩超提示胰腺体、尾显示不清(胰头轮廓欠清晰,内部回声尚均匀,大小约33.5×23.2mm,胰体、胰尾显示不清),余无异常。上腹部平扫+增强CT:胰头稍饱满(图1),胰体及胰尾未见明确显示—考虑背侧胰腺发育不全。上腹部平扫+增强MRI+MRCP:1.胰体和胰尾未见明确显示(图2),主胰管未见明确显示,考虑为胰腺变异、胰腺发育不全;2.MRCP未见异常。

图1 箭头所指部位为稍饱满的胰头。图2 箭头所指部位为缺失的胰体、胰尾。图3 患儿HNF-1β基因存在杂合变异c.748T>C,患儿父亲、母亲、外祖母均未携带该变异。

表1 馒头餐试验(5-10分钟口服馒头140g),测静脉血浆葡萄糖和C肽结果
诊疗经过:该患儿入院后,积极给予糖尿病知识教育,糖尿病饮食,加强运动,监测血糖、血酮体、血压,给予胰岛素泵持续皮下输注胰岛素进行强化治疗(赖脯胰岛素,初始剂量0.8iu/kg.d)等糖尿病综合治疗方案,血糖平稳后,逐步减少赖脯胰岛素用量,于入院第11日,逐渐减少并完全停用外源性胰岛素,仅口服二甲双胍(0.5g,bid)单药治疗,血糖控制平稳,病情好转出院。
随访:患儿出院后继续口服二甲双胍治疗,随访至今共1年6个月,1-3个月复查1次,血糖基本平稳。患儿在4个月前,自行停药,没有规律监测血糖。因监测末梢血糖Hi,糖化血红蛋白10.8%,于2个月前再次住院治疗,住院期间给予长效胰岛素(德谷胰岛素)联合二甲双胍口服治疗,血糖平稳后,再次完善OGTT评估胰岛β细胞功能(表2),结果提示:患儿胰岛β细胞功能较前明显下降,叮嘱患儿及家长,必须严格遵医嘱治疗,切勿随意停药。
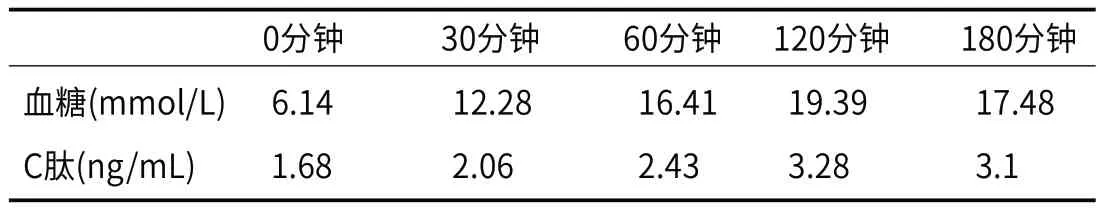
表2 口服葡萄糖耐量试验(OGTT),测静脉血浆葡萄糖和C肽结果
1.2 方法全外显子基因测序分析:本研究取得患儿监护人知情同意,经河南省儿童医院医学伦理委员会审批(2021-K-045)。采用EDTA抗凝管抽取患儿及其父母、外祖母静脉血各2mL,由北京凯昂医学检验实验室利用高通量测序仪(Illumina HiSeq X),对已知致病基因的大约20000个外显子区域及其毗邻剪接区域(约50bp)进行测序,然后运用BWA软件与UCSC提供的hg19版本人类基因组参考序列进行比对,数据解读参考美国医学遗传学和基因组学学会(Americal College of Medical Genetics and Genomics,ACMG)遗传变异分类标准与指南。针对已知的相关的基因变异进行分析,采用一代Sanger测序技术验证变异位点,同时验证患儿双亲和外祖母样本。
2 结 果
高通量测序结果显示,患儿的HNF-1β基因存在杂合变异c.748T>C(p.Y250H),变异位点位于17号染色体的3号外显子上(转录本编号为NM_000458),对患儿父母及其外祖母进行Sanger一代测序验证,结果显示三人均无该基因位点变异,提示为患儿自身的新发变异(PS2,图3),该变异位于热点突变区域,和/或位于已知无良性变异的关键功能域(PM1),检索EXAC数据库、ESP数据库、千人数据库及相关文献,发现该变异在正常人群中发生频率为0(PM2),为未报道过的新变异,多种统计方法预测该变异(c.748T>C)均为保守区域(GERP++,4.94,Conserved),会对基因或基因产物造成有害影响(PP3):SIFT(-,-);polyphen 2(0.997,Probably_damaging);Mutation Taster(1.0,Disease_causing),依据ACMG遗传变异分类标准与指南,该变异的评级为:疑似致病性变异Likely pathogenic(PS2+PM1+PM2+PP3),致病性较高,可导致常染色体显性遗传的青少年起病的成人型糖尿病5型(MODY5)。
3 讨 论
HNF-1β基因,又名TCF2基因,位于17号染色体,含有9个外显子,编码转录因子HNF-1β。HNF-1β蛋白有3个功能区域,分别为N端二聚体结构域、DNA结合结构域及C端转录激活结构域。本研究中HNF-1β基因的新变异位点c.748T>C位于17号染色体的第3个外显子上,可导致第748位碱基由T变为C,由编码酪氨酸变为编码组氨酸,从而使HNF-1β蛋白失去相应功能,不能正常发挥转录因子作用。
背侧胰腺发育不全(ADP)是一种罕见的先天性畸形,属于常染色体遗传病,按背侧胰腺、胰管完全或者部分缺失,分为两个亚型:完全性和部分性ADP[1-2],可合并多种并发症或器官发育畸形,如糖尿病、胰腺炎、泌尿系统、生殖系统发育畸形。本例患儿腹部影像学提示胰头稍饱满,胰体、胰尾、主胰管未见明确显示,归类为完全性ADP。与ADP的发生发展有密切关系的基因,主要包括人类同源异型基因GATA4、GATA6及HNF-1β[5]。HNF-1β基因对胰腺内分泌细胞的分化和发育、胰腺结构的发育均具有调控作用,有相关研究报道,HNF-1β基因对于调控背侧胰腺的分化发育具有重要作用[6]。
HNF-1β基因同时为MODY5的致病基因。在西方发达国家,MODY约占糖尿病患者总数的1~2%,而MODY5占比更少,仅占5%左右[7]。由于各类MODY的基因变异类型不一样,治疗方案、预后亦不一样。HNF-1β基因广泛存在于胰岛细胞核、肝肺肾及生殖系统[8、9],如果该基因发生变异,可导致靶基因表达和组织细胞发育、分化出现异常,例如多囊肾、输尿管扩张、肝囊肿、阴道发育不全、畸形子宫等[8-10]。本文中的患者入院之初因体型偏胖(BMI 23.14kg/m2)、病程较长、胰岛素分泌功能尚可、无酮症倾向,且其外祖母患有糖尿病,初步诊断为2型糖尿病,但在完善腹部彩超时发现患儿胰腺发育存在异常,进一步完善了腹部CT及MRI+MRCP,提示存在背侧胰腺发育不全,考虑为特殊类型糖尿病可能性大,积极完善全外显子基因检测,结果提示患儿HNF-1β基因存在杂合变异c.748T>C,且患儿父母、外祖母在该基因位点均未发现变异,证实患儿为HNF-1β基因新发变异导致的背侧胰腺发育不全、MODY5。
有研究显示,胰岛细胞大量减少(减少50~60%)不一定导致临床糖尿病[11、12],因为残留的胰岛细胞可以释放足够多的胰岛素,但由于胰岛细胞大部分位于胰腺体尾部,完全性ADP通常会造成胰岛细胞数量不足,造成糖尿病[13、14]。同样有研究显示,ADP患者残存的胰岛细胞在儿童时期是足够使用的,当进入青春期或者胃肠道感染等应激时,机体需要的胰岛素急剧增加,而此时残存的胰腺细胞不能代偿,因而发展为临床糖尿病[15],这或许可以解释本研究中的患儿在儿童时期并没有糖尿病的相关表现,而在进入青春期、月经来潮后逐渐出现多饮、血糖升高等情况。
本文中的患儿同时存在低镁血症,可能与肾脏失钾有关,既往已有的研究显示[16],携带HNF-1β基因变异的患者较其他病因所致肾脏畸形的患者血镁更低,可能是由于HNF-1β与Na+-K+-ATP酶的亚单位膜离子通道蛋白2(FXYD2)的启动子结合[17],导致肾小管对镁的重吸收减少有关。因此,对于有多种脏器发育异常、低镁血症等表现的糖尿病患者,应提高基因检测的警惕性。本研究患儿目前除ADP、糖尿病、低镁血症外,尚未发现其他临床表现,需密切跟踪随访。
HNF-1β基因变异导致的ADP、MODY5为常染色体显性遗传疾病,临床表型广泛,全面认识本病的症状和体征,有助于在临床工作中更多地识别此类患者,避免漏诊,早期明确诊断,有助于优化诊疗、判断预后和提供遗传咨询,避免再生育同种疾病的后代,减轻患者本人和家庭、社会的负担。
