贝莱斯芽孢杆菌微胶囊制备及其防治番茄枯萎病的应用评价
2023-05-23彭启超张志鹏黄德龙魏浩李俊王莹邓祖科王宗抗
彭启超 张志鹏 黄德龙 魏浩 李俊 王莹 邓祖科 王宗抗




摘要 以前期分离筛选获得的生防菌贝莱斯芽孢杆菌DTP-03为研究对象,将其制备成贝莱斯芽孢杆菌微胶囊菌剂,并通过随机质心对微胶囊的制备工艺进行优化,最终微胶囊的制备条件:海藻酸钠浓度为2.05%,氯化钙浓度为1.90%,壳聚糖浓度为0.85%,菌液:海藻酸钠为1∶2.5,经测定其微胶囊包埋率可达99.0%以上。贝莱斯芽孢杆菌DTP-03微胶囊的稳定性试验表明,在不添加任何保护剂的条件下35 d后,贝莱斯芽孢杆菌活菌数的保存率为79.91%。通过盆栽试验验证其对番茄枯萎病的防治效果,盆栽试验结果表明,贝莱斯芽孢杆菌DTP-03微胶囊菌剂对番茄枯萎病的防效达76.00%,相比于未包膜的菌体,应用后防效提升了18.75%,表明微胶囊包膜技术能提升贝莱斯芽孢杆菌的生防效果,为今后贝莱斯芽孢杆菌微胶囊菌剂的应用开发提供一定的前期基础。
关键词贝莱斯芽孢杆菌;微胶囊;随机质心映射优化;番茄枯萎病;防效
中图分类号S436.412文献标识码A
文章编号0517-6611(2023)08-0152-04
doi:10.3969/j.issn.0517-6611.2023.08.035开放科学(资源服务)标识码(OSID):
Preparation of Bacillus velezensis Microcapsules and Its Application Evaluation on the Control of Fusarium wilt of Tomato
PENG Qi-chao ZHANG Zhi-peng HUANG De-long et al(1.Beijing Long Age AMMS Biological Technology Co.,Ltd.,Beijing 101200;2.Shenzhen Batian Ecotypic Engineering Co.,Ltd.,Shenzhen,Guangdong 518105)
AbstractIn this study,the biocontrol bacterium Bacillus velezensis DTP-03 obtained in the early stage was selected as the research object.It was prepared into Bacillus velezensis microcapsule,and the preparation process of microcapsule was optimized by random centroid.The final preparation conditions of the microcapsule were as follows:the concentration of sodium alginate was 2.05%,the concentration of calcium chloride was 1.90%,the concentration of chitosan was 0.85%,and the concentration of bacterial solution:sodium alginate was 1∶2.5.The embedding rate of the microcapsule was determined to be more than 99.0%.The stability test data of Bacillus velezensis DTP-03 microcapsule showed that after 35 days without adding any protective agent,the preservation rate of Bacillus velezensis viable bacteria was 79.91%.Finally,the pot experiment was conducted to verify its control effect on Fusarium wilt of Tomato.The results of the pot experiment showed that the control effect of Bacillus velezensis DTP-03 microcapsule on Fusarium wilt of tomato reached 76.00%,and the control effect increased by 18.75% compared with the uncoated bacteria,indicating that the microcapsule coating technology can improve the biocontrol effect of Bacillus velezensis,it provides a certain preliminary basis for the application and development of Bacillus velezensis microcapsules in the future.
Key wordsBacillus velezensis;Microcapsule;Random-centroid optimization;Fusarium wilt of tomato;Control effect
植物病害是威脅农业安全生产的重要因素,化学农药的长期大量使用使得病原菌产生一定抗药性,同时对人、畜和环境产生了危害,由农药引起的食品安全和环境污染问题已经受到广泛关注[1-2]。因此,采用高效、低毒、环境友好的治理技术替代传统单一依靠化学农药来防治植物病害是生产中亟待解决的问题[3]。
芽孢杆菌具有繁殖快、抗逆性强、杀菌效果好、且能诱导植物抗病性及促生增产等优点,在植物病害生物防治中被广泛研究和应用[4-5]。贝莱斯芽孢杆菌(Bacillus velezensis)是一种新型生防细菌,由Ruiz-García等[6]在2005年发现并命名,其作为芽孢杆菌属的一个新种,因其具有丰富的代谢产物和生理功能而受到学者们更多的青睐[7]。李生樟等[8]研究发现贝莱斯芽孢杆菌 504 能够抑制水稻细菌性条斑病菌在水稻叶片中的生长,也有研究表明贝莱斯芽孢杆菌在防治黄瓜霜霉病、马铃薯疮痂病和早疫病等方面也具有较好的应用潜力[9-11]。然而生防微生物在土壤中发挥功效的必要条件就是保障其在环境中的存活率和稳定性[12],现阶段,微胶囊技术是维持微生物的菌存活率和菌稳定性的较好方法之一[13]。生物微胶囊是将微生物包埋在合适的成膜材料中,从而可以有效地保护菌体活性及囊内其他活性物质的有效性,避免外界环境不良因素的伤害和噬菌体的入侵,提高菌体在冷冻、储存和定殖过程的存活率 [14-15],利用生物微胶囊技术与生防微生物菌种相结合制备成效果更优的生防菌剂是未来的发展趋势。
因此,笔者以北京世纪阿姆斯生物工程有限公司前期分离筛选获得的生防菌贝莱斯芽孢杆菌DTP-03为研究对象,将其制备成贝莱斯芽孢杆菌微胶囊菌剂,并对微胶囊的制备工艺进行优化,随后通过盆栽试验测定贝莱斯微胶囊菌剂对番茄枯萎病的防治功效,为今后贝莱斯芽孢杆菌微胶囊菌剂的应用开发提供一定的前期基础。
1材料与方法
1.1材料
1.1.1菌株。番茄枯萎病病原菌(Fusarium oxysporumf.sp lycopersici,Fol)由中国农业科学院植物保护研究所提供。贝莱斯芽孢杆菌DPT-03菌株由北京世纪阿姆斯生物工程有限公司从土壤中分离并保存。
1.1.2培养基配制。LB培养基和PDA培养基的配制参考方中达[16]的方法。
1.2方法
1.2.1菌株活化。吸取冻干管中保存的贝莱斯芽孢杆菌DTP-03 1 mL,加入100 mL的LB液体培养基中,随后放置摇床中120 r/min、32 ℃培养24 h,然后取活化菌液涂布到LB固体培养基平板中,放至培养箱,32 ℃培养24 h后观察菌落无杂菌,保存备用。吸取冻干管中保存的番茄枯萎病病原菌1 mL,加入到100 mL的PDA液体培养基中,随后放置摇床中120 r/min、37 ℃培养24 h,然后取活化菌液涂布到PDA固体培养基平板中,放至培养箱,37 ℃培养24 h后观察菌落无杂菌,保存备用。
1.2.2贝莱斯芽孢杆菌微胶囊菌剂的制备。以海藻酸钠和壳聚糖为壁材,以贝莱斯芽孢杆菌DPT-03为芯材,用挤压法制备贝莱斯芽孢杆菌-海藻酸钠/壳聚糖微胶囊,制备方法:取适量的菌液与灭菌的海藻酸钠溶液混合均匀后,在搅拌速度为400 r/min的情况下,用直径0.45 mm的无菌注射器将此混合液滴加到CaCl2溶液中,固化30 min后,用无菌水洗涤2次后收集微胶囊,洗涤液收集备用。将收集的微胶囊在搅拌速度为600 r/min的条件下加至壳聚糖溶液中覆膜40 min后洗涤2次,4 ℃保存,洗涤液收集备用。
1.2.3RCO优化微胶囊制备的随机选择。影响微胶囊内活菌数的因子包括海藻酸钠浓度、壳聚糖浓度、氯化钙浓度、菌液與海藻酸钠混合比等因素,设定4个因素及其变化范围,分别为海藻酸钠浓度1.0%~2.5%;氯化钙浓度1.0%~2.5%;壳聚糖浓度0.5%~1.5%;菌液/海藻酸钠(V/V)0.16~1.00。优化指标设定为每粒微胶囊内的总活菌数。将以上影响因素及其变化范围输入到RCO程序并运行,随机选择得到的微胶囊制备条件见表1,并根据表1的优化方案进行试验。
1.2.4RCO优化微胶囊制备的质心选择和映射优化。将随机选择的试验结果输入到RCO程序进行质心选择,得到针对每种检测目标的优化方案,并按照方案进行。根据质心选择试验得到的发酵目标值分别输入RCO程序中并进行映射优化,针对每一个发酵目标给出一个最佳发酵方案。
1.2.5微胶囊包埋率的测定。微胶囊的包埋率是微胶囊所包埋的活菌数占总活菌数的百分比。微胶囊制备后,溶液内、胶囊表面和内部都含有活菌,测定其所有的活菌数即为总菌数;测定溶液内以及微胶囊表面的活菌数即为未包埋的活菌数;总菌数与未包埋的活菌数之差即为微胶囊所包埋的活菌数。包埋率计算公式:
微胶囊包埋率=(总活菌数-未包埋的总活菌数)/总活菌数×100%
1.2.6生物微胶囊存储稳定性的测定。将微胶囊与菌液均于4 ℃保存,每隔7 d采用平板稀释法检测一次微胶囊及菌液中的菌体浓度,连续测定35 d。
1.2.7生物微胶囊菌剂在盆栽试验中防病能力的测定。将番茄苗播种于灭菌基质中,当番茄苗长出6片真叶时,进行移苗。采用直径约15 cm的塑料盆,盆底垫20目尼龙网,每盆装土约2 kg,将番茄苗移栽至盆中,每盆3株。使用20 mL番茄枯萎病病原菌孢子液对每株番茄植株进行灌根,24 h后添加相应菌剂,试验共设3个处理,每个处理设9盆。处理①添加贝莱斯微胶囊菌剂10粒,微胶囊浓度为10-7 CFU/粒;处理②添加贝莱斯芽孢杆菌菌悬液1 mL(菌悬液浓度为10/mL);处理③清水对照。期间浇水、追肥、防治病虫害等管理措施一致,待番茄苗生长30 d后调查病情,计算发病率及防效,计算公式:
发病率=发病株数/调查总株数×100%
防效=(对照组发病率-处理组发病率)/对照组发病率×100%
1.3数据处理试验数据采用Excel 2007和Prism-GraphPad 5.0进行统计与分析。
2结果与分析
2.1RCO随机优化结果根据RCO随机选择给出的微胶囊制备优化方案,进行微胶囊制备试验,在各组微胶囊制备结束时,测定各组的总活菌数。各试验组的活菌数见图1,9号配方具有最高的菌数,平均可达5.67×10 CFU/粒,4号配方微胶囊成型效果最差,菌数最少,仅为0.33×10CFU/粒。
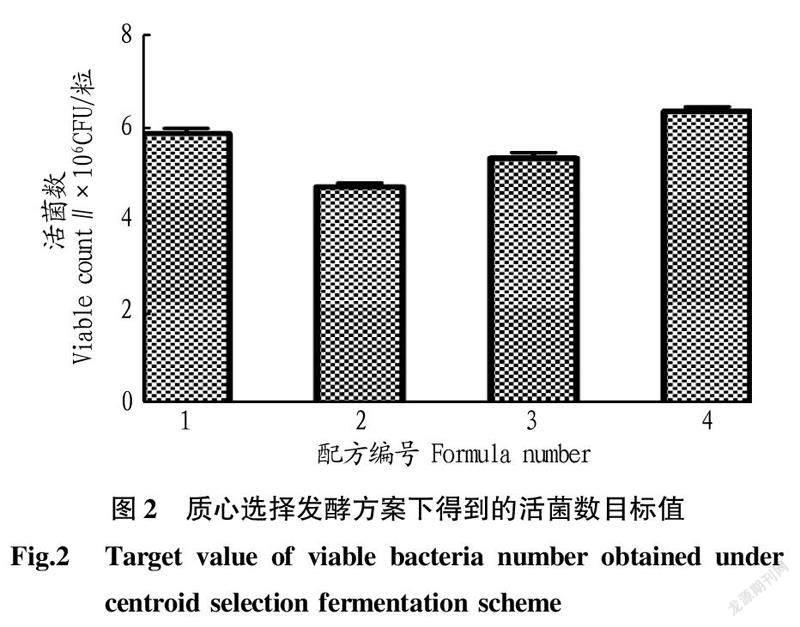
2.2RCO质心优化结果将随机选择的试验结果输入到RCO程序进行质心选择,得到针对每种检测目标的优化方案,并按照方案进行优化,优化方案见表2。根据质心选择的条件进行试验得到相应试验组的总活菌数(图2),结果表明4号方案中海藻酸钠浓度为2.05%,氯化钙浓度为1.90%,壳聚糖浓度为0.85%,菌液/海藻酸钠为0.40时具有更多的活菌数,可达6.34×10 CFU/粒。
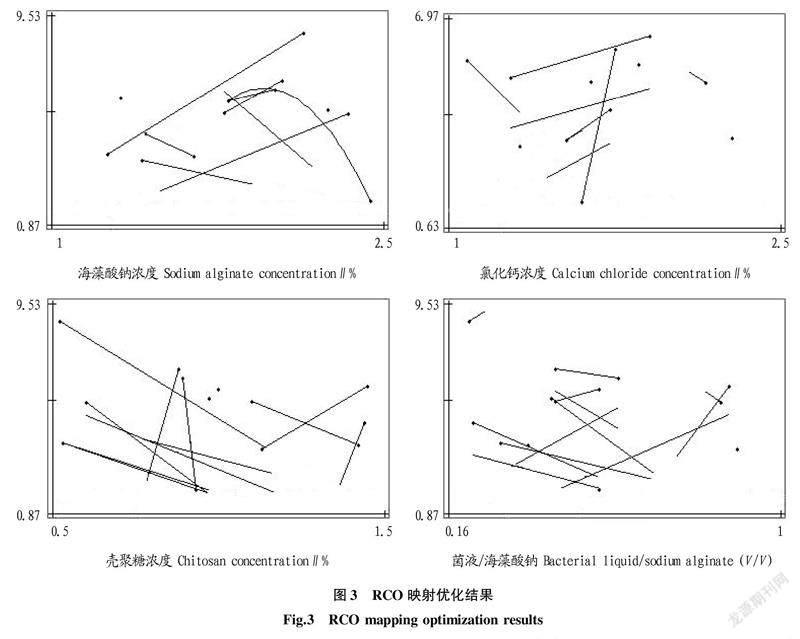
2.3RCO映射优化结果将质心选择得到的目标值再次分别输入RCO程序中进行映射优化,针对每个目标给出一个最佳试验方案,映射优化结果见图3。由图3可知,在微胶囊的制备过程中海藻酸钠浓度、壳聚糖浓度和菌液与海藻酸钠比的趋势线均比较集中,表明海藻酸钠浓度、壳聚糖浓度和菌液与海藻酸钠比对微胶囊活菌数的影响最为显著,而氯化钙浓度并不是影响菌数的主要因子。根据RCO优化结果,最终微胶囊的制备条件:海藻酸钠浓度为2.05%,氯化钙浓度为1.90%,壳聚糖浓度为0.85%,菌液∶海藻酸钠为1∶2.5。
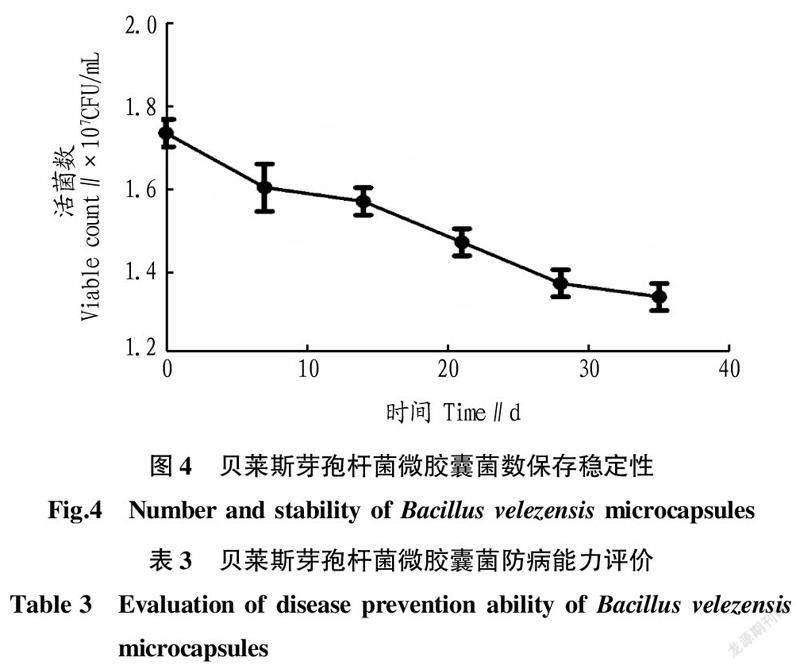
2.4微胶囊包埋率与存储稳定性试验结果表明制备贝莱斯芽孢杆菌微胶囊过程中包埋率可达99.0%以上,生物微胶囊的稳定性试验结果见图4,在不添加任何保护剂的条件下35 d后,贝莱斯芽孢杆菌活菌数的保存率为79.91%。
2.5贝莱斯芽孢杆菌微胶囊菌剂防病能力评价试验结果表明,接种番茄枯萎病菌后,处理①的防效为76.00%,处理②的防效为64.00%。同样施用贝莱斯芽孢杆菌的处理①和处理②相比,利用微胶囊技术包膜后的贝莱斯芽孢杆菌的防效提升了18.75%,表明贝莱斯芽孢杆菌生物微胶囊对番茄枯萎病具有良好的生防效果,且采用微胶囊技术包膜后的防效更优(表3)。
3结论与讨论
微胶囊技术是指使用聚合物基质将具有功能性的生物活性材料包裹制备成微观容器的一种手段,微胶囊技术已广泛应用于药物递送、生物活性物质保护以及益生菌类产品开发等领域[17-18]。微胶囊主要是通过不同壁材的优化选择来保证芯材的生理生化性能,良好的壁材能够保护芯材不受外部环境因素的损害[19-20]。海藻酸钠由于其优良的稳定性、溶解性、黏性和安全性以及生物相容性,是良好的微胶囊外壳组成物质,而且海藻酸钠储量丰富、可再生,海藻酸钠制备的微胶囊被广泛应用[21]。
海藻酸钠分子与壳聚糖分子在特定条件下会发生复合凝聚,随着在溶液中的溶解度降低,包覆在芯材周围凝聚形成微囊[22]。该研究采用海藻酸钠-壳聚糖作为其壁材,将前期获得的生防贝莱斯芽孢杆菌DPT-03制备成生物微胶囊菌剂,并采用随机质心映射优化技术将制备过程中各影响因素的条件进行优化,最终获得最优的微胶囊制备条件:海藻酸钠浓度为2.05%,氯化钙浓度为1.90%,壳聚糖浓度为0.85%,菌液∶海藻酸钠为1∶2.5。表明氯化钙-海藻酸钠对固定化有益微生物有较好的保护作用,在不同生理条件下,益生菌的存活率和功效表现比没有微囊化的菌体有明显提升[23-24]。该研究中微胶囊包埋率可达99.0%以上且在不添加任何保护剂的条件下35 d后微生物活菌数的保存率达79.91%。
乔紫璇[25]将贝莱斯芽孢杆菌FZB42制备成微胶囊能显著提升菌数的保藏性,明显减缓菌数的下降速率,同时将贝莱斯芽孢杆菌FZB42和枯草芽孢杆菌168、枯草芽孢杆菌OKB105和假单孢菌Pf-5制备成的复合微生物胶囊菌剂对纹枯病的防治效果达81.19%,对稻瘟病的防治效果达84.78%,具有提升防控效果和作物产量的功效。王琴等[26]研究表明,将短短芽孢杆菌HAB-05、枯草芽孢杆菌A178、萎缩芽孢杆菌制备成微生物胶囊,短短芽孢杆菌HAB-05和枯草芽孢杆菌A178对芒果炭疽病菌防治效果有明显提升。该研究中贝莱斯芽孢杆菌DPT-03微胶囊菌剂相比于未包膜的菌体防效提升了18.75%,表明贝莱斯芽孢杆菌DPT-03微胶囊包膜能一定程度上提升其对病害的防治效果,为后续贝莱斯芽孢杆菌微胶囊菌剂的开发与应用提供一定的理论依据。
参考文献
[1] HUANG N X,ENKEGAARD A,OSBORNE L S,et al.The banker plant method in biological control[J].Critical reviews in plant sciences,2011,30(3):259-278.
[2] 王超,郭堅华,席运官,等.拮抗细菌在植物病害生物防治中应用的研究进展[J].江苏农业科学,2017,45(18):1-6.
[3] DE CLERCK E,VANHOUTTE T,HEBB T,et al.Isolation,characterization,and identification of bacterial contaminants in semifinal gelatin extracts[J].Appliedand environmental microbiology,2004,70(6):3664-3672.
[4] 余小霞,田健,伍宁丰.枯草芽胞杆菌芽胞表面展示外源蛋白的研究进展[J].中国农业科技导报,2013,15(5):31-38.
[5] 李俊州,文才艺.植物病害生防细菌研究进展[J].河南农业科学,2015,44(10):1-7.
[6] Ruiz-GARCA C,BJAR V,MARTNEZ-CHECA F,et al.Bacillus velezensis sp.nov.,a surfactant-producing bacterium isolated from the river Vélez in Málaga,southern Spain[J].International journal of systematic and evolutionary microbiology,2005,55 :191-195.
[7] 张德锋,高艳侠,王亚军,等.贝莱斯芽孢杆菌的分类、拮抗功能及其应用研究进展[J].微生物学通报,2020,47(11):3634-3649.
[8] 李生樟,陈颖,杨瑞环,等.一株拮抗黄单胞菌的贝莱斯芽孢杆菌的分离和鉴定[J].微生物学报,2019,59(10):1969-1983.
[9] CUI L X,YANG C D,WEI L J,et al.Isolation and identification of an endophytic bacteria Bacillus velezensis 8-4 exhibiting biocontrol activity against potato scab[J].Biological control,2020,141:1-7.
[10] 肖倩,李守望,梁晨,等.贝莱斯芽孢杆菌对黄瓜霜霉病的作用方式和持效期[J].农药,2021,60(11):829-831.
[11] 迟惠荣,张亚惠,曾欣,等.多花黄精内生贝莱斯芽胞杆菌的分离鉴定及其抗菌与促生作用分析[J].植物保护,2019,45(4):122-131.
[12] KLOEPPER J W,BEAUCHAMP C J.A review of issues related to measuring colonization of plant roots by bacteria[J].Canadian journal of microbiology,1992,38(12):1219-1232.
[13] DIANWATI D,MISHRA V,SHAH N P.Stability of microencapsulated Lactobacillus acidophilus and Lactococcus lactis ssp.cremoris during storage at room temperature at low aw[J].Food research international,2013,50(1):259-265.
[14] DING W K,SHAH N P.Effect of various encapsulating materials on the stability of probiotic bacteria[J].Journal of food science,2009,74(2):M100-M107.
[15] NAZZARO F,ORLANDO P,FRATIANNI F,et al.Microencapsulation in food science and biotechnology[J].Current opinion in biotechnology,2012,23(2):182-186.
[16] 方中达.植病研究方法[M].3版.北京:中国农业出版社,1998.
[17] 董羽嘉,何艳慧,武占省.微胶囊化植物根际促生菌剂的研究进展[J].生物加工过程,2021,19(4):404-412.
[18] 陈彬,王宗抗,张敏,等.微胶囊壁材的研究进展[J].磷肥与复肥,2020,35(8):50-52.
[19] LARIONOVA N V,PONCHEL G,DUCHNE D,et al.Biodegradable cross-linked starch/protein microcapsules containing proteinase inhibitor for oral protein administration[J].International journal of pharmaceutics,1999,189(2):171-178.
[20] 王慧梅,范艷敏,王连艳.基于微胶囊技术对油脂包埋的研究进展[J].现代食品科技,2018,34(10):271-280,195.
[21] 项郑昊,周化岚,张建国.海藻酸钠微胶囊制备及其在微生物包埋中的应用[J].工业微生物,2021,51(1):43-49.
[22] 胡义钰,冯成天,刘辉,等.海藻酸钠/壳聚糖基橡胶树死皮康复营养剂微胶囊的制备工艺优化[J].热带作物学报,2019,40(7):1379-1386.
[23] 于乐军.明胶/阿拉伯胶复凝聚微胶囊技术用于乳酸菌保护的研究[D].青岛:中国海洋大学,2009.
[24] 张宇琪,彭湉,周新丽.微滴喷射法制备植物乳杆菌微胶囊的试验研究[J].上海理工大学学报,2022,44(1):34-41.
[25] 乔紫璇.生防芽胞杆菌与假单胞菌的相互作用及生防细菌微胶囊剂的田间应用研究[D].南京:南京农业大学,2020.
[26] 王琴,高青,缪卫国,等.3种生防细菌2种药剂剂型对芒果炭疽病菌的拮抗作用初探[J].广东农业科学,2014,41(11):82-88.
