不同亚硒酸钠浓度对党参生长、生理特性和品质的影响
2023-05-22李婷婷段耿婷张澜王丹丹吴发明姚秋阳
李婷婷 段耿婷 张澜 王丹丹吴发明 姚秋阳

摘 要:为综合了解党参的施硒效应,该研究基于水培试验探究不同亚硒酸钠浓度处理条件下党参幼苗的硒积累、生长、生理和品质的变化规律。结果表明:(1)适宜硒浓度(0.2 mg·L-1)可以促进党参的叶片面积、株高、生物量的增长,而高硒浓度(10 mg·L-1)则抑制党参生长。(2)增加亚硒酸钠浓度和硒暴露时间均可提高党参幼苗在根和叶中的硒含量,不同器官硒积累表现为根>叶>茎。(3)适宜硒浓度(0.2 mg·L-1)处理可提高光合色素含量和根系活力,并减少丙二醛、脯氨酸和过氧化氢的积累,而高硒浓度(10 mg·L-1)则与之相反。(4)适宜硒浓度(0.2 mg·L-1)有利于党参炔苷、多糖、可溶性蛋白的积累,而高硒浓度(10 mg·L-1)可以对多糖和可溶性蛋白的积累产生不利影响。综上认为,亚硒酸钠对党参具有双重效应,施加适量浓度对党参的生长、生理和品质有益,并以0.2 mg·L-1硒浓度处理的效果最佳。该研究结果有助于了解亚硒酸钠浓度对施硒效应的影响,为富硒党参的基础研究及栽培提供了理论依据。
关键词: 施硒效应, 富硒党参, 党参炔苷, 胁迫反应, 双重效应
中图分类号:Q945
文献标识码:A
文章编号:1000-3142(2023)04-0755-10
Abstract:To comprehensively understand the effect of selenium (Se) supplementation on Codonopsis pilosula, effects of sodium selenite levels on Se accumulation, growth, physiology and quality were explored by using hydroponic experiments. The results were as follows: (1)Treatment with 0.2 mg·L-1 Se promoted leaf size, plant height and biomass of C. pilosula, while treatment with 10 mg·L-1 Se suppressed them. (2)Both increasing Se level and exposure time to C. pilosula seedlings could raise its Se contents in root and leaf, and Se was distributed in organs with an order of root>leaf>stem. (3)Treatment with 0.2 mg·L-1 Se increased photosynthetic pigment content and root activity, and reduced malondialdehyde, proline and hydrogen peroxide contents, while treatment with 10 mg·L-1 Se had opposite effects. (4)Treatment with 0.2 mg·L-1 Se had positive effects on accumulations of lobetyolin, polysaccharide, and soluble protein, while treatment with 10 mg·L-1 Se had negative effects on the accumulations of polysaccharide and soluble protein. In summary, sodium selenite has double effect on C. pilosula; application of appropriate Se is beneficial to its growth, plant physiology and quality, and 0.2 mg·L-1 Se level is the optimum. This study may improve us to understand the effect of selenite level on the biology effect of C. pilosula, which will be useful for the basic research and cultivation of Se-enriched C. pilosula.
Key words: effect of Se supplementation, Se-enriched Codonopsis pilosula, lobetyolin, stress response, double effect
硒(selenium,Se)是人體必需的微量元素,正常成人每天需摄入50~400 μg硒元素(中国卫生行业标准WS/T 578.3—2017)。由于硒代半胱氨酸是动物抗氧化酶系统多个成员如谷胱甘肽过氧化酶的活性位点,因此硒元素在提高人体抗氧化和免疫力方面非常重要(Santesmasses & Gladvshev, 2021)。随着越来越多关于硒对人体健康有益的发现被报道,富硒中药材作为特种中药材资源,其开发利用也受到关注。党参(Codonopsis Radix)来源于桔梗科植物党参(Codonopsis pilosula)、素花党参(C. pilosula var. modesta)或川党参(C. tangshen)(国家药典委员会,2020),是我国产量和需求量最大的中药材品种之一(杨慧珍等,2016)。刘宽辉等(2017)的研究表明硒化修饰能进一步提高党参多糖的免疫活性,表明党参与硒对人体的补益作用有一定程度的叠加效应,这为富硒党参的栽培和开发提供了依据。
党参中的有机硒与总硒的比值为80.1%~83.6%(周武先等,2021),但其硒含量参差不齐,一般为0.05~1.6 mg·kg-1(0.1~0.4中位数)(李增禧等,2013)。产区土壤硒含量不足,并且缺乏配套富硒栽培技术,这是导致现有富硒党参药材资源稀少和参差不齐的主要原因。目前,党参的硒营养强化研究还处于起步阶段。席旭东等(2015)报道了根际施加硒肥(主要成分为亚硒酸钠)可以使党参硒含量达到0.98 mg·kg-1,并能增加党参的溶出物。周武先等(2021)采用大田试验外源喷施亚硒酸钠(按硒元素计400 g·hm-2),不仅能提高硒含量(达0.947 mg·kg-1),还增加了党参的产量以及多糖和党参炔苷的积累。这表明硒元素对党参的生长和次生代谢存在重要影响,常规人工喷施硒肥虽然能提高党参的硒含量,但存在一定瓶颈效应。若要发现硒含量瓶颈效应的制约因素,并提出针对性的富硒栽培措施,就要了解党参硒积累潜能及施硒效应。
硒元素对植物生长的毒害作用和有益作用被称为双重效应(Hawrylak-Nowak et al., 2015)。与动物相比,植物的双重效应之所以发现得较晚,是因为硒对植物生长有益的证据直到近些年才陆续被报道出来,如水稻(Olyza Sativa)(Yin et al., 2019)、油菜(Brassica napus)(Ulhassan et al., 2019)、芥菜(B. juncea)(Eiche et al., 2015)、黄瓜(Cucumis sativus)(Hawrylak-Nowak et al., 2015)和茶(Camellia sinensis)(王丹丹等,2021)等。硒的双重作用主要表现为浓度依赖性,并在一定程度上改变植物生理和代谢过程,从而影响作物的产量和品质(周武先等,2021)。因此,研究外源硒对作物的生长、生理和品质的影响具有重要现实意义。目前,基于水培实验的党参富硒强化研究尚未见报道,其硒积累潜能及富硒与硒过量所产生的施硒效应仍知之甚少。由于亚硒酸钠及其代谢中间体在体内有强氧化性和抗氧化性,因此能反应抗氧化系统变化的抗逆性指标越来越多与生长指标一起被应用于硒响应相关的基础研究中(Hartikainen et al., 2000)。基于此,本研究拟采用水培技术探讨不同水平的亚硒酸钠处理下党参的硒积累特性及其对党参的生长、抗逆生理特性和品质指标的影响,以期为富硒党参的基础研究及栽培提供理论依据。
1 材料与方法
1.1 材料和试验设计
供试党参种子由甘肃靖远西北道地药材种植经济合作社提供,由遵义医科大学药学院吴发明教授结合亲本和幼苗植株形态鉴定为桔梗科黨参属植物党参(Codonopsis pilosula)的种子。党参炔苷对照品(四川省维克奇生物科技有限公司,批号为wkq17031006,纯度为98%),乙腈为色谱纯,其余试剂均为分析纯,水为超纯水。
挑选大小均一的党参种子,播种在黄壤土、腐殖土和有机肥(5∶4∶1)混合均匀的培育基质中,于室内培养架中发芽生长,培养60 d左右,待幼苗长约6 cm时,将党参幼苗移栽至装有6 L营养液的通气水培箱中预培养14 d。所用营养液为改良版小西茂毅营养液(Konishi et al., 1985),营养液元素组成为N (1 125 μmol·L-1)、K (500 μmol·L-1)、Ca(500 μmol·L-1)、P (500 μmol·L-1)、S (400 μmol·L-1)、Mg (400 μmol·L-1)、Al (200 μmol·L-1)、Fe (20 μmol·L-1)、B (2 μmol·L-1)、Mn (2 μmol·L-1)、Zn (2 μmol·L-1)、Cu (1.5 μmol·L-1)、Mo (0.15 μmol·L-1)和Na (37 μmol·L-1),营养液pH调至6。前期营养液筛选实验显示,相同条件下,与霍格兰、通用配方(段雪婷等,2020)两种营养液相比,党参在小西茂毅营养液培养1个月后长势最好。预培养后,挑选生长趋势一致的幼苗进行后期试验,以亚硒酸钠为硒源,设置不同梯度亚硒酸钠浓度,按硒元素计为0(CK)、0.05、0.1、0.2、0.3、0.4、10 mg·L-1共7个处理,分别记为Se0、Se0.05、Se0.1、Se0.2、Se0.3、Se0.4、Se10,每个处理3次重复,继续水培30 d后,分别对根、茎和叶进行取样,对其农艺性状和相关生理生化指标进行测定。
1.2 试验方法
1.2.1 硒含量测定 硒含量测定采用氢化物原子荧光光度法(谢小雪,2021)。分别采集不同处理组党参幼苗的根、茎和叶,60 ℃烘干并研磨成粉,取0.3 g加入10 mL硝酸-高氯酸(9∶1)于电热板上消解,将消解后的溶液定容至25 mL,测定其硒含量。
1.2.2 植株形态特征及生长状况 培养期间每7 d观察和测量植物的颜色、大小和高度等指标,在培养30 d时称量叶和根的干重和鲜重。叶绿素含量采用乙醇研磨紫外吸收法测定(李合生,2000)。
1.2.3 生理和品质指标测定 可溶性蛋白含量采用考马斯亮蓝G-250染色法测定;丙二醛(MDA)含量采用硫代巴比妥酸法测定;脯氨酸含量采用茚三酮法测定;根系活力采用氯化三苯基四氮唑法测定(李合生,2000);多糖含量采用硫酸苯酚法测定(成铭等,2020);过氧化氢含量采用紫外分光光度法测定(高俊凤,2006)。
1.2.4 党参炔苷含量测定
1.2.4.1 对照品溶液的制备 称取党参炔苷对照品适量,加甲醇配置成浓度为100 μg·mL-1的对照品溶液。
1.2.4.2 供试品溶液的制备 取干燥党参根粉末(过50目筛)约1 g,置于50 mL具塞锥形瓶中,加入75%甲醇30 mL,密塞,称定质量,超声(功率为400 W,频率为50 kHz)处理30 min,取出,称重并用75%甲醇补足至30 mL,用微孔滤膜过滤。
1.2.4.3 色谱条件 色谱柱为Inertsil ODS-3(250 mm × 4.6 mm,5 μm),流动相为乙腈(A)-水(B),梯度洗脱(0~3 min,3.5% A;3~20 min,3.5% A→14% A;20~35 min,14% A→23% A;35~60 min,23% A→72% A;60~76 min,72% A→95% A),流速为0.8 mL·min-1,柱温为30 ℃,检测波长为210 nm,进样量为20 μL(刘付松等,2020)。标准品色谱图如图1所示。
1.2.4.4 线性关系考察 分别精密吸取党参炔苷对照品溶液制备成质量浓度为10、20、40、60、80、100 μg·mL-1,得到质量浓度(x,μg·mL-1)为横坐标、峰面积(y)为纵坐标的线性关系,回归方程为y=50.581x-129.1,r=0.999。
1.3 数据分析
采用SPSS 17.0统计分析软件计算各指标的平均值和标准误,以单因素方差分析 (ANOVA)进行组间比较,根据统计结果使用Graphpad Prism 7.0软件绘图,其中P<0.05表示有显著性差异,P<0.01表示有极显著性差异。
2 结果与分析
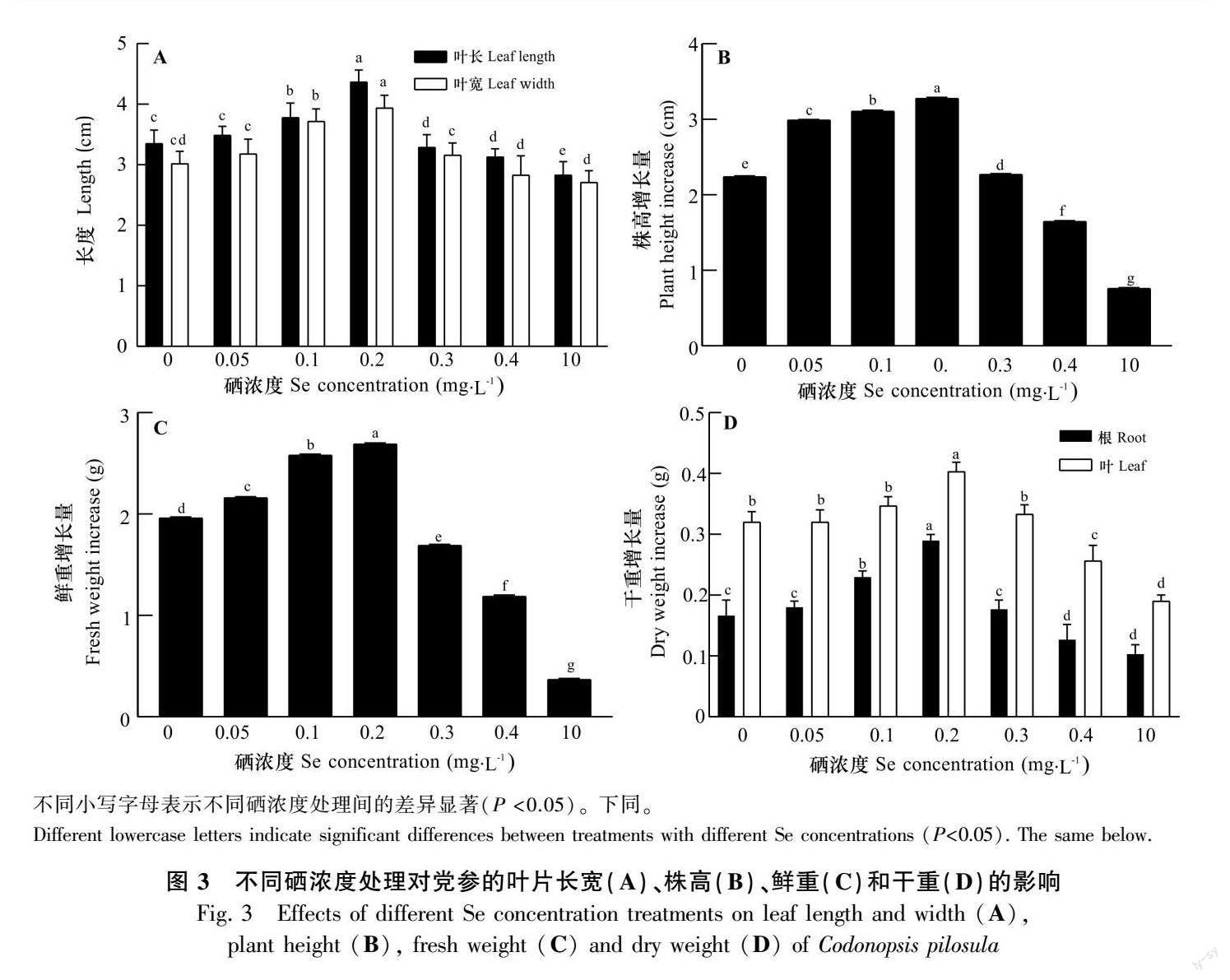
2.1 不同亚硒酸钠浓度下党参生长的变化情况
由图2和图3可知,不同亚硒酸钠浓度处理下党参幼苗的叶长、叶宽、株高、鲜重和干重均随亚硒酸钠浓度的增加呈现先升后降的趋势。低亚硒酸钠浓度处理对党参幼苗的生长有利,随着亚硒酸钠浓度的升高党参幼苗的生长逐渐受到抑制。与Se0相比,0.2 mg·L-1硒浓度下党参幼苗长势最好,新生侧根数量较多,其鲜重、株高以及根和叶的干重均增加,分别增加了37.2%、46.4%、81.3%、25.0%;Se10处理下党参植株矮小,根系颜色逐渐褐黄,成熟叶片出现枯斑等,并且党参幼苗的鲜重、株高、根干重、叶干重都显著下降。
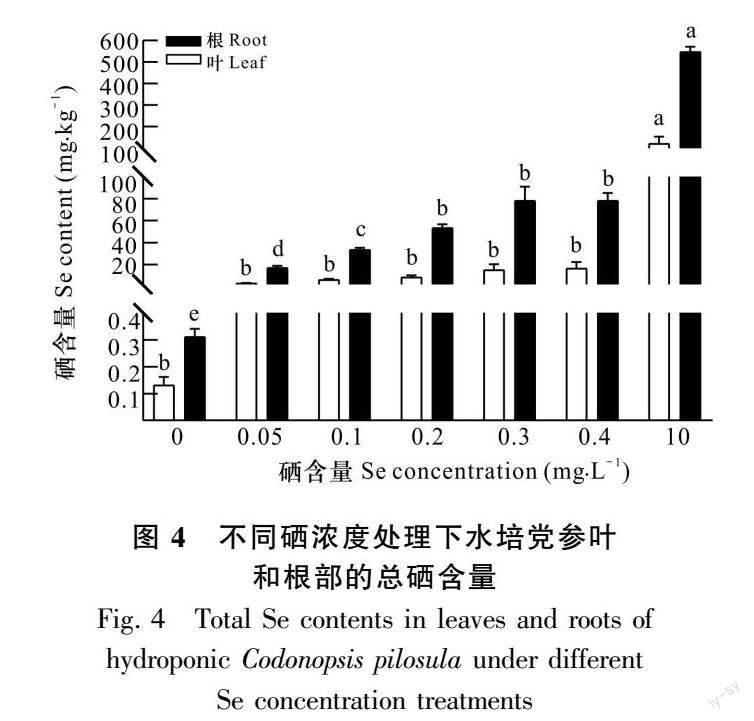
2.2 不同亚硒酸钠浓度对党参硒积累的影响
由图4可知,水培条件下随着亚硒酸钠浓度的增加,党参根部和叶部的总硒含量均明显增加,其中根部积累更多的硒元素。在硒浓度为0.2 mg·L-1时,党参叶和根的硒含量分别达到20、50 mg·kg-1;在硒浓度为10 mg·L-1时,其叶和根的硒含量分别超过100、500 mg·kg-1。
2.3 硒积累的时空变化特征
根据上述筛选的最适硒浓度(0.2 mg·L-1),探究水培条件下的硒积累时空变化特征。由图5:A可知,在施加亚硒酸钠的0~720 h之间,党参叶和根的硒含量随着培养时间而不断增加。由图5:B可知,党参各器官的硒积累能力不同,在0.2 mg·L-1硒浓度处理下各器官分布顺序为根>叶>茎。
2.4 不同亚硒酸钠浓度对党参光合色素含量的影响
由图6可知,随着亚硒酸钠浓度的增加,党参的叶绿素和类胡萝卜素含量呈现先升高后下降的趋势。在Se0.2处理下党参的叶绿素a、叶绿素b和类胡萝卜素含量达到最高值,与Se0处理相比,上述光合色素含量分别增加了11.0%、6.9%和13.2%,而在Se10处理下各光合色素的含量均显著下降。
2.5 不同亚硒酸钠浓度对党参抗逆生理特性的影响
由图7:A可知,與Se0相比,随着亚硒酸钠浓度的增加,党参幼苗MDA含量在Se0.05、Se0.1处理下显著减少,在Se0.2、Se0.3和Se0.4处理下MDA含量逐渐回升,在Se10处理下MDA含量显著增加。由图7:B可知,随着亚硒酸钠浓度的增加,脯氨酸含量呈现先降低后升高的趋势。与Se0相比,Se0.2处理下脯氨酸含量最低,Se10处理下显著增加。由图7:C可知,在不同硒浓度处理中,以Se0.2处理下的党参幼苗过氧化氢含量最低,Se10处理下最高,两者均达到显著水平。由图7:D可知,随着亚硒酸钠浓度的增加,根系活力逐渐增加。Se0.2处理下根系活力达到最大值,比Se0处理下增加了125.0%,随后根系活力随着亚硒酸钠浓度的升高而逐步回落。
2.6 不同亚硒酸钠浓度对党参品质的影响
以党参炔苷、党参多糖和可溶性蛋白初步评价硒元素对党参品质的影响。由图8:A可知,随着亚硒酸钠浓度的增加,党参炔苷含量在Se10处理下达到最大值,较其他处理组均达到显著水平;相比Se0处理,党参幼苗在Se0.2处理下党参炔苷含量增加了26.0%。由图8:B,C可知,随着亚硒酸钠浓度的增加,党参多糖和可溶性蛋白含量呈现先升高后下降的趋势。与Se0相比,在Se0.2处理下达到最高值,党参多糖含量增加了36.5%,可溶性蛋白含量增加了13.9%;而在Se10处理下,党参多糖含量则无显著变化,可溶性蛋白含量均显著下降。
3 讨论
3.1 外源施硒下党参的硒积累特征
亚硒酸钠是植物常从土壤中吸收得到的重要硒源,也是富硒栽培和相关基础研究广泛使用的硒源。植物可以直接吸收利用亚硒酸钠,磷酸转运子PT2被发现是植物实现该吸收运输过程的载体(Li et al., 2008)。植物吸收无机硒后,主要在地上部分的叶绿体和细胞质中转化为有机硒,之后转移并积累到不同的组织中(White, 2018)。根据植物硒积累的能力可以分为超聚硒植物(Se hyperaccumulator)、次级聚硒植物(Se secondary accumulator)和非聚硒植物(Se non-accumulator)(Yuan et al., 2013)。聚硒植物的干重硒含量可在100 mg·kg-1以上,有聚硒和耐硒特性,能作为硒指示植物和硒净化物种。例如,自然生长在恩施硒矿核心区域(其土壤含可溶性硒2.4 mg·kg-1,水中含硒0.275 mg·L-1)的恩施碎米荠(Cardamine violifolia)的硒含量为1 800~4 400 mg·kg-1(Both et al., 2020)。大多数植物如常见的粮食作物、蔬菜和药用植物都是非聚硒植物,硒耐受能力不如聚硒植物,干重硒含量一般不超过25 mg·kg-1。席旭东等(2015)在大田试验中进行施硒处理,得到党参硒含量最大值为0.98 mg·kg-1。本研究结果进一步证明党参属于非聚硒植物,在硒浓度为0.2 mg·L-1的水培体系中培养,党参的生长未受抑制,其叶和根的硒含量分别可达到20、50 mg·kg-1;在硒浓度为10 mg·L-1的水培条件下其叶和根的硒含量分别超过100、500 mg·kg-1,但生长受到抑制,表明党参有较高的富硒潜能。另外,本研究与席旭东等(2015)基于土培的结果差别较大,说明培养方式和培养基质是影响硒积累的重要因素。其中,土壤的理化因素常会对植物硒吸收产生重要影响(王锐等,2018)。由此可见,通过改变栽培方式或提高土壤硒活化度是今后开发富硒党参及其他富硒作物的潜在途径。目前,基于严格的安全性考虑,在食品硒限量卫生标准中,富硒茶硒含量范围为0.25~4.00 mg·kg-1,富硒稻谷为0.04~0.30 mg·kg-1,富硒食品为0.025~1 mg·kg-1(NY/T 600—2002,2003)。本研究在水培条件下通过增加外源性亚硒酸钠很容易到达或超过上述标准,说明无土栽培能在添加少量的硒源条件下即可得到高硒浓度的富硒农产品。由于高硒原材料可以为富硒产品的开发提供更多的选择空间,因此可以考虑更高附加值的有机硒的分离纯化产品,如以恩施碎米荠为原料成功开发出的“硒蛋白精华片”(刘坤媛等,2015)。
本研究还探究了最适硒浓度(0.2 mg·L-1)水培条件下的硒积累时空变化特征。Li等(2020)报道显示,亚硒酸盐更容易在根部积累有机硒,而往地上部分迁移较少。本研究结果也支持这一观点, 相同处理浓度下党参根部比地上部分积累更多硒元素。生产富硒农产品的目标是在食用或药用部位富集硒元素,在亚硒酸钠处理下根部积累更多硒元素,这一特征可为外源施加硒肥生产富硒党参提供有利条件。此外,党参叶和根的硒积累与亚硒酸钠浓度正相关,并且硒积累还随着培养时间而不斷增加,这与蔡阳光等(2021)报道的魔芋等植物中的研究结果一致,说明党参地上部分和根系都可以蓄积一定量的硒元素,这些富硒资源有待进一步综合开发利用。
3.2 不同亚硒酸钠水平对党参生长和抗逆生理特性的影响
众所周知,硒水平过高对植物有毒性作用。这主要是因为摄入过量硒元素后植物在蛋白质合成过程中会大量非特异性地引入硒代氨基酸,从而造成异常蛋白快速积累(Garousi et al., 2017)。随着研究的深入,越来越多的报道显示,硒对植物的生长和发育有明显的剂量效应,表现为低硒浓度时有促进作用而高硒浓度时却有抑制作用(Zhou et al., 2021)。本研究结果与之一致:合适的硒浓度(0.2 mg·L-1)对党参幼苗的叶长、叶宽、鲜重、株高以及干重均具有显著的促进作用,而高硒浓度(如10 mg·L-1)则会严重抑制党参幼苗的生长。叶绿素是植物进行光合作用的重要物质,而光合作用产生的有机物是植物生长的物质基础。叶绿素含量及其合成途径相关基因的表达对硒浓度敏感,如茶树(胡玉荣,2016;王丹丹等,2021)、黄瓜(Hawrylak-Nowak et al., 2015)、白术(Atractylodes macrocephala)(张美德等,2021)等。党参中有相似现象,在0.2 mg·L-1硒浓度处理下光合色素含量有所增加,在10 mg·L-1的硒浓度处理下光合色素含量显著降低,表明亚硒酸钠影响光合色素的生成是其调节党参生长的重要途径。
硒对生物体抗氧化系统的双重作用已被许多学者认为是硒对植物生长剂量效应的重要原因。适宜浓度下,硒能增强抗氧化酶活性(Ulhassan et al., 2019),而高浓度的硒元素是促氧化剂,可以引发体内活性氧(ROS)大量积累,使抗氧化酶活性受损,从而产生硒胁迫效应(Hartikainen et al., 2000)。MDA和过氧化氢是生物膜系统脂质过氧化和细胞损伤的重要产物,脯氨酸是植物体细胞内的渗透调节物质,三者是衡量植物抗逆生理特性的重要指标。本研究中,在低硒浓度(0.1~0.2 mg·L-1)下党参的MDA、过氧化氢和脯氨酸含量均有所降低,在高硒浓度(10 mg·L-1)下三者均显著升高,而根系活力随着硒浓度的变化呈现先增加后回落的趋势。这提示:在适宜的亚硒酸钠浓度下,党参的过氧化酶体系活性增加,ROS物质减少,使得根系活力增强,从而促进植物生长;而在高亚硒酸钠浓度条件下,ROS快速积累,细胞膜受损,体细胞渗透压失衡,产生硒胁迫效应,需要更多脯氨酸以提高植物抗逆性。
3.3 不同亚硒酸钠水平对党参品质的影响
党参含有党参炔苷、多糖等多种化学成分,具有提高免疫和抗氧化等功能(Gao et al., 2020)。作为一种药食两用作物,党参炔苷、多糖和蛋白质含量常作为党参药材质量和营养价值的重要指标。本研究结果显示,在最适宜生长的硒浓度(0.2 mg·L-1)处理下,党参炔苷、多糖和蛋白质含量都有所增加。值得关注的是,在高浓度的亚硒酸钠胁迫条件下,多糖和蛋白含量均有所降低,而党参炔苷显著升高。党参炔苷虽然具有抗氧化作用(Yoon et al., 2014),但党参是否可能利用党参炔苷在亚硒酸钠胁迫条件下增强抗氧化性从而提高其适应性仍需要进一步研究。生产富硒农产品的总体目标是在食用或药用部位富集硒元素,同时尽量减少硒营养强化对植物生长、营养价值及药材品质的损害(Jaiswal et al., 2011)。总体而言,由于高亚硒酸钠浓度可以使党参品质下降,而适当的亚硒酸钠浓度处理可以提高其品质,因此控制硒浓度是植物硒营养强化趋利避害的重要途径。综上所述,药食两用的党参可以作为一种有很好开发潜力的富硒作物,可有待进一步综合开发。
4 结论
亚硒酸钠处理水平对党参的施硒效应有重要影响。在硒浓度为0.2 mg·L-1的水培体系中可得到叶和根的硒含量分别为20、50 mg·kg-1的富硒党参,该浓度对党参的生长、植物生理和品质均有益;高硒浓度(10 mg·L-1)可使党参的叶和根的硒含量分别超过100、500 mg·kg-1,但对党参幼苗有害,使党参出现胁迫反应,抑制植物生长,降低党参品质。本研究有助于了解党参的硒积累特性和施硒效应,为富硒党参的基础研究和栽培提供依据。
参考文献:
BOTH EB, STONEHOUSE GC, LIMA LW, et al., 2020. Selenium tolerance, accumulation, localization and speciation in a Cardamine hyperaccumulator and a non-hyperaccumulator [J]. Sci Total Environ, 703: 135041.
CHENG M, PI WX, LU TL, et al., 2020. Determination of Codonopsis and polysaccharides in the ground part of Codonopsis and analysis of influencing factors [J]. J Chin Med Mat, 43(5): 1092-1098.[成铭, 皮文霞, 陆兔林, 等, 2020. 党参地上部分的党参炔苷、多糖含量测定及影响因素分析 [J]. 中药材, 43(5): 1092-1098.]
CAI YG, DUAN LF, QIN JF, 2021. The content variation of exogenous selenium in different organs of konjac at different growth stages [J]. Chin Agric Sci Bull, 37(36): 61-65.[蔡阳光, 段龙飞, 覃剑锋, 等, 2021. 外源硒在魔芋不同生育时期不同器官中的含量变化研究 [J]. 中國农学通报, 37(36): 61-65.]
Chinese Pharmacopoeia Commission, 2020. The pharmacopoeia of the Peoples Republic of China:Part 1 [S]. Beijing: Chinese Medical Science and Technology Press.[国家药典委员会, 2020. 中华人民共和国药典: 一部 [S] . 北京: 中国医药科技出版社.]
DUAN XT, WANG L, FENG XD, 2020. Effects of different nutrient formulas on the growth of cucumber seedlings [J]. J Yanan Univ (Nat Sci Ed), 39(3): 85-89.[段雪婷, 王璐, 冯晓东, 2020. 不同营养液配方对黄瓜幼苗生长的影响 [J]. 延安大学学报(自然科学版), 39(3): 85-89.]
EICHE E, BARDELLI F, NOTHSTEIN AK, et al., 2015. Selenium distribution and speciation in plant parts of wheat (Triticum aestivum) and Indian mustard (Brassica juncea) from a seleniferous area of Punjab, India [J]. Sci Total Environ, 505: 952-961.
GAO JF, 2006. Plant physiology experiment guidance [M]. Beijing: Higher Education Press: 118-220.[高俊凤, 2006. 植物生理学实验指导 [M]. 北京: 高等教育出版社: 118-120.]
GAO ZZ, ZHANG C, JING LR, et al., 2020. The structural characterization and immune modulation activitives comparison ofCodonopsis pilosula polysaccharide (CPPS) and selenizing CPPS (sCPPS) on mouse in vitro and vivo [J]. Int J Biol Macromol, 160: 814-822.
GAROUSI F, DOMOKOS-SZABOLCSY , JANOSZKY M, et al., 2017. Selenoamino acid-enriched green pea as a value-added plant protein source for humans and livestock [J]. Plant Foods Hum Nutr, 72(2): 168-175.
HAWRYLAK-NOWAK B, MATRASZEK R, POGORZELEC M, 2015. The dual effects of two inorganic selenium forms on the growth, selected physiological parameters and macronutrients accumulation in cucumber plants [J].Acta Physiol Plant, 37(2): 41.
HARTIKAINEN H, XUE TL, PIIRONEN V, et al., 2000. Selenium as an anti-oxidant and pro-oxidant in ryegrass [J]. Plant Soil, 225(2): 193-200.
HU YR, 2016. Identification and analysis of genes related to selenium assimilation and metabolism in tea plant roots [D]. Wuhan: Chinese Academy of Agricultural Sciences: 1-4.[胡玉荣, 2016. 茶树根系硒吸收和代谢的关键基因发掘与分析 [D]. 武汉: 中国农业科学院: 1-4.]
JAISWAL AK, RAJAURIA G, ABU-GHANNAM N, et al., 2011. Phenolic composition, antioxidant capacity and antibacterial activity of selected Irish Brassica vegetables [J]. Nat Prod Commun, 6(9): 1299-1304.
KONISHI S, MIYAMOTO S, TAKI T, 1985. Stimulatory effects of aluminum on tea plants grown under low and high phosphorus supply [J]. Soil Sci Plant Nutr, 31(3): 361-368.
LI YX, ZHU NL, LIANG XJ, et al., 2020. A comparative study on the accumulation, translocation and transformation of selenite, selenate, and SeNPs in a hydroponic-plant system [J]. Ecotoxicol Environ Saf, 189: 109955.
LIU FS, CHEN CS, SUN P, et al., 2020. Comparative study on contents of 5 active ingredients in different varieties and harvesting periods of Codonopsis radix [J]. Chin Pharm, 31(14): 1677-1682.[刘付松, 陈翠莎, 孙佩, 等, 2020. 不同品种及采收期党参药材中5种有效成分含量的比较研究 [J]. 中国药房, 31(14): 1677-1682.]
LIU KY, TIAN XL, QIN ZG, et al., 2015. Structure characteristics and anti-motor fatigue activity of selenium-containing protein from Cardamine hupingshanensis [J]. Food Sci, 36(9): 160-165.[劉坤媛, 田秀丽, 秦治国, 等, 2015. 壶瓶碎米荠中含硒蛋白结构特性及其缓解运动性疲劳的作用 [J]. 食品科学, 36(9): 160-165.]
LI HF, MCGRATH SP, ZHAO FJ, 2008. Selenium uptake, translocation and speciation in wheat supplied with selenate or selenite [J]. New Phytol, 178: 92-102.
LI HS, 2000. Principle and technology of plant physiology and biochemical experiments [M]. Beijing: Higher Education Press: 350-550.[李合生, 2000. 植物生理生化实验原理和技术 [M]. 北京: 高等教育出版社: 350-550.]
LI ZX, PAN WJ, TAN YJ, et al., 2013. TCM trace element data (10) [J]. Guangdong Trace Elem Sci, 20(11): 42-70.[李增禧, 潘伟健, 谭永基, 等, 2013. 中药微量元素数据(10) [J]. 广东微量元素科学, 20(11): 42-70.]
LIU KH, TIAN WJ, GAO ZZ, et al., 2017. Comparative studies on polysaccharide-selenizing polysaccharide compounds in enhancing immune function of chicken [J]. J Nanjing Agric Univ, 40(3): 521-528.[刘宽辉, 田卫军, 高珍珍, 等, 2017. 多糖-硒化多糖复方增强鸡免疫功能的比较研究 [J]. 南京农业大学学报, 40(3): 521-528.]
NY/T 600—2002, 2003. Selenium-enriched tea [S]. Beijing: Standards Press of China.[NY/T 600—2002, 2003. 富硒茶 [S]. 北京: 中国标准出版社.]
SANTESMASSES D, GLADVSHEV VN, 2021. Pathogenic variants in selenoproteins and selenocysteine biosynthesis machinery [J]. Int J Mol Sci, 22(21): 11593.
ULHASSAN Z, GILL RA, ALI S, et al., 2019. Dual behavior of selenium: Insights into physio-biochemical, anatomical and molecular analyses of four Brassica napus cultivars [J]. Chemosphere, 225: 329-341.
WANG DD, HUANG Y, ZHOU ZZ, et al., 2021. Effects of selenate at different concentrations on growth and physiological indexes of tea tree [J]. Guihaia, 41(2): 183-194.[王丹丹, 黄妍, 周中政, 等, 2021. 不同浓度硒酸钠对茶树的生长和生理指标的影响 [J]. 广西植物, 41(2): 183-194.]
WANG R, YU T, YANG ZF, et al., 2018. Bioavailability of soil selenium and its influencing factors in selenium-enriched soil [J]. Res Environ Yang Basin, 27(7): 1647-1654.[王锐, 余涛, 杨忠芳, 等, 2018. 富硒土壤硒生物有效性及影响因素研究 [J]. 长江流域资源与环境, 27(7): 1647-1654.]
WHITE PJ, 2018. Selenium metabolism in plants [J]. Biochim Biophys Acta, 1862(11): 2333-2342.
XIE XX, FANG YC, LIU LG, 2021. Determination of selenium content in fruits from Dangshan producing area by hydride generation atomic fluorescence spectrometry [J]. Chin Food Saf Mag, 25: 94-95.[谢小雪, 方迎春, 刘龙刚, 2021. 氢化物发生原子荧光法测定砀山产地水果中硒含量 [J]. 食品安全导刊, 25: 94-95.]
XI XD, JI LJ, LI HD, 2015. Effect of selenium fertilizer on quality and selenium content of three staple herb-medicines in Gansu Province [J]. Chin Agric Sci Bull, 31: 136-140.[席旭东, 姬丽君, 李海东, 2015. 硒肥对甘肃3種大宗药材品质及硒含量的影响 [J]. 中国农学通报, 31: 136-140.]
YANG HZ, CHEN Y, GUO FX, et al., 2016. Resource investigation of wild Codonopsis pilosula in Tanchang County of Gansu [J]. Chin J Chin Mat Med, 41(2): 186-191.[杨慧珍, 陈垣, 郭凤霞, 等, 2016. 甘肃省宕昌县党参野生资源调查研究 [J]. 中国中药杂志, 41(2): 186-191.]
YOON YP, RYU J, PARK SH, et al., 2014. Effects of lobetyolin, lobetyol and methyl linoleate on secretion, production and gene expression of MUC5AC mucin from airway epithelial cells [J]. Tuberc Respir Dis, 77(5): 203-208.
YUAN LX, ZHU YY, LIN ZQ, et al., 2013. A novel selenocystine-accumulating plant in selenium-mine drainage area in Enshi, China [J]. PLoS ONE, 8(6): 65615.
YIN HQ, QI ZY, LI MQ, et al., 2019. Selenium forms and methods of application differentially modulate plant growth, photosynthesis, stress tolerance, selenium content and speciation in Oryza sativa L. [J]. Ecotoxicol Environ Saf, 169: 911-917.
ZHANG MD, WU HT, ZHANG YJ, et al., 2022. Effects of different soil selenium levels on growth and partial physiological characteristics of Atractylodes macrocephala seedlings [J]. Guihaia, 42(6): 1008-1017.[张美德, 吴海棠, 张雅娟, 等, 2021. 不同土壤硒水平对白术幼苗生长及部分生理特性的影响 [J]. 广西植物, 42(6): 1008-1017.
ZHOU WX, LIU CJ, DUAN YY, et al., 2021. Roles and underlying mechanisms of foliar selenium application in regulating growth of Codonopsis [J]. J Agric Res Environ, 38(4): 618-625.[周武先, 刘翠君, 段媛媛, 等, 2021. 外源硒对川党参生长的影响及其可能作用机制 [J]. 农业资源与环境学报, 38(4): 618-625.]
ZHOU WX, DUAN YY, ZHANG YJ, et al., 2021. Effects of foliar selenium application on growth and rhizospheric soil micro-ecological environment of Atractylodes macrocephala Koidz [J]. S Afr J Bot, 137(1): 98-109.
(责任编辑 蒋巧媛)
