小花老鼠簕可培养细菌多样性及其生物学活性研究
2023-05-22李喆黄媛林朱俊华胡文进王巧贞黄庶识潘信利
李喆 黄媛林 朱俊华 胡文进 王巧贞 黄庶识 潘信利


摘 要:小花老鼠簕(Acanthus ebracteatus)是一种生长在红树生态系统的珍稀真红树植物,具有较高的药用价值。为研究小花老鼠簕内生及根际可培养细菌多样性,挖掘其潜在新物种及具有特殊生物学活性的菌株,该文利用7种不同培养基,通过传统稀释涂布法对小花老鼠簕各植物组织及根际土壤可培养细菌进行分离,基于16S rRNA基因序列解析其内生及根际细菌群落结构和多样性特征,应用植物病原菌平板對峙实验和平铺捕食活性测试分析其可培养细菌的抗菌活性。结果表明:(1)基于16S rRNA基因序列分析,发现从小花老鼠簕的根、茎、叶、花及根际土壤中分离得到144株可培养细菌,这些细菌隶属于18目26科37属66种,芽孢杆菌属(Bacillus)和链霉菌属(Streptomyces)为优势菌属,分别占细菌种数的15.1%和13.6%;(2)拮抗多种植物病原菌试验结果显示,获得29株具有拮抗植物病原菌活性的细菌,10株具有广谱抑菌活性,其中链霉菌属菌株拮抗作用最强且菌株Y129为潜在新物种。(3)捕食活性测试结果显示,有5株细菌对金黄色葡萄球菌(Staphylococcus aureus)、耐甲氧西林金黄色葡萄球菌(multi-drug resistance Staphylococcus aureus)及大肠埃希氏菌(Escherichia coli)具有捕食活性,假单胞菌属菌株捕食活性最强,其中菌株Y90为潜在新物种。综上表明,红树植物小花老鼠簕及其根际土壤中蕴含着丰富的细菌种质资源且具有多种生物活性,可作为生防菌和药源菌的来源之一,该研究结果为提高红树植物小花老鼠簕的药效和栽培提供了理论参考。
关键词: 小花老鼠簕, 可培养细菌, 植物病原菌, 捕食活性
中图分类号:Q939.96
文献标识码:A
文章编号:1000-3142(2023)04-0635-14
Abstract:Acanthus ebracteatus is a special kind of rare mangrove plant, possessing great medicinal value. In this paper, in order tostudy the diversity of endophytic and rhizosphere culturable bacteria in the A. ebracteatus, we explored new potential bacterial species and strains with special biological activities. The culturable bacteria were isolated from A. ebracteatus by dilution separation method. The bacterial diversity was investigated based on the 16S rRNA gene sequence analysis. In addition, the confrontation experiment and lawn predation assay were utilized to screen bacteria with anti-microorganism activities. The results were as follows: (1) A total of 144 culturable bacteria were isolated from A. ebracteatus root, stems, leaves, flowers and rhizosphere soil. These bacteria were affiliated into 66 species based on the analysis of the 16S rRNA gene sequence. The bacterial genera Bacillus and Streptomyces were dominant in plant tissue and rhizosphere soil with that of the value 15.1% and 13.6%, respectively. (2) The bioactivity assays revealed that there were 29 strains with anti-fungal activity and 10 strain possessing a broad spectrum of anti-fungal activity. Among them, the Streptomyces strains had the strongest antagonistic effect, and the active strain Y129 was a potential new species. (3) A total of five strains showed predation activity on Staphylococcus aureus, multi-drug resistance Staphylococcus aureus and Escherichia coli. Pseudomonas had the strongest predatory activity, and the active strain Y90 was a potential new species. In conclusion, A. ebracteatus and their rhizosphere soil contain rich bacterial germplasm resources and have a variety of functional strains, which can be used as one of the sources of biocontrol bacteria and medicinal bacteria. This study provides the theoretical reference for improving the efficacy and cultivation of A. ebracteatus.
Key words: Acanthus ebracteatus, culturable bacteria, plant pathogens, predation activity
珍稀濒危真红树植物小花老鼠簕属于爵床科(Acanthaceae)老鼠簕属(Acanthus),主要分布于我国海南、广东和广西等地的红树林潮间带(中国植物志,2004)。其果实具有解毒消肿的功效,叶子提取物具有保護神经作用,根可用于乙型肝炎的治疗(中华本草,1999;陈玫伶等,2019)。近十几年来,红树林的过度开发导致红树物种多样性减少,有近1/3红树植物处于濒危状态,其中包括小花老鼠簕。黄丽艳等(2020)的研究调查了该物种在广西的分布及种群特征,发现仅在防城港市江山半岛西南侧和黄竹江中游潮滩存有不足2 000株小花老鼠簕。林诚(2009)研究表明,植物内生细菌部分或全部定殖于植物组织,与植物生长发育、环境适应性、抗逆性甚至药用活性等密切相关且部分内生细菌具有与宿主植物相同或相似的活性功能,表明药用植物内生细菌是抗生素、生物农药的来源之一。近几年来,许多研究学者热衷于挖掘红树林生境来源细菌的生物学活性,如抗血栓(李菲等,2020)、抗衰老(李蜜等,2020)、拮抗植物病原菌(颜栋美等,2018;李菲等,2021)、抗肿瘤(梁静娟等,2006)、耐受重金属(De La Rosa-Acosta et al., 2015)和降解多环芳烃(Guo et al., 2005)等。红树植物内生及根际土壤可培养细菌不仅多样性丰富,还是一个理想的药源菌和生防菌资源库。
近年来,临床上多重耐药菌感染严重威胁人类健康,其耐药范围广,毒性大,滥用抗生素加重了治愈的难度,因此寻找新型药源来解决这一瓶颈尤为重要(陈方圆等,2010;王晓彤等,2020)。捕食性细菌(predatory bacteria)能够在营养缺乏或者竞争环境下通过“吞噬”其他细菌来获取能量和营养物质(Kadouri et al.,2013;Negus et al.,2017)。Arend等(2020)研究发现,被确定为滑柱菌属(Herpetosiphon)的菌株CA052B能对大肠杆菌(Escherichia coli)、肺炎克雷伯菌(Klebsiella Pneumoniae)、奇异变形杆菌(Pfiodeus mirabidis)和金黄色葡萄球菌(Staphylococcus aureus)等10种具有临床相关性的病原菌进行捕食活动。Livingstone等(2018)的研究指出,黄色粘球菌(Myxococcus xanthus)的捕食机制能以广泛的细菌为食,并使用不同的多因素机制来杀死和降解不同的猎物。研究表明部分捕食性细菌也是专性的细菌捕食者,对部分哺乳动物细胞系不造成伤害(Gupta et al., 2016;Monnappa et al., 2016),如在小鼠、兔子、豚鼠和鸡中,已经验证了在其体内施用捕食性细菌的安全性,说明捕食性细菌具有“活抗生素”作用的潜力(Westergaard et al., 1977;Atterbury et al., 2011;Shatzkes et al., 2017.)。另外在农业上,香蕉枯萎尖孢镰刀菌、芒果炭疽病原菌等有害微生物导致的流行病对农业生产及经济发展造成了较大影响,目前对植物病原菌的防控措施主要包括栽培管理、培育抗病品种、农业防治、化学防治、物理防治和生物防治等方面,其中以化学防治为主,化学农药的广泛使用致使农业生态系统遭到破坏(詹儒林等,2005;许家辉等,2007)且使有害微生物表现出抗药性,因此亟须找到新的防治手段(黄媛林等,2021)。目前,普遍认为低毒、污染小的生物防治是最有潜力的防治措施(张鲁斌,2010;王超等,2017)。
本研究以采集自海南的红树植物小花老鼠簕为研究材料,采用传统稀释涂布法对其植物组织和根际土壤进行可培养细菌分离,并通过以多种植物病原菌和人类致病菌为指示菌测试细菌活性,拟探讨以下问题:(1)小花老鼠簕内生和根际土壤可培养细菌的群落结构及多样性;(2)可培养细菌的不同生物活性;(3)对活性菌株的抑菌能力及其功能酶活性进行初步鉴定,以获得具有潜在药用价值的菌株。本研究为开展小花老鼠簕的保护育种及新型生物医药的开发等工作奠定基础。
1 材料与方法
1.1 材料
1.1.1 样品采集 小花老鼠簕样本采集于海口市东寨港红树林保护中心(11°34′47″ E、19°57′1″ N), 分别收集小花老鼠簕的根、茎、叶、花及其根际10 cm处土壤,密封袋分装,4 ℃保藏带回实验室进行预处理。
1.1.2 指示菌 香蕉枯萎病尖孢镰刀菌(Fusarium oxysporum f. sp. Cubense)1号(Tr1)和4号(Tr4)侵染小种、香蕉炭疽病原菌(Colletotrichum musae)、芒果炭疽病原菌(C. gloeosporioides)、链格孢菌(Alternaria alternata)和葡萄座腔菌(Botryosphaeria dothidea)由广西农业科学院李其利老师提供。
金黄色葡萄球菌ATCC6538、耐甲氧西林金黄色葡萄球菌ATCC43300来源于ATCC菌种保藏中心(American Type Culture Collection);大肠埃希氏菌CMCC(B)44102来源于CMCC保藏中心(National Center for Medical Culture Collections)。
1.1.3 培养基
(1)分离培养基。AGG:可溶性淀粉10 g,葡萄糖1 g,甘油5 mL,复合盐母液10 mL,琼脂15 g,去离子水1 000 mL。ISP7:甘油15 mL,L-酪氨酸0.5 g,L-天冬酰胺1 g,复合盐母液10 mL,琼脂15 g,去离子水1 000 mL,pH 7.2~7.4。ISP3:可溶性燕麦粉20 g,复合盐母液10 mL,琼脂15 g,去离子水1 000 mL。M7:酵母提取粉5 g,L-天冬酰胺1 g,甘油10 mL,复合盐母液10 mL,琼脂15 g,去离子水1 000 mL,pH 7.2~7.4。M5:海藻糖5 g,脯氨酸1 g,复合盐母液10 mL,琼脂15 g,维生素母液1 mL,去离子水1 000 mL,pH 7.2~7.4。腐殖酸培养基:腐殖酸1 g,CaCO3 0.02 g,Na2HPO4 0.5 g,MgSO4·7H2O 0.05 g,KCl 1.7 g,FeSO4·7H2O 0.01 g,琼脂15 g,去离子水1 000 mL,pH 7.2~7.4。
M10:淀粉10 g,水解酪素0.5 g,复合盐母液10 mL,琼脂15 g,去离子水1 000 mL。复合盐母液:KNO3 1 g,NaCl 0.5 g,MgSO4·7H2O 0.5 g,K2HPO4 0.5 g,NH4NO3 0.1 g,FeSO4 0.01 g,MnCl2·H2O 0.001 g,ZnSO4·7H2O 0.001 g,去离子水10 mL(注:K2HPO4 溶液须单独配置,高温灭菌后按比例加入培养基)。抑制剂:分别配备重铬酸钾及放线菌酮溶液,使用0.22 μm无菌过滤器进行过滤备用,添加终浓度分别为25 mg·L-1和50 mg·L-1。改良ISP2培养基:酵母提取粉2 g,麦芽浸出粉2 g,无水葡萄糖2 g,去离子水1 000 mL。
(2)指示菌培养基。LB培养基:胰蛋白胨10 g,酵母提取粉5 g,NaCl 10 g,去离子水1 000 mL,pH 7.2~7.4。
PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂15 g,去离子水1 000 mL。
(3)捕食活性测试培养基。TPM培养基:1 mL 1 mol·L-1 Tris-HCl溶液,1 mL 0.8 mol·L-1 MgSO4·7H2O溶液,使用l mol·L-1 KH2PO4溶液调节pH至7.6。
(4)酶活鉴定培养基。酯酶筛选培养基:分别以吐温20、吐温60及吐温80为底物(添加量为1%),胰蛋白胨1 g,去离子水1 000 mL,琼脂15 g。脲酶筛选培养基:以30%尿素溶液为底物(添加量为2%),胰蛋白胨1 g,NaCl 5 g,葡萄糖1 g,KH2PO4 2 g,酚红0.012 g,琼脂15 g , 去离子水1 000 mL,pH 6.8~6.9。其他参考文献进行纤维素酶(宋朝霞等,2018)、几丁质酶(Roberts & Selitrennikoff,1988)、淀粉酶及蛋白酶(赵雅慧等,2018)筛选培养基的配制。
1.2 方法
1.2.1 样品预处理 植物组织:使用无菌水冲洗小花老鼠簕各组织器官表面泥土,预处理方法(李菲等,2017)对样品表面进行消毒,依次使用5%次氯酸钠溶液浸泡3 min,0.2%吐温20溶液浸泡3 min,75%酒精浸泡3 min且浸泡每种消毒液后均使用无菌水冲洗样品3次。消毒完成后将其晾干,使用无菌手术刀分别将各植物组织剪成1 cm ×1 cm大小,充分研磨后加入1 mL无菌水制成母液。
根际土壤:取适量根际土壤样品均匀平铺于陶瓷蒸发皿中,90 ℃热激30 min后称取1 g样品,加入9 mL无菌水制成母液。
1.2.2 菌株分离和纯培养 使用无菌水将各植物组织及根际土壤母液稀释至10-3和10-4,分别吸取0.2 mL稀释悬液涂布于7种不同的分离培养基中,28 ℃倒置培养7~28 d。通过肉眼观察记录不同菌株的形态及数目,对其进行编号,并挑取不同菌落划线至改良ISP2培养基上不断纯化直至得到纯菌株。将获得纯培养后的菌株接种至改良ISP2斜面培养基并放置4 ℃保藏,同时制备30%(V/V)甘油冻存液,挑取新鲜菌苔制成冻存管保藏于-80 ℃冰箱中。
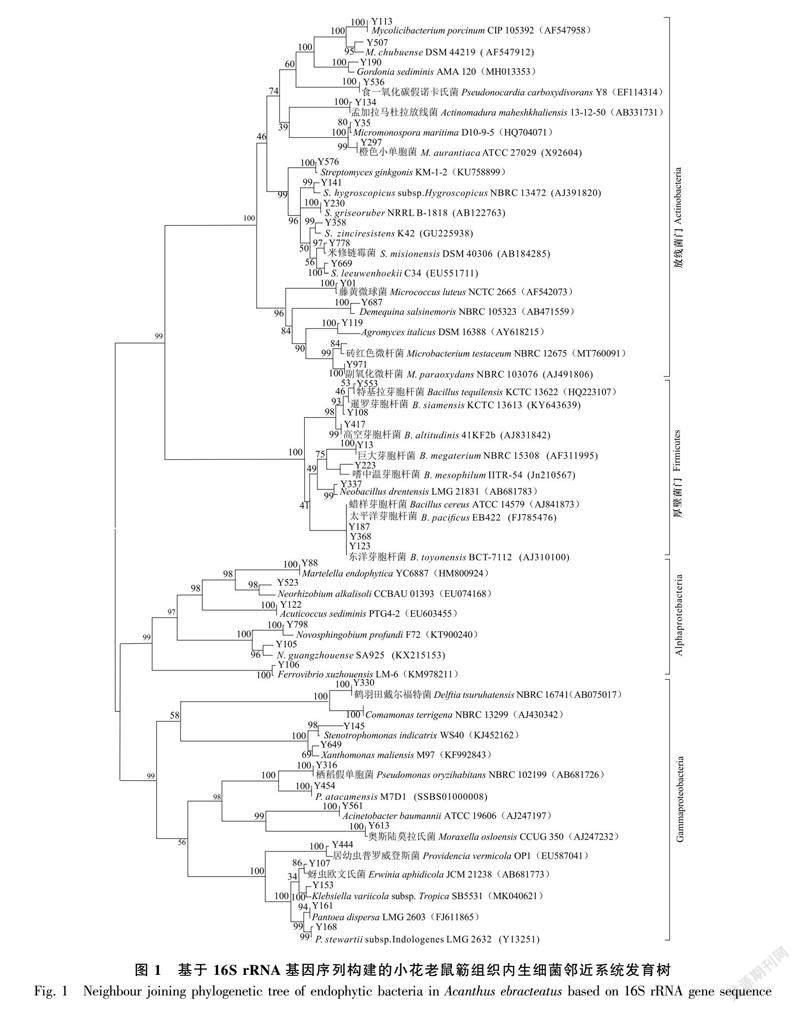
1.2.3 16S rRNA系统发育分析及菌株鉴定 采用Chelex-100法(周双清等,2010)提取菌株DNA,取0.1 mL高温灭菌的20%树脂水溶液,无菌牙签挑取适量纯培养菌株单菌落与其充分混合、研磨。100 ℃金属浴10 min,通过离心充分沉淀Chelex-10颗粒,取上清作为PCR扩增模板,参考Walsh等(1991)的方法,扩增引物为27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1522R(5′-AAGGAGGTGATCCAGCCGCA-3′),PCR反应条件为:95 ℃预变性8 min,94 ℃变性1 min,58 ℃退火45 s,72 ℃延伸90 s,共进行32个循环。将扩增产物进行1%琼脂糖凝胶电泳检验合格后,对阳性扩增产物进行切胶回收,采用pGM-18T载体及感受态大肠杆菌Trans 10对其进行克隆,采用引物M13F(5′-GTTTTCCCAGTCACGA-3′)和M13R(5′-CAGGAAACAGCTATGA-3′)对克隆菌落进行PCR,扩增产物进行电泳检验合格后,将阳性克隆子送往上海生工生物工程(上海)股份有限公司进行测序。使用BioEdit及DNAstar軟件对测序结果进行整理,并将其提交至EZbiocloud序列比对平台与储存在该数据库(https://www.ezbiocloud.net/)已发表序列进行序列比对,运用 MEGA10.0软件,采用邻近法(Neighbor-Joining)法、最大似然(Maximum-likelihood)法构建系统树,基于1 000次自展值(Boostrap值)分析各活性菌株的系统发育关系(Tamura et al., 2011)。
1.2.4 拮抗植物病原真菌活性测试 采用平板对峙法对6种指示植物病原菌进行菌株拮抗测试。每4株可培养菌株为一组,采用点植法依次将纯化后的可培养菌株接种于PDA平板四周距离边缘2 cm处,同时使用无菌打孔器将各植物病原真菌制成直径5 mm菌饼,接种于PDA平板中心,设置只接种植物病原菌的PDA平板作为空白对照,每组试验重复3次,置于28 ℃倒置培养数天,观察记录菌株生长及抑制情况,计算其抑菌率。
抑菌率=(对照组植物病原真菌菌落半径-处理组植物病原真菌菌落半径)/对照组植物病原真菌菌落半径×100%。
1.2.5 捕食活性测试 将金黄色葡萄球菌、耐甲氧西林金黄色葡萄球菌和大肠埃希氏菌分别接种至LB液体培养基,置于37 ℃,180 r·min-1震荡培养24 h后离心去除培养基,并使用TPM液体培养基将菌体冲洗3次后重悬,将其稀释到106 CFU·mL-1,吸取0.3 mL菌悬液均匀涂布于TPM琼脂平板上制成含有被捕食细菌的平板待用。将可培养菌株以点植法接种于含有被捕食细菌的TPM平板上,同时将可培养菌株接种于不含被捕食细菌的TPM平板作为对照组,每组实验重复3次,置于28 ℃恒温培养箱中培养7 d,观察并测量出现的抑菌圈直径。
1.2.6 酶活鉴定 对植物病原真菌拮抗活性测试及捕食活性测试筛选出的阳性菌株进行不同酶活鉴定。使用无菌打孔器将待鉴定菌制成直径5 mm菌饼,并接种到不同酶活筛选培养基中,28 ℃倒置培养2~7 d,通过观察是否出现透明圈来对活性菌株酶活性进行初步鉴定。
2 结果与分析
2.1 小花老鼠簕内生及根际可培养细菌的多样性
对采集来自海口市东寨港红树林保护中心的小花老鼠簕样品进行内生细菌及根际土壤细菌多样性分离,通过菌株的形态、颜色和状态进行初步排重,选取144株细菌进行16S rRNA基因测序分析,结果显示获得66种细菌,隶属于18目26科37属(表1),其中植物组织获得46种,隶属于17目19科28属,根际土壤获得37种,隶属于14目19科21属。基于16S rRNA基因序列的系统发育分析发现(图1和图2),内生细菌及根际土壤细菌优势菌均为芽孢杆菌属(Bacillus)和假单胞菌属(Pseudomonas),此外,链霉菌属(Streptomyces)也作为植物根部及根际土壤的优势菌属之一。
从不同植物组织和根际土壤分离菌属情况来看(图3),根际土壤分离得到的细菌种属数量最多,分布于21属37种,其次为根部,而花中最少,分布于8属9种。其中,根际土壤和植物组织分离得到12个相同的菌属(图4),分别来自不动杆菌属(Acinetobacter)、Acuticoccus、芽孢杆菌属、戈登氏菌属(Gordonia)、克雷伯氏菌属(Klebsiella)、微杆菌属(Microbacterium)、小单孢菌属(Micromonospora)、分枝杆菌属(Mycolicibacterium)、新鞘脂菌属(Novosphingobium)、假诺卡氏菌属(Pseudonocardia)及链霉菌属。
从不同分离部位特异性来看,根际土壤获得的细菌来自短杆菌属(Brevibacterium),Diaphorobacter、假芽孢杆菌属(Fictibacillus)、Jiella、Metabacillus,诺卡氏菌属(Nocardia)、类诺卡氏菌属(Nocardioides)、Rosenbergiella及沙雷氏菌属(Serratia),而植物组织获得的内生菌株来自马杜拉放线菌属(Actinomadura)、壤霉菌属(Agromyces)、丛毛单胞菌属(Comamonas)、戴尔福特菌属(Delftia)、甲基萘醌菌属(Demequina)、欧文氏菌属(Erwinia)、Ferrovibrio、Martelella、微球菌属(Micrococcus)、莫拉氏菌属(Moraxella)、Neobacillus、新根瘤菌属(Neorhizobium)、泛菌属(Pantoea)、普罗威登斯菌属(Providencia)、寡养单胞菌属(Stenotrophomonas)及黄单孢菌属(Xanthomonas)。
2.2 菌株生物活性测试
采用平板对峙法筛选具有拮抗植物病原菌活性的菌株,结果显示以寡营养培养基对可培养菌株进行捕食活性测试试验(图5),获得5株对3株人体指示病原菌均具有捕食活性的菌株;共有29株细菌能够抑制至少一种植物病原菌,总阳性率为43.9%,其中10株对4种以上植物病原菌都具有抑制能力(图6)。
采用十字交叉法测量抑菌圈直径,对10株拮抗多种植物病原菌菌株及5株捕食活性菌株的抗菌能力进行数据分析。结果如图7所示,菌株Y108、Y263、Y553和Y130具有显著活性,对6株植物病原菌都具有超过30%的抑制率,而菌株Y134、Y133和Y454拮抗植物病原菌能力相对较弱。从活性菌株对不同植物病原菌生长的抑制能力来看,菌株 Y108对葡萄座腔菌和香蕉炭疽病原菌的拮抗能力较强,菌株Y553对香蕉枯萎尖孢镰刀菌4号小种和葡萄座腔菌的拮抗能力较强,而菌株 Y130和Y129分别对香蕉炭疽病原菌和芒果病原菌显示出较强抑制活性;另外,5株捕食活性菌株对金黄色葡萄球菌和耐甲氧西林金黄色葡萄球菌显示出不同程度的捕食活性,除菌株Y330对大肠埃希氏菌表现出较弱捕食活性外,其余菌株对大肠埃希氏菌的捕食活性无明显差别。其中,菌株Y90对耐甲氧西林金黄色葡萄球菌和金黃色葡萄球菌均表现出较强的捕食活性,其次为菌株Y522,而菌株Y145对两种金黄色葡萄球菌的捕食活性较弱。
由分析结果表2可知,抑制多种植物病原菌菌株来源于芽孢杆菌属、链霉菌属、马杜拉放线菌属、沙雷氏菌属、假单胞菌属及诺卡氏菌属,其中,菌株Y129为潜在新物种。具有捕食活性的菌株分布于戴尔福特菌属、Diaphorobacter、假单胞菌属和寡养单胞菌属,其中,菌株Y90为潜在新菌。从活性菌株属级水平分析,芽孢杆菌属和链霉菌属获得最多抑制多种植物病原菌的菌株,均占拮抗植物病原菌活性菌株的30%,假单胞菌属获得最多捕食活性菌株,占捕食活性菌株的40%。此外,芽孢杆菌属和假单胞菌属均获得具有拮抗植物病原菌活性及捕食活性的菌株;从活性菌株分离来源分析,活性菌株主要分布于根际土壤、植物根部和植物茎部,分别占活性菌株的60%、26.7%和13.3%。
2.3 生物活性菌株酶活分析
选用不同底物制备酶活测试平板,对15株活性菌株进行酶活测试,结果(表3)表明,活性菌株均具有至少3种功能酶活性,其中来自链霉菌属菌株Y130、Y129和马杜拉放线菌属菌株Y134具有显著的功能酶活性,产酶阳性率均为75%,另外芽孢杆菌属菌株Y553和Y263,假单孢菌属菌株Y523,戴尔福特菌属菌株Y330,沙雷氏菌Y319以及来自寡养单胞菌属菌株Y145均表现出良好的酶活性,产酶阳性率均为62.5%;通过对不同酶活的阳性菌株数量进行分析,对产几丁质酶、脲酶、酯酶、蛋白酶、纤维素酶、淀粉酶显示为阳性的活性菌株分别是15、12、8、5、5、3株,阳性率分别为100%、73.3%、53.3%、33.3%、33.3%、20%。
3 讨论与结论
红树林特殊的生境必然会造就独特而丰富的微生物种类, 微生物同时又是推动红树林生态系统物质循环和能量流动的主力军(曹启民等,2008)。本研究基于16S rRNA基因测序分析,对小花老鼠簕的根、茎、叶、花4种植物组织中内生细菌及根际土壤细菌的多样性进行研究, 共分离得到可培养细菌66种,分布于18目26科37属。相较于植物组织,根际土壤细菌的多样性最为丰富,其次为根部,花中内生细菌群落多样性最低,与李蜜等(2020)和李菲等(2021)的结果相似,这可能是由于红树林土壤中富含有机质,红树植物落叶及其根系分泌物进入土壤,为微生物生长和繁殖提供了丰富的能量来源(庄铁诚和林鹏,1993)。此外,植物组织内生细菌和根际土壤细菌群落构成相似,优势菌属均为芽孢杆菌属和假单胞菌属,都含有来自放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)、Gammaproteobacteria和Alphaproteobacteria的细菌。然而,细菌群落结构又显示出特异性,从植物组织中获得11个特有菌属,从植物根际土壤中分离得到9个特有菌属,这可能与不同微生物定殖于植物组织的选择性有关,进一步证实了内生菌的群落结构随植物组织的不同具有多样性、普遍性和特异性。
肖胜蓝等(2011)研究表明,药用植物中的部分内生细菌能够产生与宿主相同或相似的生理活性成分,是抗菌、抗植物病虫害、抗病毒、抗癌等活性物质来源的资源宝库。红树林生境具有典型的海洋生境特征,为了适应高盐、低压、潮湿及有机物富集的特点,红树林微生物类群形成了独特的代谢路径和生物学活性,具有开发新型海洋医药的潜力(曹启民等,2008;吕佩帅等,2021)。本研究通过活性测试从小花老鼠簕内生及根际可培养细菌中筛选到多个具有生物活性的菌株,就多样性而言,获得10株具有抑制多种植物病原菌活性的菌株,分别隶属于芽孢杆菌属、链霉菌属、马杜拉放线菌属、沙雷氏菌属、假单胞菌属及诺卡氏菌属,5株分别来自戴尔福特菌属、Diaphorobacter、假单胞菌属和寡养单胞菌属的细菌具有捕食多种人类病原菌活性,活性菌株表现出不同程度的生物活性, 其中链霉菌属菌株对植物病原菌表現出最强的拮抗作用, 而假单胞菌属捕食活性最强;就新颖性而言,链霉菌属菌株Y129及假单胞菌属菌株Y90均为潜在新物种,同时相关研究表明植物内生细菌的整个生命周期都生活在植物组织中,能够通过产生具有活性的次生代谢产物和各种功能酶来保护植物免受病毒和病原菌的侵害,并能促进植物生长发育(Saikkonen et al., 2004;Afzal et al., 2014; Fan et al., 2020)。因此,具有良好生物活性的潜在新菌可作为开发新型无害的生物医药材料。另外,就活性菌株来源分析,活性菌株主要来源于根际土壤和植物根部,这与陈华等(2006)对海南18种红树和4种半红树植物的根际土壤、根、叶和果中分离筛选活性菌株的结果相似,活性菌株多分布于根际土壤,根部次之。研究表明植物根部和根际土壤细菌能够通过产生活性次生代谢产物和鳌铁化合物来抑制植物病原菌的生长,是理想的药源菌来源之一(Strobel,2003;刘峰和洪葵,2006)。此外,通过酶活测试发现活性菌株普遍具有分泌多种功能酶的潜力,尤其对酯酶、蛋白酶及纤维素酶表现出显著酶活力,这可能是因为红树林易受间歇性潮水浸淹影响,使得大量海洋动植物残体聚集和落叶堆积,为微生物提供了丰富的代谢产物、纤维素和蛋白类等营养有机质(赵雅慧等,2018)。同时,这些水解酶可能与细菌的捕食活性相关,捕食性细菌不仅能够通过生产活性化合物来抑制病原菌,还能够通过分泌多种溶解酶来裂解被捕食性细菌(Lambert et al., 2006,2008;Keane & Berleman,2015), 如粘球菌利用抗生素Myxovirescin、水解酶及蛋白酶MepA与细胞外膜囊泡协作共同裂解猎物细胞,并在捕食过程中产生多种不同活性的次级代谢产物和裂解酶,它们能作为新型活性化合物的来源(Keane & Berleman,2015),多种功能酶活的菌株能为针对性开发和利用药用微生物资源提供理论依据和指导方向。
综上所述,海南东寨港红树林保护中心药用红树植物小花老鼠簕内生可培养细菌多样性丰富,并且具有多种生物活性,是后续研究新型生物医药的理想材料。
参考文献:
ATTERBURY RJ, HOBLEY L, TILL R, et al., 2011. Effects of orally administered Bdellovibrio bacteriovorus on the well-being and salmonella colonization of young chicks [J]. Appl Environ Microbiol, 77(16): 5794-5803.
AFZAL M, KHAN QM, SESSITSCH A, 2014. Endophytic bacteria: prospects and applications for the phytoremediation of organic pollutants [J]. Chemosphere, 117: 232-242.
AREMD KI, SCHMIDT JJ, BENTLER T, et al., 2020. Myxococcus xanthus predation of Gram-positive or Gram-negative bacteria is mediated by different bacteriolytic mechanisms [J]. Appl Environ Microbiol, 87(5): e02382-20.
China Flora Compilation Committee, 2004. Flora Republicae Popularis Sinicae [M]. Beijing: Science Press, 40: 45.[中国植物志编纂委员会, 2004. 中国植物志 [M]. 北京: 科学出版社, 40: 45]
CHEN H, HONG K, ZHUANG L, et al., 2006. Isolation and cytotoxic activity of microorganisms from mangrove in Hainan [J]. Chin J Trop Crop, 27(1): 59-63.[陈华, 洪葵, 庄令, 等, 2006. 海南红树林的微生物生态分布及细胞毒活性评价 [J]. 热带作物学报, 27(1): 59-63.]
CAO QM, ZHENG KZ, CHEN G, et al., 2008. A review of studies on microbiology of mangrove ecosystems [J]. Ecol Environ, 17(2): 839-845.[曹启民, 郑康振, 陈耿, 等, 2008. 红树林生态系统微生物学研究进展 [J]. 生态环境, 17(2): 839-845.]
CHEN FY, MA XX, CAI JY, et al., 2010. Clinical medical treatment against multiple drug-resisant Staphylococcus aureus (MDRSA) and its drug-resistance mechanism[J]. J Microbiol, 30(1): 71-74.[陈方圆, 马笑雪, 蔡景钰, 等, 2010. 多重耐药性金黄色葡萄球菌(MRSA)的临床药物治疗及耐药机制研究 [J]. 微生物学杂志, 30(1): 71-74.]
CHEN ML, HAO EW, DU ZC, et al., 2019. Research progress on marine Chinese materia medica with antiviral effect [J]. Chin Herb Med, 50(23): 5653-5660.[陈玫伶, 郝二伟, 杜正彩, 等, 2019. 具有抗病毒作用的海洋中藥研究进展 [J]. 中草药, 50(23): 5653-5660.]
DE LA ROSA-ACOSTA M, JIMNEZ-COLLAZO J, MALDONADO-ROMN M, et al., 2015. Bacteria as potential indicators of heavy metal contamination in a tropical mangrove and the implications on environmental and human health [J]. J Trop Life Sci, 5(3): 100-116.
Editorial Committee of Chinese Materia Medica of the State Administration of Traditional Chinese Medicine, 1999. Chinese materia medica [M]. Shanghai: Science and Technology Press, 7: 433-434.[国家中医药管理局中华本草编委会, 1999. 中华本草 [M]. 上海: 科学技术出版社, 7: 433-434.]
FAN D, SUBRAMANIAN S, SMITH DL, 2020. Plant endophytes promote growth and alleviate salt stress in Arabidopsis thaliana [J]. Sci Rep, 10(1): 12740.
GUO CL, ZHOU HW, WONG YS, et al., 2005. Isolation of PAH-degrading bacteria from mangrove sediments and their biodegradation potential [J]. Mar Poll Bull, 51(8-12): 1054-1061.
GUPTA S, TANG C, TRAN M, et al., 2016. Effect of predatory bacteria on human cell lines [J]. PLoS ONE, 11(8): e0161242.
HUANG LY, SHI XF, MO ZC, et al., 2020. Distribution and population characteristics of the rare and endangered exclusive mangrove plant Acanthus ebracteatus in Guangxi [J]. J Guangxi Acad Sci, 36(4): 353-360.[黄丽艳, 史小芳, 莫竹承, 等, 2020. 广西珍稀濒危真红树植物小花老鼠簕分布及种群特征 [J]. 广西科学院学报, 36(4): 353-360.]
HUANG YL, PAN XL, LU L, et al., 2021. Isolation and identification of antifungal compound from a mangrove-derived Streptomyces sp. and its biosynthetic gene cluster analysis[J]. Chin J Antibiot, 46(12): 1090-1101.[黄媛林, 潘信利, 陆璐, 等, 2021. 一株红树林链霉菌所产抑菌活性化合物的分离及其生物合成基因簇的研究 [J]. 中国抗生素杂志, 46(12): 1090-1101.]
KADOURI DE, TO K, SHANKS RMQ, et al., 2013. Predatory bacteria: a potential ally against Multidrug-resistant Gram-negative pathogens [J]. PLoS ONE, 8(5): e63397.
KEANE R, BERLEMAN J, 2015. The predatory life cycle of Myxococcus xanthus [J]. Microbiol, 162(1): 1-11.
LIANG JJ, PANG ZW, ZHAN P, 2006.Isolation and identification of mangrove marine bacteria and analysis of their bioactive products [J]. J Trop Oceanogr, 25(6): 47-51.[梁静娟, 庞宗文, 詹萍, 2006. 红树林海洋细菌的分离鉴定及其活性物质初步分析 [J]. 热带海洋学报, 25(6): 47-51.]
LIU F, HONG K, 2006. Diversity of mangrove microorganisms and their metabolites [J]. Hainan Med, 17(5): 171-173.[刘峰, 洪葵, 2006. 红树林微生物及其代谢产物多样性 [J]. 海南医学, 17(5): 171-173.]
LAMBERT C, MOREHOUS KA, CHANG CY, et al., 2006. Bdellovibrio: growth and development during the predatory cycle [J]. Curr Opin Microbiol, 9(6): 639-644.
LAMBERT C, HOULEY L, CHANG CY, et al., 2008. A predatory patchwork: membrane and surface structures of Bdellovibrio bacteriovorus [J]. Advan Microb Physiol, 54: 313-361.
LIN C, 2009. Study on the isolation, identification, bioactivity and secondary metabolites of mangrove actinomycetes [D].Xiamen: Xiamen University.[林诚, 2009. 红树植物内表生放线菌的分离、活性筛选和次级代谢产物研究 [D]. 厦门: 厦门大学. ]
LI F, HUANG SS, HU WJ, et al., 2020. Diversity and anti-thrombotic activity of the endophytic and rhizosphere bacteria isolated from Aegiceras corniculatum [J]. Guihaia, 40(3): 335-344.[李菲, 黃庶识, 胡文进, 等, 2020. 桐花树内生和根际细菌多样性及抗血栓活性研究 [J]. 广西植物, 40(3): 335-344.]
LI M, GAO CH, JIANG S, et al., 2020. Diversity and anti-aging activity of endophytic bacteria from true mangrove plants collected from the west coast of Hainan [J]. Guihaia, 40(3): 311-319. [李蜜, 高程海, 姜舒, 等, 2020. 海南西海岸真红树内生细菌多样性及其延缓衰老活性研究 [J]. 广西植物, 40(3): 311-319.]
LI F, HUANG SS, HU WJ, et al., 2021. Diversity of endophytic and rhizospheric bacteria isolated from semi-mangrove Cerbera manghas L. and their activity against plant pathogenetic fungi [J]. Chin J Antibiot, 46(5): 396-405.[李菲, 黄庶识, 胡文进, 等, 2021. 半红树植物海芒果内生与根际细菌多样性及抗农用真菌活性研究 [J]. 中国抗生素杂志, 46(5): 396-405.]
LIVINGSTONE PG, MORPHEW RM, COOKSON AR, et al., 2018. Genome analysis, metabolic potential and predatory capabilities of Herpetosiphon llansteffanense sp. nov. [J]. Appl Environ Microbiol, 84(22): e01040-18.
LU PS, ZHANG LL, XU FZ, et al., 2021. Advances in the resources, research methods and biological activities of marine actinomycetes [J]. Biol Resour, 43(3): 232-245.[吕佩帅, 张丽红, 徐福洲, 等, 2021. 海洋放线菌资源、研究方法与生物活性研究进展 [J]. 生物资源, 43(3): 232-245.]
MONNAPPA AK, BARI W, CHOI SY, et al., 2016. Investigating the responses of human epithelial cells to predatory bacteria [J]. Sci Rep, 6: 33485.
NEGUS D, MOORE C, BAKER M, et al., 2017. Predator versus pathogen: How does predatory bdellovibrio bacteriovorus interface with the challenges of killing gram-negative pathogens in a host setting?[J]. Ann Rev Microbiol, 71(1): 441-457.
ROBERTS WK, SELITRENNIKOFF CP, 1988. Plant and bacterial chitinases differ in antifungal activity [J]. J Gen Microbiol, 134(1): 169-176.
STROBEL GA, 2003. Endophytes as sources of bioactive products [J]. Microb Infect, 5(6):535-544
SAIKKONEN K, WLI P, HELANDER M, et al., 2004. Evolution of endophyte-plant symbioses [J]. Trends Plant Sci, 9(6): 275-280.
SHATZKES K, TANG C, SINGLRTON E, et al., 2017. Effect of predatory bacteria on the gut bacterial microbiota in rats [J]. Rep, 7: 43483.
SONG ZX, FAN L, LI P, et al., 2018. Screening and identification of a cellulase-producing strain [J]. J Henan Inst Technol (Nat Sci Ed) , 30(4): 76-81.[宋朝霞, 范玲, 李鹏, 等, 2018. 一株纤维素酶高产细菌的筛选及鉴定 [J]. 河南工程学院学报(自然科学版), 30(4): 76-81.]
TAMURA K, PETERSON D, PETERSON N, et al., 2011. MEGA5: Molecula evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods [J]. Mol Biol Evol, 28(10): 2731-2739.
WALSH PS, METZGER DA, HIGUCHI R, 1991. Chelex 100 as a medium for simple extraction of DNA for PCR-based typing from forensic material [J]. Biotechniques, 10(4): 506-513.
WANG C, GUO JH, XI YG, et al., 2017. Research progress on the application of antagonistic bacteria in biological control of plant diseases [J]. Jiangsu Agric Sci, 45(18): 1-6.[王超, 郭堅华, 席运官, 等, 2017. 拮抗细菌在植物病害生物防治中应用的研究进展 [J]. 江苏农业科学, 45(18): 1-6.]
WANG XT, JIN LM,YU Y, et al., 2020. Screening and identification of marine microorganisms against Escherichia coli [J]. Chin Brew, 39(6): 43-46.[王晓彤, 金黎明, 俞勇, 等, 2020. 拮抗大肠杆菌的海洋微生物的筛选与鉴定 [J]. 中国酿造, 39(6): 43-46.]
WESTERGAARD JM, KRAMER TT, et al., 1977. Bdellovibrio and the intestinal flora of vertebrates [J]. Appl environ microbiol, 34(5): 506-511.
XU JH, YU D, XU L, et al., 2007. Status and development countermeasures of mango industry in Fujian[J]. Fujian Fruit Tree, (3): 21-22.[许家辉, 余东, 许玲, 等, 2007. 福建芒果产业状况及发展对策 [J]. 福建果树, (3): 21-22.]
XIAO SL, LEI XL, SHE ZG, et al., 2011. Isolation and inhibition activity of microbes of endophytic fungi from eight mangrove plants of Shanko District, Guangxi [J]. Chin J Trop Crop, 32(12): 2259-2263.[肖胜蓝, 雷晓凌, 佘志刚, 等, 2011. 广西山口8种红树林内生真菌的分离鉴定及抗菌活性菌株的筛选 [J]. 热带作物学报, 32(12): 2259-2263.]
YAN DM, WANG W, LI M, et al., 2018.Diversity of rhizospheric bacteria and its inhibition activity from Sonneratia apetala in Maowei Sea [J]. S J Agric Sci, 49(06): 1095-1101.[颜栋美, 王伟, 李蜜, 等, 2018. 茅尾海无瓣海桑根际土壤细菌多样性及抑菌活性分析 [J]. 南方农业学报, 49(6): 1095-1101.]
ZHUANG TC, LIN P, 1993. Soil microbial amount variations of mangroves (Kandelia candel) in process of natural decomposition of litter leaves [J]. J Xiamen Univ (Nat Sci Ed), 32(3): 365-370[莊铁诚, 林鹏, 1993. 红树林凋落叶自然分解过程中土壤微生物的数量动态 [J]. 厦门大学学报(自然科学版), 32(3): 365-370]
ZHAN RL, LI W, ZHENG FC, 2005. Studies on carbendazim-resistance of Colletotrichum gloeosporioides on mango fruit [J]. Chin J Plant Protect, 32(1): 71-76. [詹儒林, 李伟, 郑服丛, 2005. 芒果炭疽病菌对多菌灵的抗药性 [J]. 植物保护学报, 32(1): 71-76.]
ZHANG LB, CHANG JM, ZHAN RL, 2010. Advances in biocontrol to the diseases of postharvest mango [J]. J Trop Crop, 31(8): 1427-1432.[张鲁斌, 常金梅, 詹儒林, 2010. 芒果采后病害生物防治研究进展 [J]. 热带作物学报, 31(8): 1427-1432.]
ZHOU SQ, HUANG XL, HUANG DY, et al., 2010. A rapid method for extracting DNA from actinomycete by Chelex-100 [J]. Biotechnol Bull, (2): 123-125.[周双清, 黄小龙, 黄东益, 等, 2010. Chelex-100快速提取放线菌DNA作为PCR扩增模板 [J]. 生物技术通报, (2): 123-125.]
ZHAO YH, ZHANG SL, WU JF, et al., 2018. Screening the diversity and activity of culturable bacteria isolated from mangrove rhizosphere soil at Shankou [J]. Acta Oceanol Sin, 40(8): 138-151.[赵雅慧, 张舒琳, 吴家法, 等, 2018. 山口红树林根际土壤可培养细菌多样性及其活性筛选 [J]. 海洋学报, 40(8): 138-151.]
(责任编辑 李 莉 王登惠)
