HIF-1α通过激活Notch通路缓解活性氧诱导的心肌细胞凋亡
2023-05-20冯桂菊王守燕
冯桂菊 张 红 王守燕 郭 依 沈 鑫 钟 霞
山东第一医科大学附属省立医院全科医学科,山东 济南 250021
冠心病是指由冠状动脉狭窄或阻塞引起的一类疾病,近年来,我国冠心病的发病率呈上升趋势。急性心肌梗死是冠心病最严重的表现形式,急性心肌梗死后早期心肌再灌注是挽救濒死心肌以及改善临床预后的最有效措施[1-3]。但是,缺血会增加自由基和活性氧的产生,并且这些物质的产生会在再灌注后进一步增加[4],引起心肌损伤,即缺血再灌注损伤,严重影响缺血性心肌病患者的预后。因此,寻找缓解心肌细胞损伤的方法已成为近年来心肌梗死治疗的研究重点。
缺 氧 诱 导 因 子1(hypoxia inducible factor-1, HIF-1)是一种有助于机体对缺氧产生适应性反应的核因子,是由HIF-1α 和HIF-1β 亚基组成的异二聚体。虽然HIF-1β 是缺氧诱导因子1 的组成性成分,但HIF-1α 在缺氧反应中表达上调,因此,HIF-1的活性主要取决于HIF-1α 的表达水平[5-6]。研究表明,HIF-1α具有心肌保护作用并可预防缺血再灌注损伤[7]。缺血再灌注损伤由很多因素介导,其中包括活性氧(reactive oxygen species, ROS)的产生增加,尤其发生在再灌注时[8]。但是,HIF-1α 在ROS诱导的心肌细胞损伤中的作用尚未被完全揭示。
Notch 信号通路是一种高度保守的信号通路,参与多种生理过程,如细胞分化、增殖、凋亡和再生[9]。Notch 信号通路参与了心肌损伤中的心脏保护作用,当Notch配体与相邻细胞上的受体结合时,诱导了Notch 受体蛋白水解裂解,并从细胞膜上释放Notch 胞内结构域(notch intracellular domain, NICD)。然后NICD进入细胞核,组装成一个转录激活复合物,激活下游靶基因的转录。Notch 信号通路的激活可有效减轻缺血损伤,调节心肌梗死后的心脏自我修复并保护心肌细胞免于凋亡[10]。研究证明,HIF-1α可以影响Notch通路[11-12]。
本研究探讨了HIF-1α 在ROS 诱导的心肌细胞凋亡中的作用以及其潜在的分子机制。
1 材料与方法
1.1 细胞培养与处理
AC16 心肌细胞系购自北京北纳生物。AC16细胞在DMEM 高糖培养基(Gibco,赛默飞世尔科技公司,上海)中培养,添加100 u/mL 链霉素,100 u/mL 青霉素和10%胎牛血清(FBS),在37 ℃和5% CO2条件下培养。为诱导AC16 的氧化损伤,刺激活性氧积累,采用不同浓度的H2O2(50、100、200、400 μmol/L)处理AC16 细胞构建缺血再灌注心肌氧化损伤模型。
1.2 实时定量聚合酶链反应(qRT-PCR)
使用AG RNAex Pro 试剂(艾科瑞生物技术公司)从心肌细胞中分离总RNA,在-80 ℃保存至分析。用NanoDrop 2000 定量测定RNA 的浓度和纯度。采用EvoM-MLV Ⅱ逆转录试剂盒(艾科瑞生物技术公司)通过逆转录合成第一链cDNA进行分析。根据 LightCycler®480 SYBR Green I Master qRTPCR检测系统的标准方案检测目的基因相对表达。引物由艾科瑞生物技术公司合成。GAPDH 正向引物:GCACCGTCAAGGCTGAGAAC,反向引物:TGGTGAAGACGCCAGTGGA;HIF-1α 正 向 引 物:TGATTGCATCTCCATCTCCTACC,反向引物:GACTCAAAGCGACAGATAACACG。mRNA 相对表达量采用2-ΔΔCq法进行分析。
1.3 CCK-8法检测细胞活力
将AC16细胞以每孔1 × 104个细胞的密度接种于96孔板中,孵育过夜。每孔中加入10 μL CCK-8溶液(博奥森生物技术有限公司),黑暗环境中37 ℃孵育1 h。最后,用Thermo Multiskan GO记录在450 nm波长处的光密度(optical density, OD)。
1.4 细胞转染
HIF-1α小干扰RNA(siRNA)和阴性对照(NC)购自吉满生物公司。AC16细胞接种在6孔板中,当细胞生长到60% 融合时,按照说明书,使用Lipofectamine 2000将siRNA和NC转染到细胞中。
1.5 流式细胞术
采用Annexin V-FITC 凋亡检测试剂盒(BD 公司)检测AC16细胞的凋亡百分率。将AC16细胞置于24孔板中,孵育过夜。用胰蛋白酶法收集心肌细胞,用磷酸盐缓冲液(phosphate buffered solution, PBS)冲洗。离心后,将收获的细胞在Annexin VFITC结合缓冲液中重悬。然后收集细胞,用PBS洗涤,并再次悬浮在避光的碘化丙啶(propidium iodide, PI)溶 液 中。 最 后 采 用 流 式 细 胞 仪(Beckman FC 400 MPL,USA)分析凋亡细胞。
1.6 蛋白印迹
用RIPA 裂解缓冲液(索莱宝科技有限公司)在冰上提取蛋白质。用BCA法测定蛋白浓度(索莱宝科技有限公司)。蛋白质样品在十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶中分离,然后转移到PVDF 膜上。5%脱脂牛奶孵育1 h,然后与一抗(Bax、Bcl2、NICD 和Hes1)在4 ℃下孵育过夜。将PVDF膜与适当的二抗在25 ℃下孵育2 h,然后用TBST 洗涤。最后使用电化学发光(electrogenerated chemiluminescence, ECL)法检测目的蛋白质,并使用Amersham Imager 600软件分析条带。
1.7 统计学分析
采用GraphPad Prism 8.0 软件和SPSS 25.0 软件进行统计学分析。所有数据均来自至少3次独立的实验,并以均数 ± 标准差表示。差异采用独立样本t检验或单因素方差分析。检验水准α= 0.05。
2 结 果
2.1 体外模型的建立及细胞模型中HIF-1α的表达水平
采 用50、100、200、400 μmol/L 的H2O2诱 导AC16 细胞损伤,结果发现,与未经处理的细胞相比,经H2O2处理后,AC16心肌细胞的细胞活力逐渐下降。当H2O2浓度达到200 μmol/L 时,AC16 心肌细胞的活力明显降低(表1)。采用qRT-PCR 检测不同处理时间(6、12、24 h)下AC16 心肌细胞中HIF-1α 的表达变化,发现H2O2处理后AC16 心肌细胞中HIF-1α 的表达较未处理的细胞增加。在H2O2处理的细胞中,HIF-1α 的表达也呈时间依赖性的增加(表2)。为保证实验效果,本研究采用200 μmol/L H2O2处理24 h,构建了AC16 细胞氧化损伤模型。
表1 CCK-8检测不同浓度H2O2处理24 h后的细胞活力( ± s)

表1 CCK-8检测不同浓度H2O2处理24 h后的细胞活力( ± s)
注:对照组的细胞活力已标准化为1。与对照组比较,aP < 0.05;与对照组比较,bP < 0.01。
分组对照组过氧化氢处理组 50 μmol/L 100 μmol/L 200 μmol/L 400 μmol/L细胞活力值1 0.68 ± 0.15 0.65 ± 0.14 0.56 ± 0.15a 0.51 ± 0.14b 6.409 0.008 FP
表2 qPCR法检测H2O2 (200 μmol/L)处理不同时间后HIF-1α mRNA的表达量( ± s)

表2 qPCR法检测H2O2 (200 μmol/L)处理不同时间后HIF-1α mRNA的表达量( ± s)
注:与对照组比较,aP < 0.001。
分组对照组过氧化氢处理组6 h 12 h 24 h HIF-1α mRNA的表达量1.01 ± 0.14 FP 2.04 ± 0.20 3.39 ± 0.45a 4.16 ± 0.81a 25.600< 0.001
2.2 HIF-1α 敲低加重了H2O2诱导的AC16 心肌细胞凋亡
为了检测HIF-1α 是否参与了H2O2诱导的AC16 心肌细胞凋亡,本研究使用HIF-1α 特异性小干扰RNA(si-HIF-1α)转染AC16 心肌细胞,并采用qRT-PCR 检测转染效率。结果表明,在AC16 心肌细胞中转染si-HIF-1α 使HIF-1α 表达水平降低到33.9%(0.34 ± 0.10vs. 1.00 ± 0.06,P< 0.001)。CCK-8 实验结果表明,敲除HIF-1α 可以增加H2O2对AC16 心肌细胞活力的伤害作用(表3)。促凋亡相关蛋白(Bax)在H2O2处理的心肌细胞中表达上调,并在HIF-1α 敲低后进一步升高。抗凋亡相关蛋白(Bcl-2)在H2O2处理的AC16 心肌细胞中下调,而HIF-1α 下调则逆转(图1、表4)。流式细胞术结果显示,与NC 组相比,HIF-1α 敲低增加了H2O2处理组心肌细胞的凋亡率(图2、表5)。
表3 CCK-8检测敲低HIF-1α对心肌细胞活力的影响( ± s)

表3 CCK-8检测敲低HIF-1α对心肌细胞活力的影响( ± s)
注:与空白对照组比较,aP < 0.001;与H2O2刺激+空白转染组比较,bP < 0.05。
细胞活力值1.15 ± 0.14 0.66 ± 0.05a 0.60 ± 0.11a 0.29 ± 0.03b 44.230< 0.001分组空白对照组H2O2刺激组H2O2刺激+空白转染组si-HIF-1α转染组FP
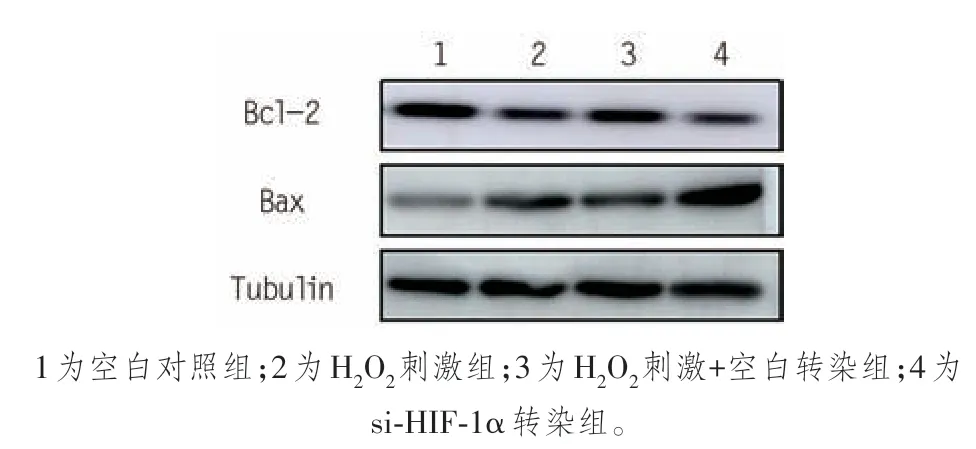
图1 免疫印迹法检测各组凋亡相关蛋白表达
表4 免疫印迹法检测敲低HIF-1α对Bax和Bcl-2蛋白表达的影响( ± s)

表4 免疫印迹法检测敲低HIF-1α对Bax和Bcl-2蛋白表达的影响( ± s)
注:与空白对照组比较,aP < 0.05;与H2O2刺激+空白转染组比较,bP < 0.05;与H2O2刺激+空白转染组比较, cP < 0.001。
Bax 0.30 ± 0.04 0.59 ± 0.06a 0.42 ± 0.12 1.12 ± 0.15c 37.82< 0.001分组空白对照组H2O2刺激组H2O2刺激+空白转染组si-HIF-1α转染组FP Bcl-2 1.07 ± 0.08 0.70 ± 0.03a 0.89 ± 0.23a 0.51 ± 0.11b 9.471 0.005
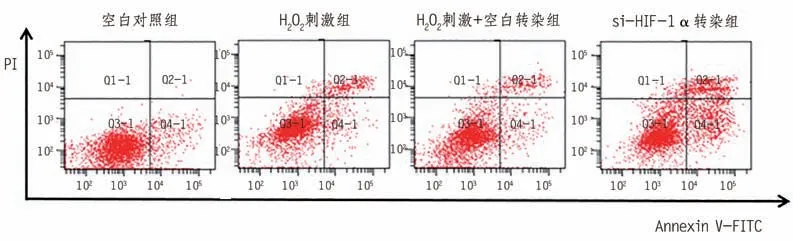
图2 流式细胞术检测细胞凋亡
表5 流式细胞术检测敲低HIF-1α对心肌细胞凋亡率的影响(± s)

表5 流式细胞术检测敲低HIF-1α对心肌细胞凋亡率的影响(± s)
注:与空白对照组比较,aP < 0.05;与H2O2刺激+空白转染组比较,bP < 0.001。
分组空白对照组H2O2刺激组H2O2刺激+空白转染组si-HIF-1α转染组FP凋亡率/%6.13 ± 0.12 13.10 ± 0.40a 13.80 ± 0.44a 27.77 ± 5.19b 36.161 0.001
2.3 HIF-1α敲低抑制了Notch信号通路。
为了评估HIF-1α 是否能够调控Notch 信号通路,采用si-HIF-1α 处理AC16 心肌细胞,分析H2O2处理24 h后Notch信号关键成分的表达。免疫印迹结果显示,H2O2增加了NICD 和Hes1(Notch 的活性形式和Notch下游效应物)的蛋白表达,敲低HIF-1α的心肌细胞中,NICD 和Hes1 的蛋白表达下调(图3、表6)。
表6 免疫印迹法检测敲低HIF-1α对Notch信号相关蛋白表达的影响(± s)

表6 免疫印迹法检测敲低HIF-1α对Notch信号相关蛋白表达的影响(± s)
注:与空白对照组比较,aP < 0.05;与H2O2刺激+空白转染组比较,bP < 0.05;与H2O2刺激+空白转染组比较,cP < 0.001。
分组空白对照组H2O2刺激组H2O2刺激+空白转染组si-HIF-1α转染组FP Hes1 0.24 ± 0.05 0.63 ± 0.08a 0.63 ± 0.10a 0.31 ± 0.10b 16.881< 0.001 NICD 0.46 ± 0.07 0.64 ± 0.04a 0.71 ± 0.07a 0.40 ± 0.07c 15.542 0.001

图3 免疫印迹法检测各组Notch信号相关蛋白表达量
3 讨 论
尽管近几十年来在心血管疾病的预防、诊断和治疗方面取得了较大进展,但这些疾病仍然是导致死亡的主要原因之一。心肌梗死是一种潜在的致命性疾病,威胁着全世界数百万人的生命[13]。随着介入技术的发展,冠状动脉介入治疗已成为心肌梗死患者治疗的首选,极大提高了患者生存率[14]。但是,心肌缺血再灌注损伤成为了冠状动脉介入治疗不可避免的问题。心肌缺血再灌注在使心脏功能恢复的同时,可导致线粒体中的活性氧爆发[15],可能会加剧心肌细胞结构和功能障碍,这种现象被称为缺血再灌注损伤。因此,如何缓解缺血再灌注导致的心肌损伤至关重要。
氧化应激以ROS的积累为特征,ROS在多种细胞活动中起着重要作用[16]。在生理情况下,循环系统输送氧气,线粒体不断地将氧气转化为代谢产物,并产生适当水平的ROS 以促进细胞的增殖[17];在缺氧状态下, ROS 的过度累积会引起线粒体功能障碍,进而引发细胞内稳态失衡、代谢紊乱,最终导致细胞死亡[18]。在心肌缺血再灌注过程中细胞内氧稳态的失衡增加了ROS的产生。本研究中,采用H2O2刺激心肌细胞模拟了缺血再灌注过程中ROS 的产生。HIF-1α 是对缺氧反应的主要转录调控因子,主要在心肌中表达[19]。研究表明,HIF-1α在心肌梗死和缺血再灌注中发挥重要作用,HIF-1α可增强心肌梗死后的心脏修复[20]。HIF-1α 通过调节糖酵解和能量代谢而激活,从而提高心肌细胞对缺血缺氧的耐受性,减少心肌细胞的凋亡。因此,在ROS 刺激下机体可通过代偿性上调HIF-1α 的表达来改变心肌代谢,以提高心肌细胞对缺血、缺氧的耐受。本研究也证明了这一结论。
心肌缺血再灌注导致心肌细胞损伤,包括心肌细胞凋亡和坏死[21]。心肌缺血再灌注损伤中过量产生的ROS 是心肌细胞凋亡的主要原因[22]。心肌细胞的凋亡在心肌细胞损伤和心功能不全中起着关键作用[23-24]。因此,本研究评估了HIF-1α对心肌细胞凋亡的作用。H2O2减弱心肌细胞活力,加重心肌细胞损伤,增加心肌细胞凋亡,而敲低HIF-1α 进一步加重上述情况,并通过下调Bcl-2和上调Bax来抑制细胞凋亡。这证实了HIF-1α的心肌保护作用,其水平上调可以抑制ROS 诱导损伤后心肌细胞的凋亡。
Notch 信号可以通过促进心肌再生、保护缺血心肌、诱导血管生成、负调控心脏成纤维细胞-肌成纤维细胞转化来修复心肌损伤。研究证明,HIF-1α可以影响Notch通路[11-12]。为了证明Notch信号通路在心肌细胞损伤中的保护作用,本研究通过敲低HIF-1α表达来证明其相关性,结果表明,Notch信号的已知成分如NICD 和Hes1 的表达受到HIF-1α 的调控,H2O2增加了心肌细胞中NICD和Hes1的表达。然而,在敲低HIF-1α的情况下NICD和Hes1的表达反而下降。
综上,HIF-1α 可能会通过Notch 信号通路调控Bax 和Bcl-2 表达来调控心肌细胞缺血再灌注过程中ROS 诱导的心肌细胞凋亡。这些数据将为未来急性心肌梗死缺血再灌注的治疗提供一个潜在的靶点。本研究可能有以下局限性:首先,HIF-1α 调控Notch 信号通路的确切机制尚不清楚,不能排除其他参与调控HIF-1α心肌细胞损伤的其他机制;此外,HIF-1α对体内心脏损伤和心脏恢复功能的影响还需要在未来的研究中进行评估。
志谢 感谢上海海天医药科技开发有限公司对本研究的资助。
利益冲突所有作者均声明不存在利益冲突