红茶茶黄素含量的测定方法研究
2023-05-20覃丽霞
◎ 华 艳,覃丽霞
(1.广西壮族自治区特种设备检验研究院,广西 南宁 530000;2.广西壮族自治区产品质量检验研究院,广西 南宁 530000)
茶黄素具有良好的抗氧化、抗炎、防癌抗癌、降脂和预防心血管疾病的功效,是红茶品质优劣的重要指标,准确测定红茶中茶黄素的含量可有效指导红茶科学生产。1957 年,Roberts 首次发现茶黄素(Theaflavins),并提出了茶黄素的定量测定方法,即分光光度法[1]。茶黄素是一类溶于乙酸乙酯的橙黄色物质,是由茶多酚及其衍生物氧化形成的具有多个羟基或酚羟基的苯并卓酚酮结构的化合物[2]。目前,已发现茶黄素的种类达20 多种,但含量较高且进行深入研究的成分主要有茶黄素(Theaflavin,TF)、茶黄素-3-没食子酸酯(Theaflavin-3-Gallate,TF-3-G)、茶黄素-3'-没食子酸酯(TF-3'-G)和茶黄素-3,3'-双没食子酸酯(Theaflavin 3,3'-Digallate,TFDG)4 种[3]。
茶黄素的测定方法有Robert 法、α-氨基乙基二苯硼酸酯(Flavognost)法、Sepha-dex LH-20 柱色谱法和气相色谱法和高效液相色谱法等[4]。由于Robert法和Flavognost 法受到多种因素的影响,测定结果偏差大;Sepha-dex LH-20 柱色谱法操作复杂;气相色谱法需要用衍生化法对茶黄素进行分析,该法烦琐,在茶黄素的分析中使用不多[5]。而高效液相色谱法较为成熟,具有较高的灵敏度和精确度,可以快速、准确地测定红茶中的茶黄素。因此,本文采用高效液相色谱法对8 种红茶中的茶黄素含量进行测定,分析红茶中茶黄素的含量。
1 材料与方法
1.1 材料与试剂
8 种红茶样品有滇红、祁门工夫、川红工夫、祁红毛峰、黄金茶红茶、正山小种红茶、宁红工夫和宜红工夫;TF、TF-3-G、TF-3'-G 和TFDG 标准品,纯度均大于98%(上海融禾医药科技发展有限公司);乙腈(色谱纯,德国默克公司);冰乙酸(色谱纯,阿拉丁试剂有限公司);甲醇(分析纯,北京化工厂);乙酸乙酯(分析纯,天津市化学试剂一厂);水为Milli-Q 超纯水。
1.2 仪器设备
1260 高效液相色谱仪和DAD 检测器(美国安捷伦公司);BP211D 型电子精密天平(德国赛多利天平有限公司);Allegra 64R 台式冷冻高速离心机(美国Beckman Coulter 公司);数显恒温水浴锅(江苏水北科普实验仪器厂)。
1.3 实验方法
1.3.1 标准溶液的制备
分别精密称取4 类茶黄素标准品25 mg 于25 mL容量瓶中,用甲醇定容得到1 mg·mL-1的标准储备液。取1 mL 标准储备液置于5 mL 容量瓶中,用体积分数为20%的甲醇溶液定容,得200 μg·mL-1的混合标准溶液。分别取混合标准溶液0.1 mL、0.5 mL、2.5 mL、5.0 mL、10.0 mL,用甲醇水溶液定容至10.0 mL 的容量瓶中,稀释成质量浓度为2 μg·mL-1、10 μg·mL-1、50 μg·mL-1、100 μg·mL-1和200 μg·mL-1的标准曲线工作液。
1.3.2 样品溶液的制备
称取均匀磨碎的8 种红茶样品1 g(精确至0.001 g)加入20 mL 体积分数为70%的甲醇溶液,通过恒温水浴锅70 ℃浸提10 min,再使用冷冻高速离心机离心10 min,取上清液于50 mL 容量瓶中。残渣操作步骤同上,最后合并加70%甲醇定容,制得待测样品。每个样品重复3 次,外标法分析计算8 种茶样中TF、TF-3-G、TF-3'-G 和TFDG 的含量。
1.3.3 色谱条件
根据《茶叶中茶黄素的测定 高效液相色谱法》(GB/T 30483—2013),色谱柱为Agilent ZORBAX SB-C18(250 mm×4.6 mm,5 μm); 流 动 相 为2%乙酸水溶液(A)和乙腈+乙酸乙酯(B);流速为1.0 mL·min-1;柱温30 ℃,检测波长为280 nm,进样量10 μL;采用梯度洗脱,流动相B 在0 ~15 min时0%→20%,15 ~25 min 时20%→30%,并保持5 min,在30 min 时30%→20%,维持10 min。
2 结果与分析
2.1 流动相条件的优化
红茶中茶黄素的测定多采用乙腈-2%乙酸水溶液为流动相,因此采用乙腈-2%乙酸水溶液作溶剂系统,4 种茶黄素类物质只有TF-3-G、TF-3'-G 实现分离,TF、TFDG 无法分离,通过改变洗脱梯度程序可以分离,但不能满足快速分离的要求。此方法色谱图峰型差、拖尾严重、分离效果差,不利于定量计算。通过加入一定量的乙酸乙酯,明显改善了分离效果,峰型尖锐、不拖尾,缩短了检测时间。但由于样品中杂质峰较多,为了使茶黄素类物质与杂质可以有效分离,经多次优化梯度洗脱程序,乙腈+乙酸乙酯的体积分数在10 min 内由20%增加到30%,整个分析过程为40 min,4 种茶黄素类物质实现分离。
2.2 色谱柱的选择
选择Agilent ZORBAX SB-C18色谱柱,由于该色谱柱可以承受较低pH 值的流动相,pH 值为1 ~8。当流动相的pH 值在2 左右时分析样品,不仅可以保证色谱柱无损坏,同时具有良好的分离度和峰型。
2.3 检测波长的确定
通过DAD 检测器进行光谱扫描发现,4 种茶黄素类物质在260 ~280 nm、360 ~380 nm 和450 ~470 nm均有吸收峰,最大吸收值在波长280 nm 左右,故选择280 nm 作为检测波长。
2.4 标准曲线、检出限和定量限
按照色谱条件对配制好的2 ~200 μg·mL-1的标准溶液进行测定,分别以质量浓度和峰面积为横坐标和纵坐标,绘制标准曲线,求得回归方程。各物质标准曲线的相关系数R2>0.999,质量浓度与峰面积具有良好的线性相关性。将最低浓度的标准溶液进样,按照S/N=3 计算得出方法的检出限,按照S/N=10 计算得出方法的定量限,结果如表1 所示。
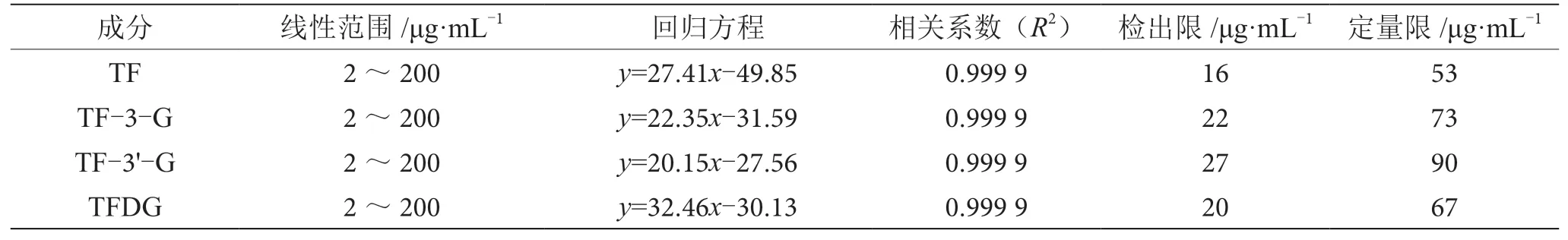
表1 线性范围、检出限和定量限结果表
2.5 精密度、重复性、稳定性实验
精密度、重复性、稳定性是高效液相色谱法的重要衡量指标。在1.3.3 的色谱条件下,按1.3.1 方法制备标准溶液连续进样5 次,根据4 种茶黄素类物质的峰面积,计算相对标准偏差(RSD),得出精密度、重复性和稳定性分别为2.4%~3.5%、1.98%~4.76%、2.28%~3.91%,见图1。表明该方法可以稳定、准确检测出样品中的4 种茶黄素类物质,具有良好的精密度、重复性和稳定性。

图1 高效液相色谱法的精密度、重复性、稳定性验证结果图
2.6 加标回收实验
向样品中加入低、中、高3 个浓度水平的茶黄素标准品进行加标实验,按色谱条件进行测定,每份样品进行5 次平行测定,计算不同浓度水平样品的加标回收率和RSD,结果见表2。在3 个加标水平下,平均加标回收率为96.05%~105.02%,RSD 为1.39%~2.28%,结果表明该方法准确度高。

表2 加标回收率实验结果表(n=5)
2.7 样品测定
制备8 种红茶供试样品,采用建立的分析方法测定茶黄素含量,结果见表3。样品中黄金茶红茶的茶黄素总含量最高,正山小种红茶最低。不同品种红茶中茶黄素总量存在差别,本次测定的8 种红茶样品的茶黄素总含量在0.56%~0.82%,平均总含量为0.70%。其中,TFDG 在所有茶黄素类物质中含量最高,平均含量达到0.41%,最高含量达到0.51%,明显高于其他3 种茶黄素。
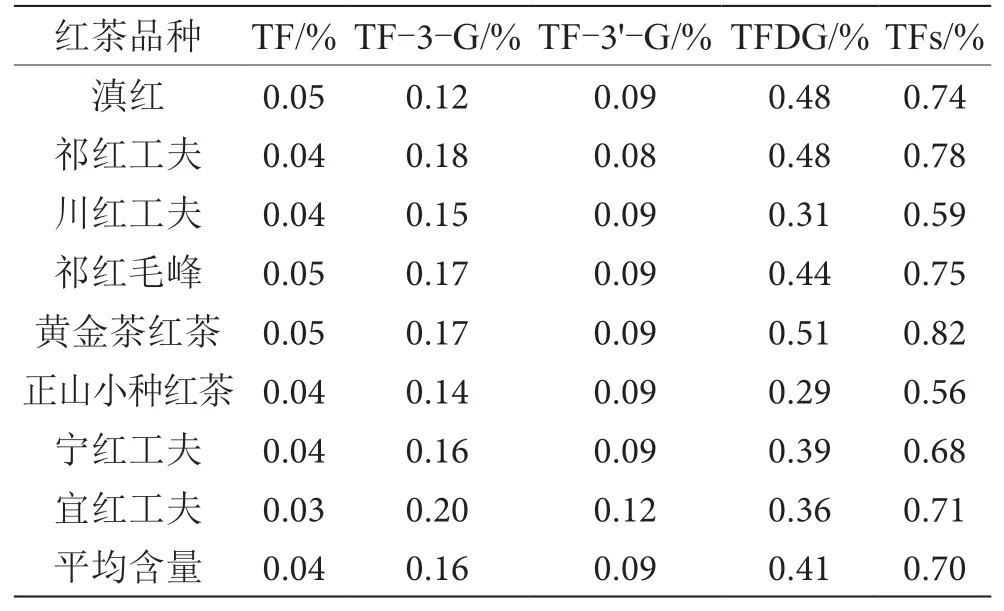
表3 8 种红茶样品中茶黄素含量测定结果表
3 结论与讨论
红茶中的茶黄素类物质有多种,由于样本和含量限制,本文对流动相条件进行了优化,建立了适用于4 种茶黄素类物质含量测定的高效液相色谱法。通过一系列方法学验证,证明该方法线性和精密度良好,准确度高,可作为检测红茶制品的重要依据。经分析发现,8 种红茶样品中4 种茶黄素类物质总含量在0.56%~0.82%,平均总含量为0.70%。其中,黄金茶红茶的4 种茶黄素类物质含量最高,正山小种红茶的4 种茶黄素类物质含量最低。结果表明高效液相色谱法可以快速准确地检测红茶中4 种茶黄素类物质的含量,更好地促进红茶品质的研究发展。而随着茶黄素研究的不断深入,将来会朝着高效液相色谱法为主的多种技术联合应用方向发展。
