尼罗罗非鱼跨膜Bax抑制剂母体6基因Tmbim 6的克隆、表达及功能鉴定
2023-05-19巫祎琴陈福暖张志强江栢坚简纪常黄瑜
巫祎琴,陈福暖,张志强,江栢坚,简纪常,黄瑜
(广东海洋大学 水产学院,广东省水产动物病害防控与健康养殖重点实验室,广东 湛江 524088)
细胞凋亡又称细胞程序性死亡,是在真核生物中进化的一种常见的生理过程,目的是去除多余的、受感染的或受损的细胞,以维持内环境动态平衡[1],在细胞发育、衰老、伤口愈合和清除病原体等生理活动中起着关键作用[2]。研究者现已阐明了多种导致细胞凋亡的途径,如线粒体依赖(内部)、线粒体非依赖性(外部)和内质网(ER)介导的途径[3]等。
跨膜Bax抑制剂母体6(transmembrane Bax inhibitor motif containing 6,TMBIM 6),又称Bax抑制剂-1(Bax inhibitor-1,BI-1),1994年在成年大鼠睾丸的cDNA文库筛选时被首次发现,并命名为Tegt(testis enhanced gene expression),随后于1998年在酵母中被鉴定为是一种抗凋亡蛋白,可以抑制Bax的促凋亡作用[4]。TMBIM 6主要定位在内质网膜和核外膜,含有6~7个跨膜结构域,主要功能是保护细胞免受内质网应激诱导的细胞凋亡[5]。内质网是细胞内钙离子的主要储存区,在蛋白质的合成和折叠过程中起着重要作用,内质网腔内错误折叠与未折叠蛋白聚集及钙离子平衡紊乱均可以引起内质网应激,激活未折叠蛋白反应(unfolded protein response,UPR)、内质网超负荷反应和Caspase-12介导的细胞凋亡途径。TMBIM 6作为一种抗凋亡蛋白,其过表达可以通过抑制Bax的激活与易位、Caspase的激活和降低细胞内钙水平等来保护内质网应激诱导的细胞凋亡[6]。研究发现,TMBIM 6可以抑制UPR途径中肌醇酶1α(inositol-requiring enzyme-1α,IRE1α)的蛋白活性,阻止其下游c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)的激活,从而通过抑制Caspase-12活性来阻止细胞凋亡[7]。
TMBIM 6还参与细胞内钙稳态[8]、活性氧簇(ROS)调节[9]、细胞免疫反应[10],以及细胞增殖、凋亡和分化[11]等多种生理过程。Lisak等[10]研究发现,TMBIM 6通过调节淋巴细胞内的钙稳态,在适应性免疫系统的功能中发挥重要作用,缺乏TMBIM 6功能的小鼠中,胞浆和内质网的钙离子水平升高,导致T细胞和B细胞功能出现障碍。此外,内质网应激与NK-κB的激活有着直接而密切的联系,内质网应激后,活化的IRE1α通过肿瘤坏死因子受体相关因子-2(tumor necrosis factor receptor-associated factors 2,TRAF2)与IKK形成复合体,进一步激活IκB的上游激酶IKK,诱导IKK的磷酸化,从而导致IkB降解和NF-κB激活[12]。
近年来,有关TMBIM 6和TMBIM 6类蛋白参与细胞发育及其对生物和非生物胁迫的研究相继报道[13],但对TMBIM 6在鱼类病原性感染中的作用知之甚少。目前,已经鉴定出Tmbim6的硬骨鱼类有斜带石斑鱼(Epinepheluscoioides)[14]、暗纹东方鲀(Takifuguobscurus)[15],以及甲壳类的克氏螯虾(Procambarusclarkii)[16]和贝类的栉孔扇贝(Chlamysfarreri)[17]等。Du等[16]使用RNAi下调克氏螯虾Tmbim6表达,结果显示,在克氏螯虾TMBIM 6功能缺失后,对白斑综合征病毒感染后诱导的细胞死亡率显著增加。而在石斑鱼虹彩病毒感染斜带石斑鱼过程中,Tmbim6过表达则可以抑制病毒诱导的细胞死亡、Caspase-3活性和病毒基因转录[14]。由此可见,TMBIM 6是细胞凋亡的重要调节因子,在鱼类抵抗病原体感染过程中参与了机体对细胞凋亡的作用。
尼罗罗非鱼(Oreochromisniloticus)作为中国优质的水产养殖品种之一,为渔业经济带来了巨大的收益。近年来,以无乳链球菌(Streptococcusagalactiae)为主的罗非鱼链球菌病及罗非鱼湖病毒病在国内外时有发生,给尼罗罗非鱼养殖业造成严重的经济损失[18-19]。本研究中,对尼罗罗非鱼Tmbim6进行克隆与鉴定,分析了该基因在健康鱼组织中的分布模式及细菌与病毒感染后的表达变化,研究了TMBIM 6的亚细胞定位及其对NF-κB通路的影响,以期为探究尼罗罗非鱼TMBIM 6的生物学功能及免疫调节功能提供科学参考。
1 材料与方法
1.1 材料
1.1.1 试验动物 尼罗罗非鱼(体质量为80~100 g)购于广东省湛江市某养殖场,于广东省水产动物病害防控与健康养殖重点实验室暂养30 d后用于正式试验,水温控制在(28±5)℃。本试验中涉及试验动物的所有操作均严格遵守广东海洋大学动物伦理委员会决议内容及广东省实验室动物管理条例相关要求执行。
1.1.2 细胞、载体和试剂 HEK-293T、无乳链球菌菌株(ZQ0901)由广东省水产动物病害防控与健康养殖重点实验室分离及保存;RNA提取试剂盒(TransZolUp Plus RNA Kit)、cDNA反转录试剂盒(Trans Script One-Step gDNA Removal and cDNA Synthesis Super Mix )和实时荧光定量PCR试剂盒(TransStart®Green qPCR SuperMix)均购自北京全式金生物技术公司;DH5α感受态细胞、PCR引物均购自生工生物工程(上海)股份有限公司;2×MagicTaq DNA聚合酶、pMD-19T载体均购自TaKaRa公司;青霉素-链霉素溶液(100×)、pEGFP-N1和pcDNA 3.1载体均购自碧云天生物技术有限公司;T4 DNA Ligase、QuickCutTMEcoR Ⅰ、QuickCutTMXho Ⅰ、Opti-MEM 培养基、Bovine Serum、Trypsin-EDTA(0.05%)、LipofectamineTM3000 Transfection Reagent试剂盒、普通质粒提取试剂盒(Plasmid Miniprep Kit)和PCR产物纯化试剂盒(Thermo ScientificTMGene JETTMGel Extraction Kit)均购自Thermo公司;去内毒素质粒提取试剂盒(E.Z.N.ATMEndo-Free Plasmid Mini Kit Ⅱ)购自Omega公司;Poly I:C购自Sigma-Aldrich公司。
1.2 方法
1.2.1 引物设计与合成 根据Tmbim6基因序列(GenBank No. XM_003457055.5),利用Primer Premier 5.0软件设计Tmbim6基因的PCR和qPCR引物(表1),以尼罗罗非鱼β-actin作为内参基因。引物由生工生物工程(上海)股份有限公司合成。
1.2.2 总RNA提取及Tmbim6开放阅读框克隆 随机抽取3尾实验室暂养1个月的尼罗罗非鱼,取其头肾组织,使用TransZol up传统法进行RNA提取,提取的总RNA测定浓度后,按照反转录试剂盒合成cDNA。以取得的cDNA为模板,以带EcoR Ⅰ和Xho Ⅰ酶切位点的Tmbim6-F/Tmbim6-R引物对Tmbim6开放阅读框(open reading franme,ORF)片段进行克隆,经核酸电泳检测后进行PCR产物纯化回收。随后将纯化的PCR产物连接至pMD-19T载体中,并将构建的重组质粒pMD19T-Tmbim6质粒转化至DH5α感受态细胞中(冰上操作),在37 ℃下振荡(150 r/min)培育1 h后,涂布于含Amp+(氨苄西林)的LB平板上,培养8 h以上;挑取大小均匀的圆形单菌落进行菌落PCR鉴定后,再挑选阳性克隆送至生工生物工程(上海)股份有限公司测序。
1.2.3 生物信息学分析 对测序正确的Tmbim6序列进行分析,获得TMBIM 6氨基酸序列,并对其进行生物信息学分析,所用分析软件见表2。
表2 生物信息学分析软件Tab.2 Software for bioinformatics analysis
1.2.4 尼罗罗非鱼TMBIM 6在HEK-293T中的亚细胞定位 参照罗国玲等[20]的方法。对“1.2.2节”测序正确的菌液进行质粒提取,使用EcoR Ⅰ和Xho Ⅰ限制性快切酶对pMD19T-Tmbim6、pEGFP-N1质粒进行双酶切;酶切后的产物用PCR产物纯化试剂盒回收纯化后,使用T4酶在4 ℃下过夜连接,将连接产物转入DH5α感受态细胞中(操作同“1.2.2节”);选取测序正确的菌液培养后,对其去内毒素质粒进行提取,检测其浓度并经电泳验证后,暂存于-80 ℃超低温冰箱中。将提前接种于24孔板培养的HEK-293T(密度为80%~90%)按照LipofectamineTM3000 Transfection Reagent试剂盒进行转染操作。将25 μL/孔Opti-mem培养基与1 μL/孔LipofectamineTM3000混合,命名为A液;将25 μL/孔Opti-mem培养基、1 μL/孔P300TM3000和500 ng DNA混合(pEGFP-N1作为对照组,pEGFP-Tmbim6作为试验组),命名为B液;将A、B液等比例混匀后静置15 min,静置期间给HEK-293T更换无血清培养基,随后将混合液按每孔50 μL添加到细胞培养液中,前后摇动混匀。将细胞板置于含CO2的培养箱(37 ℃)中,转染6 h后换带血清的培养基;48 h后先用PBS清洗细胞,再加入体积分数为4%的多聚甲醛固定细胞,15 min后用PBS润洗两次;加入150 μL DAPI进行核染15 min,使用倒置荧光显微镜观察。
1.2.5 NF-κB信号通路活性的检测 参照罗国玲等[20]的方法。按照“1.2.4节”方法构建pcDNA 3.1-Tmbim6过表达质粒,并按照转染试剂盒LipofectamineTM3000 Transfection Reagent说明书,混合A、B 液,其中B液的DNA为启动子报告质粒(150 ng)、内参质粒PRL-TK(4 ng)及试验组 pcDNA 3.1-Tmbim6(150 ng)/对照组pcDNA 3.1(150 ng),将A、B液等比例混匀后静置15 min,共转染至HEK-293T内,设3个复孔。将细胞板置于培养箱培养24 h后,按照双荧光素酶报告基因检测试剂盒说明书,往细胞样品中加入 100 μL 细胞裂解液,充分裂解后将裂解产物置于离心机,以12 000 r/min离心30 s。取细胞上清裂解液20 μL,转移至96孔酶标板中,并往样品中加入100 μL的荧光素酶检测缓冲液,充分混匀后立即放入酶标仪中检测第一次发光值,并记录数值为A;然后加入海肾萤光素酶检测工作液(现配现用),再次放入酶标仪中检测第二次发光值,并记录数值为B。分别记录试验组及对照组的双荧光参数,计算A/B值。根据试验组与对照组的A/B值计算目的报告基因的激活程度。
1.2.6Tmbim6基因在健康组织中的表达模式 随机抽取5尾暂养的尼罗罗非鱼进行解剖,取其肝脏、脾脏、头肾、肠道、肌肉、血液和脑8个组织,按RNA提取试剂盒和cDNA反转录试剂盒中的说明,对样品进行RNA提取和cDNA合成,使用qPCR法检测8个组织中Tmbim6的表达情况。反应体系(10 μL):Mix 5.0 μL,ddH2O 3.5 μL,cDNA模板0.5 μL,qTmbim6上、下游引物各0.5 μL。反应程序:95 ℃下预变性30 s;95 ℃下变性15 s,60 ℃下退火15 s,72 ℃下复性20 s,共进行30个循环。反应结束后,用 2-ΔΔCt方法对qPCR数据进行分析。
1.2.7 无乳链球菌感染和Poly I:C免疫刺激后Tmbim6的表达变化 无乳链球菌组,采用腹腔注射法对每尾尼罗罗非鱼注射0.1 mL剂量为1×107cells/mL的无乳链球菌;Poly I:C组,每尾注射0.1 mL剂量为1 mg/mL的Poly I:C(PBS稀释);空白对照组,注射0.1 mL无菌PBS。在注射后的0、3、6、12、24、48 h 6个时间点取样,每个时间点随机各取3尾鱼,取适量脾脏、肝脏、头肾、肠道和脑组织,同法提取RNA并反转成cDNA,分别对所提取的样品进行qPCR检测,PCR反应体系和扩增程序同“1.2.6节”。
1.3 数据处理
试验数据均以平均值±标准差(mean±S.D.)表示。所有反应均设置 3 个生物学重复和 3 个技术重复。采用 SPSS 18.0 软件进行单因素方差分析及组间比较分析,显著性水平设为0.05。
2 结果与分析
2.1 Tmbim 6基因克隆及生物信息学分析
克隆获得的尼罗罗非鱼Tmbim6开放阅读框为714 bp,可编码237个氨基酸,不存在信号肽。预测其蛋白相对分子质量为26 500,理论等电点为9.16。多序列比对分析表明,尼罗罗非鱼与其他鱼类的TMBIM 6氨基酸序列一致性为81%~92%,与哺乳动物TMBIM 6的一致性为68%~74%(图1)。TMBIM 6氨基酸序列包含1个cAMP和cGMP依赖性蛋白激酶磷酸化位点,1个蛋白激酶C磷酸化位点,3个N-肉豆蔻酰化位点(图2)。保守结构域分析显示,有6个跨膜结构域(图2阴影部分)及1个C-末端基序(EKDKKKEKK)(图1)。

图1 尼罗罗非鱼与其他物种TMBIM 6氨基酸序列的多序列比对Fig.1 Multiple alignments of TMBIM 6 amino acid sequence of Oreochromis niloticus compared with other species

表示cAMP和cGMP依赖性蛋白激酶磷酸化位点;□表示蛋白激酶C磷酸化位点; 表示N-肉豆蔻酰化位点; 表示微体C端靶向信号;阴影表示跨膜结构域;*表示终止子。 stands for cAMP- and cGMP-dependent protein kinase phosphorylation site;□ stands for protein kinase C phosphorylation site; stands for N-myristoylation site; stands for microbodies C-terminal targeting signal;shadow area stands for transmembrane region;*stands for stop codon.图2 尼罗罗非鱼TMBIM 6氨基酸序列和功能位点分析Fig.2 Amino acid sequence and functional site of TMBIM 6 in Oreochromis niloticus
系统进化分析显示,尼罗罗非鱼TMBIM 6首先与金头鲷(Sparusaurata)、大西洋鳕(Gadusmorhua)聚为一支,然后与其他鱼类聚为一大类,表明其与金头鲷和大西洋鳕亲缘关系较近(图3)。

图3 尼罗罗非鱼TMBIM 6的系统发育进化分析Fig.3 Phylogenetic analysis of TMBIM 6 in Oreochromis niloticus
2.2 重组蛋白的亚细胞定位
将pEGFP-Tmbim6和空载pEGFP-N1分别转染HEK-293T细胞,以确定尼罗罗非鱼TMBIM 6在细胞内的定位。从图4可见,pEGFP-N1转染组绿色荧光均匀分布于整个细胞内,而pEGFP-Tmbim6转染组绿色荧光主要集中在细胞质中。
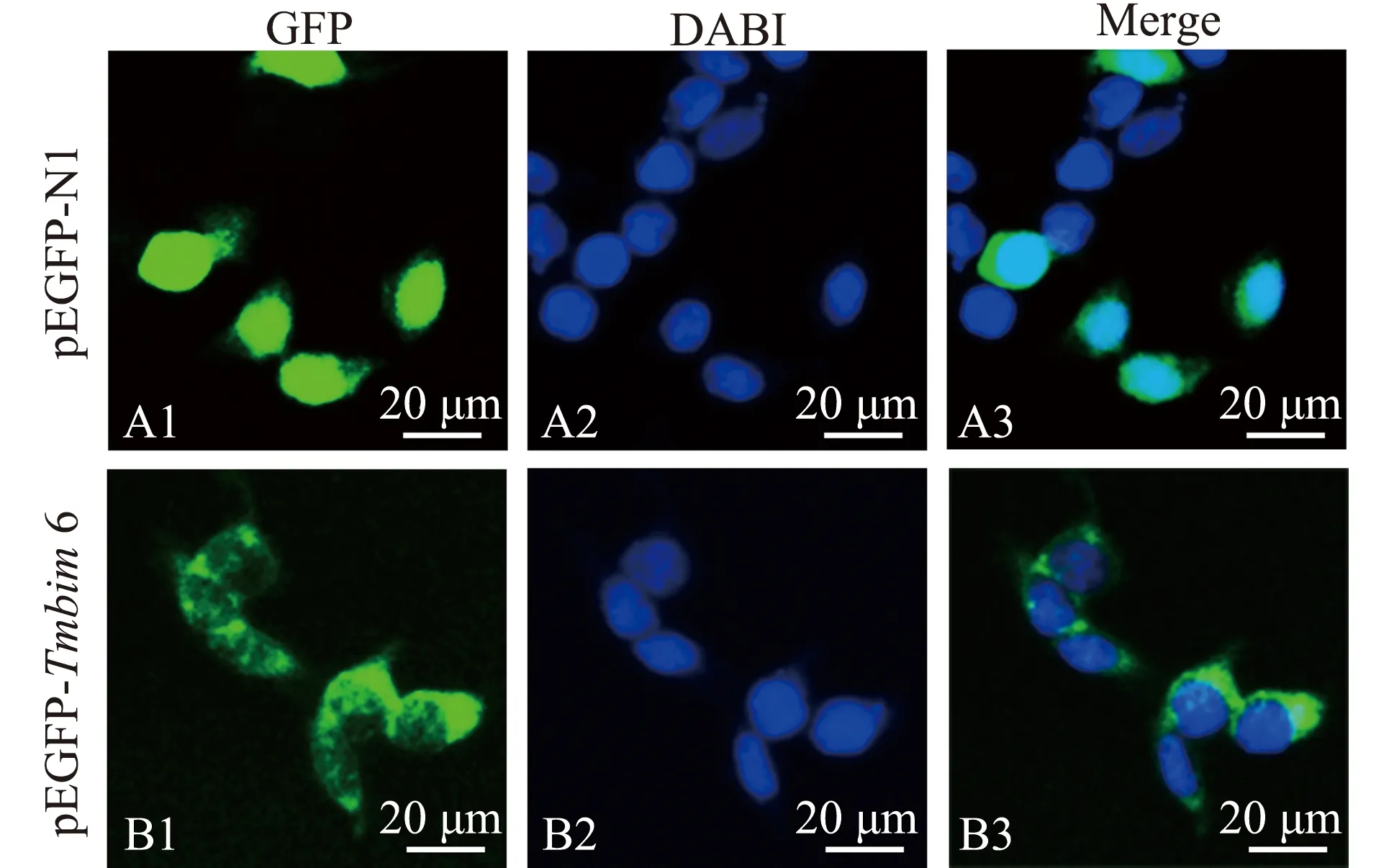
图4 TMBIM 6在HEK-293T中的亚细胞定位Fig.4 Subcellular localization of TMBIM 6 in HEK-293T
2.3 NF-κB信号通路的活性检测
双荧光素酶报告系统显示,尼罗罗非鱼Tmbim6在HEK-293T细胞中过表达后极显著抑制NF-κB信号通路活性(P<0.01)(图5)。

*表示与对照组有显著性差异(P<0.05);**表示与对照组有极显著性差异(P<0.01)。*means significant difference compared with the control(P<0.05);**means very significant difference compared with the control(P<0.01).图5 尼罗罗非鱼Tmbim 6过表达对NF-κB通路的影响Fig.5 Effect of Tmbim 6 over-expression on NF-κB pathway in Oreochromis niloticus
2.4 Tmbim 6基因在健康尼罗罗非鱼组织中的表达
从图6可见,Tmbim6基因在检测的8个组织中均有表达,其中,在肝脏中表达量最高(P<0.05),其次是肌肉、肠道和脑,在脾脏和头肾中表达量较低(P<0.05)。

标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)。The means with different letters are significantly different in the groups at the 0.05 probability level,and the means with the same letter are not significant differences.图6 Tmbim 6在尼罗罗非鱼不同组织中的表达量Fig.6 Expression levels of Tmbim 6 of Oreochromis niloticus in different tissues
2.5 无乳链球菌刺激后Tmbim 6的组织表达变化
从图7可见:经无乳链球菌攻毒后,肝脏中,尼罗罗非鱼Tmbim6基因的表达量在感染6 h时开始下调,12 h时表达量最低,而后开始上调,至48 h时达到峰值(P<0.05);脾脏中,Tmbim6表达量在6~12 h时显著上调(P<0.05),呈时序性表达模式;肠道中,Tmbim6表达量在6 h时显著上调至峰值(P<0.05),12 h时表达量与对照组相近,48 h时再次显著上调(P<0.05);头肾中,Tmbim6表达量在6 h时显著下调(P<0.05),12 h时恢复至正常水平,24 h后再次下调,最后于48 h时显著上调至峰值(P<0.05);脑中,Tmbim6表达量在感染后6~12 h时显著下调(P<0.05),24 h时显著上调至峰值(P<0.05),最后于48 h时恢复至正常水平。
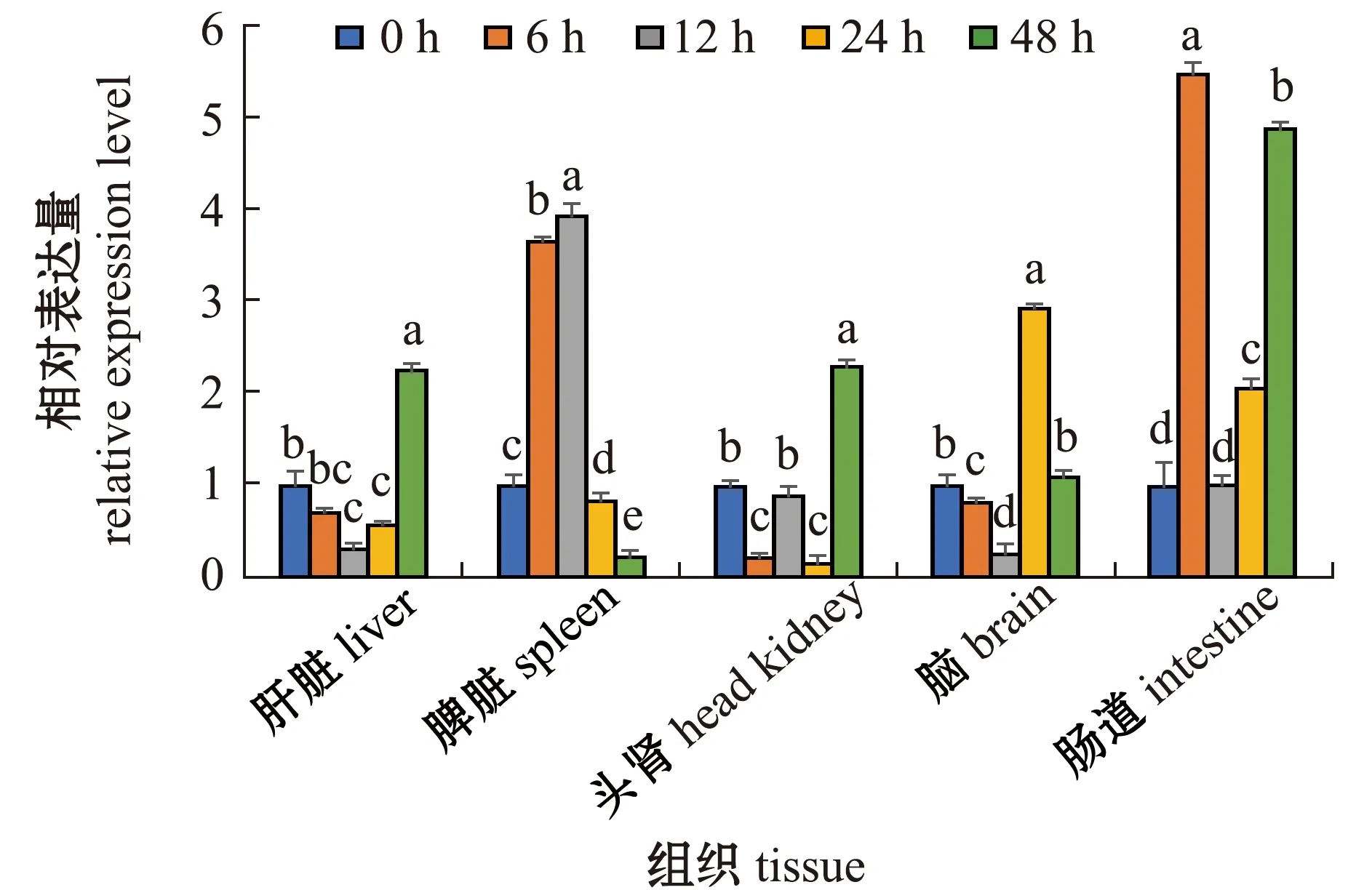
标有不同字母者表示同一组织中不同时间点间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。The means with different letters in the same tissue are significantly different in different time at the 0.05 probability level,and the means with the same letter are not significant differences,et sequentia.图7 无乳链球菌感染后尼罗罗非鱼组织中Tmbim 6的时序表达Fig.7 Temporal expression of Tmbim 6 in tissues of Oreochromis niloticus after infected by Streptococcus agalactiae
2.6 Poly I:C刺激后Tmbim 6的组织表达变化
从图8可见:经Poly I:C病毒类似物刺激后,尼罗罗非鱼肝脏、头肾、脑和肠道中Tmbim6基因的表达量均在3 h时开始显著上调(P<0.05),其中,肝脏和头肾中持续高表达至12 h时表达量显著下调(P<0.05),而在脑组织中6 h后表达量与对照组相差不大,在肠道中持续高表达至12 h时表达量下调至对照组水平,而后于24 h时再次显著上调(P<0.05);在脾脏中Tmbim6表达量于6 h时显著上调(P<0.05),之后显著下调(P<0.05)。
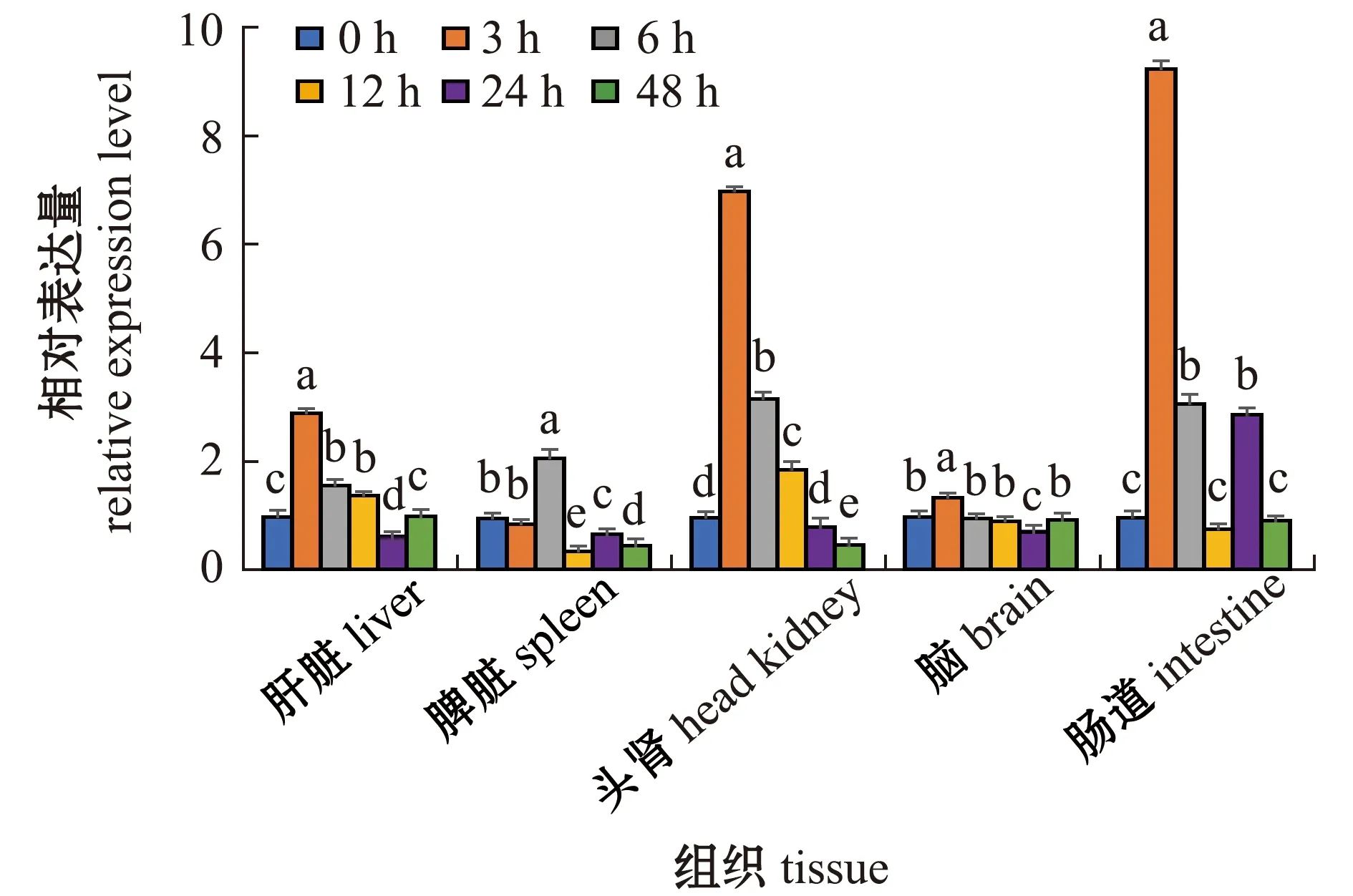
图8 Poly I:C刺激后尼罗罗非鱼组织中Tmbim 6的时序表达Fig.8 Temporal expression of Tmbim 6 in tissues of Oreochromis niloticus after infected by Poly I:C
3 讨论
3.1 尼罗罗非鱼TMBIM 6的生物信息学分析
本研究中,克隆得到尼罗罗非鱼Tmbim6的ORF为714 bp,可编码237个氨基酸。保守结构域分析显示,尼罗罗非鱼与哺乳动物的TMBIM 6相似,含有6个跨膜区和1个保守的C-末端基序(EKDKKKEKK),表明尼罗罗非鱼TMBIM 6可能与哺乳动物TMBIM 6具有相似的功能。据报道,斜带石斑鱼TMBIM 6的C-末端基序在抵抗病毒感染时起关键作用[14],且该段保守结构与TMBIM 6具有的抗细胞凋亡、ROS调节和钙调节等功能密不可分[21]。本研究中,通过SoftBerry-Psite预测发现,尼罗罗非鱼TMBIM 6蛋白包含1个蛋白激酶C磷酸化位点、1个cAMP和cGMP依赖性蛋白激酶磷酸化位点、3个N-肉豆蔻酰化位点及2个微体C端靶向信号,表明该蛋白在细胞生长、增殖、分化及信息传递中具有重要作用。系统进化分析表明,尼罗罗非鱼TMBIM 6与金头鲷亲缘关系最近。Blast分析显示,尼罗罗非鱼与其他鱼类TMBIM 6氨基酸序列的一致性为81%~92%,与哺乳动物TMBIM 6的一致性为68%~74%。以上结果说明TMBIM 6在进化上高度保守。
3.2 TMBIM 6亚细胞定位及对NF-κB信号通路的影响
亚细胞定位与蛋白质的功能和结构息息相关。已有研究表明,TMBIM 6是一种进化保守的内质网蛋白,主要定位在细胞的内质网膜和核外膜[22]。本试验中亚细胞定位显示,尼罗罗非鱼TMBIM 6主要定位于细胞质中,与对人类、暗纹东方鲀及斜带石斑鱼的研究结果相符[14-15]。
NF-κB是一类关键性的核转录因子,与免疫细胞活化和发育、应激反应及炎症反应等多种细胞活动密切相关[23]。NF-κB也是细胞凋亡的重要调节因子,与细胞凋亡等多种细胞活动存在密切关系,可通过多种途径抑制细胞凋亡[24]。研究表明,内质网应激后,活化的IRE1α通过TRAF2与IKK形成复合体,诱导IKK的磷酸化,导致IkB降解和NF-κB激活[12]。而TMBIM 6可以抑制UPR途径中IRE1α的蛋白活性,影响下游的信号分子传导,从而导致NF-κB的激活受到抑制[7]。Lisak等[10]研究发现,在TMBIM 6缺陷的小鼠中观察到NF-κB蛋白丰度和核转位增加。本研究中,通过构建TMBIM 6真核表达质粒并转染至HEK-293T细胞,采用双荧光素酶报告系统检测了尼罗罗非鱼TMBIM 6对NF-κB信号通路的影响,结果表明,Tmbim6在HEK-293T细胞中过表达后显著抑制NF-κB转录因子。综上,亚细胞定位及双荧光素报告基因结果均表明,尼罗罗非鱼TMBIM 6在进化过程中与其他物种的TMBIM 6具有相似的分布及功能特征。
3.3 尼罗罗非鱼Tmbim 6基因的组织表达模式
本研究发现,尼罗罗非鱼Tmbim6基因在脾脏、头肾、鳃、皮肤、脑、肠道、肌肉和肝脏8个组织中均有表达,这表明TMBIM 6对尼罗罗非鱼的正常生命活动起到一定作用。与高等脊椎动物相似[8],Tmbim6在肝脏与肌肉中的表达量显著高于其他组织。脊椎动物的肝脏不仅是新陈代谢的重要场所,也是重要的免疫器官[25],高表达的Tmbim6可抑制细胞凋亡,对维持肝脏正常新陈代谢及生理功能可能有重要作用[17]。而肌肉作为鱼类的结构组织和运动器官,Tmbim6在肌肉中高表达,推测其可能在尼罗罗非鱼生长发育过程的细胞增殖或分化中起到调节作用[11]。此外,Tmbim6在肠道、脑、皮肤和鳃中的表达水平相对较高,这些组织主要构成鱼类黏膜免疫系统,推测其可能参与尼罗罗非鱼非特异性免疫过程[26]。而脾脏和头肾作为鱼类的主要免疫器官[27],在其他鱼类中检测到Tmbim6在这两种组织中也高表达,如暗纹东方鲀及斜带石斑鱼[14-15],暗示Tmbim6可能参与了鱼类对病原体的免疫反应。
3.4 无乳链球菌感染和Poly I:C刺激后细胞的应激过程和免疫反应
为探究TMBIM 6在尼罗罗非鱼的功能,本研究中分别检测了无乳链球菌感染和Poly I:C刺激后,尼罗罗非鱼肝脏、脾脏、头肾、脑和肠道组织中Tmbim6基因的表达变化。免疫刺激后,鱼体出现反应迟钝、鱼体失衡和肛门红肿等不自然状态。解剖后发现,其腹腔积水,肝、脾和肾肿大,脑组织出血。无乳链球菌作为罗非鱼链球菌病的主要病原菌,传染性强、死亡率高[28]。肠道作为黏膜免疫器官,与外界环境接触,更容易接触病原;而肝脏作为重要代谢器官的同时也是免疫器官,其在免疫和新陈代谢中的双重作用,使该器官成为宿主防御病原体攻击时调整代谢功能的重要角色[25];头肾和脾脏是鱼类主要的造血和免疫组织,而无乳链球菌可以穿过血脑屏障感染脑部,导致脑环境紊乱,并引发脑膜炎[29-30]。在这5个不同组织中,经无乳链球菌感染后,尼罗罗非鱼Tmbim6的表达均呈现时间依赖性上调。TMBIM 6主要通过线粒体和内质网途径发挥对细胞凋亡的调节功能,在内质网途径中,TMBIM 6可抑制UPR途径中IRE1α的蛋白活性并阻止其下游JNK的激活,从而通过抑制Caspase 12来阻止细胞凋亡[6]。在线粒体凋亡过程中,细胞色素C通过线粒体外膜的膜孔释放出来,与凋亡激活因子1(apoptotic protease activating factor-1,APAF-1)结合,激活Caspase-9,从而导致细胞凋亡,在这个过程中,Bax利于线粒体膜孔的形成,促进凋亡蛋白的释放,进而促进细胞凋亡[6];而人的TMBIM 6蛋白可抑制小鼠Bax的促凋亡作用,说明TMBIM 6有抑制细胞凋亡的作用[4]。本研究中,Tmbim6的表达上调,暗示尼罗罗非鱼TMBIM 6在这5个组织中发挥细胞凋亡调节功能以响应机体的感染应激过程。此外,TMBIM 6还可以调节淋巴细胞内钙稳态,在适应性免疫系统的功能中发挥重要作用。本研究中,尼罗罗非鱼的肝脏、头肾和脑组织在无乳链球菌刺激后,Tmbim6的表达量在初期有所下降,可能是缺乏TMBIM 6后,淋巴细胞内胞浆和内质网的钙离子水平升高,导致T细胞和B细胞的功能出现障碍,故抑制了细胞免疫[10]。在溶藻弧菌感染暗纹东方鲀[15]及鳗弧菌感染克氏螯虾[16]后,Tmbim6的表达量也显著上调,与本研究结果类似。综上,尼罗罗非鱼TMBIM 6参与了无乳链球菌感染应激过程,其参与的细胞凋亡及免疫调节作用因器官或组织不同而有所差别。
本研究中,经Poly I:C刺激后,尼罗罗非鱼各组织中Tmbim6的表达量在3~6 h时显著上升,且呈时间依赖性表达,说明TMBIM 6在响应病毒刺激时较细菌刺激更迅速且敏捷。值得注意的是,Poly I:C模拟病毒刺激后,脑组织中Tmbim6的表达量比其他组织低且波动不大,这可能是由于鱼类血脑屏障的存在,阻止有害物质入侵,维持脑内环境稳态[31]。据相关研究显示,石斑鱼虹彩病毒感染斜带石斑鱼、白斑综合征病毒感染克氏螯虾及急性病毒性坏死症病毒感染栉孔扇贝后,Tmbim6的表达量皆显著升高[14,16-17],这表明TMBIM 6参与了抗病毒应激的细胞凋亡和免疫过程,与本研究结果类似。有趣的是,试验鱼被Poly I:C与无乳链球菌感染后,各组织中的Tmbim6表达量有所差异,可能是不同的刺激源诱导的细胞应激类型、细胞凋亡程度或者凋亡途径有所不同[32]。TMBIM 6的主要功能是保护细胞免受内质网应激诱导的细胞凋亡,其在尼罗罗非鱼中的高表达表明,TMBIM 6是细胞凋亡的重要调节因子,对保护细胞免受应激导致的细胞凋亡具有重要意义。
综上,尼罗罗非鱼TMBIM 6参与了Poly I:C刺激和无乳链球菌感染应激过程,在响应应激过程中可能发挥调节细胞凋亡及免疫的功能。
4 结论
1)从尼罗罗非鱼中克隆并鉴定了Tmbim6基因,生物信息分析表明,尼罗罗非鱼TMBIM 6蛋白与其他物种的TMBIM 6蛋白相似,含有6个跨膜区和1个保守的C-末端基序,说明TMBIM 6在进化上高度保守。
2)亚细胞定位显示,尼罗罗非鱼TMBIM 6主要位于细胞质。双荧光素酶报告基因系统检测发现,Tmbim6过表达后极显著性抑制NF-κB通路。说明尼罗罗非鱼TMBIM 6 与其他物种的TMBIM 6 具有相似的结构与功能特征。
3)尼罗罗非鱼Tmbim6基因在所检测组织中广泛分布,其中,在肝脏和肌肉中的表达量最高,在肠道、脑、皮肤和鳃中的表达水平相对较高,表明该基因在免疫应答中起重要作用。
4)在无乳链球菌和Poly I:C病毒类似物刺激后,尼罗罗非鱼Tmbim6的表达量显著上调,表明TMBIM 6参与了尼罗罗非鱼无乳链球菌感染和病毒刺激后的细胞应激过程和免疫反应。
