PLR在OSAHS患者新发脑梗死中的临床应用价值
2023-05-18章伟云孙云宇陈伟凯王发胜杨明刚唐金荣
章伟云,丁 宁,孙云宇,陈伟凯,王发胜,杨明刚,陈 聪*,唐金荣*
1南京医科大学第一附属医院神经内科,2呼吸科,3输血科,江苏 南京 210029;4盱眙县人民医院神经内科,江苏 淮安 223001
阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea hypopnea syndrome,OSAHS)是一种睡眠期间反复出现部分或完全暂停通气导致上呼吸道阻塞、间歇性低氧血症、胸内负压增加和睡眠频繁觉醒的疾病[1]。OSAHS与心脑血管疾病密切相关,研究已证实OSAHS 缓慢进展会导致心肌梗死、中风、心力衰竭和死亡的风险增加[2]。临床研究指出在30年的随访期内,OSAHS使脑梗死风险增加一倍[3]。早期正确诊断和评估OSAHS 严重程度并给予治疗对于脑梗死患者获得更好的临床结局至关重要。目前多导睡眠图(polysomnography,PSG)是确诊OSAHS及其严重程度分级的金标准,但PSG监测耗时,费用较高,被检测者的接受度低。生物标志物是可以代表生物功能的可测量参数,在机体内的变化常早于组织结构的变化和临床症状的出现。近年来血小板-淋巴细胞比值(platelet lymphocyte ratio,PLR)作为新兴的生物标志物,由全血细胞计数衍生而来,可用于反映心血管疾病中的炎症程度和血栓形成风险[4]。Xu等[5]研究表明在接受静脉溶栓治疗的急性脑梗死患者中,较高的PLR水平与不良预后和3个月后的病死率相关。本研究旨在探索生物标志物PLR与OSAHS患者新发脑梗死的关系,并在此基础上分析PLR 成为OSAHS 患者新发脑梗死的预测指标的可能性。
1 对象和方法
1.1 对象
本研究回顾性收集2016年1月—2022年4月期间就诊于南京医科大学第一附属医院神经内科及呼吸内科的155 例OSAHS 患者,其中,男115 例,女40例。纳入标准:OSAHS患者均符合阻塞性睡眠呼吸暂停低通气综合征的诊断标准,且均经PSG 检查AHI≥5次/h;年龄范围为18~75岁;入选者均知情同意。排除标准如下:患有中枢性睡眠呼吸暂停综合征、上呼吸道抵抗综合征、嗜睡症和运动障碍的OSAHS患者;患有肝肾疾病、慢性酒精中毒、恶性肿瘤、甲状腺功能亢进和甲状腺功能减退、静脉血栓栓塞等严重内科疾病(心、肺、肝、肾等重要脏器功能减退或衰竭)的患者;患有低氧性肺病,包括慢性阻塞性肺病、间质性肺病、哮喘等肺源性疾病的患者;患有炎性结缔组织疾病、炎性肠病等炎症指标异常的患者;近期输血史(<2周)和已知的血液病,如白血病或骨髓增生异常综合征;严重认知及交流障碍而不能配合者。本研究已通过伦理委员会审核(2020-SR-266),所有入组患者均签署知情同意书。
受试者根据有无新发脑梗死分为单纯OSAHS组(n=93)和OSAHS合并脑梗死组(n=62)。
入组新发脑梗死患者均为初次脑梗死发作,排除既往有脑梗死、脑出血、脑缺血病史患者。急性脑梗死发病均在7 d 内,且符合2018 年中国急性缺血性脑梗死诊治指南的诊断标准[6],并经头颅MR影像学检查确认。根据美国睡眠医学学会(AASM)工作组定义,以呼吸暂停低通气指数(AHI)评估OSAHS 的严重程度,将OSAHS 合并脑梗死组患者分为轻度组(5 次/h≤AHI<15 次/h)、中度组(15 次/h≤AHI<30次/h)和重度组(30次/h≤AHI)。收集研究对象的基线资料,包括年龄、性别、体重指数(BMI)、既往疾病史(高血压、糖尿病、高脂血症等)、吸烟史、饮酒史,以及所有受试者的PSG监测指标、血常规及影像学结果等。
1.2 方法
1.2.1 多导睡眠图
PSG 监测需要整夜不少于7 h 的睡眠。所有受试者在住院期间(入院后1 周内)病情稳定后,采用澳大利亚Compumedics公司的多导睡眠监测仪在睡眠呼吸监测试验室进行PSG 监测。记录项目如下:脑电图(采用F4A1、C4A1 和02A1 导联)、眼动电图(EOG)、下颌颏肌和胫前肌肌电图(EMG)、心电图(ECG),口鼻热敏传感器和鼻压力传感器记录口鼻气流,呼吸感应体积描记(RIP)记录呼吸运动,记录血氧饱和度、体位等。受试者检测当日禁饮酒及咖啡,停用镇静催眠药。PSG 数据通过计算机自动采集、数据处理分析,由神经内科PSG 专职医生进行分析审核。记录AHI、睡眠时血氧饱和度<90%的时间占睡眠总时间的百分比(TS90%)、氧减指数、平均氧饱和度及最低氧饱和度。
1.2.2 实验室分析
采用全自动血细胞分析仪检测患者入院24 h 内的血样,记录淋巴细胞计数(LYM)、血小板计数(PLT)、中性粒细胞计数(NEUT)、红细胞压积(HCT)、平均红细胞体积(MCV)、红细胞分布宽度变异系数(RDW-CV)、血小板压积(PCT)、平均血小板体积(MPV)、血小板分布宽度(PDW),计算NLR、PLR等。
1.3 统计学方法
应用SPSS25.0 软件进行临床资料统计学分析。计量资料以均数±标准差()或中位数(四分位数)表示,定性资料以例数或百分比表示。计量资料组间比较采用t检验或非参数检验,定性资料组间比较采用卡方检验,在检验简单相关分析变量之间的关系时,采用Pearson 或Spearman 相关系数法。运用Logistic 回归建立预测模型,并用ROC 曲线(受试者工作特征曲线)分析PLR 对OSAHS 患者新发脑梗死的预测效能。获得ROC 曲线下面积(area under curve,AUC)、敏感度、特异性、最佳截断值等模型评价指标。P<0.05为差异有统计学意义。
2 结果
2.1 患者一般资料比较
本研究共纳入符合入选标准的患者155例,根据受试者有无新发脑梗死分为单纯OSAHS 组93 例,OSAHS 合并脑梗死组62 例。两组患者淋巴细胞计数、中性粒细胞计数、血小板计数、NLR、PLR、AHI、TS90%差异有统计学意义(P<0.05),其余一般资料及既往病史比较差异无统计学意义。两组患者一般资料比较详见表1。
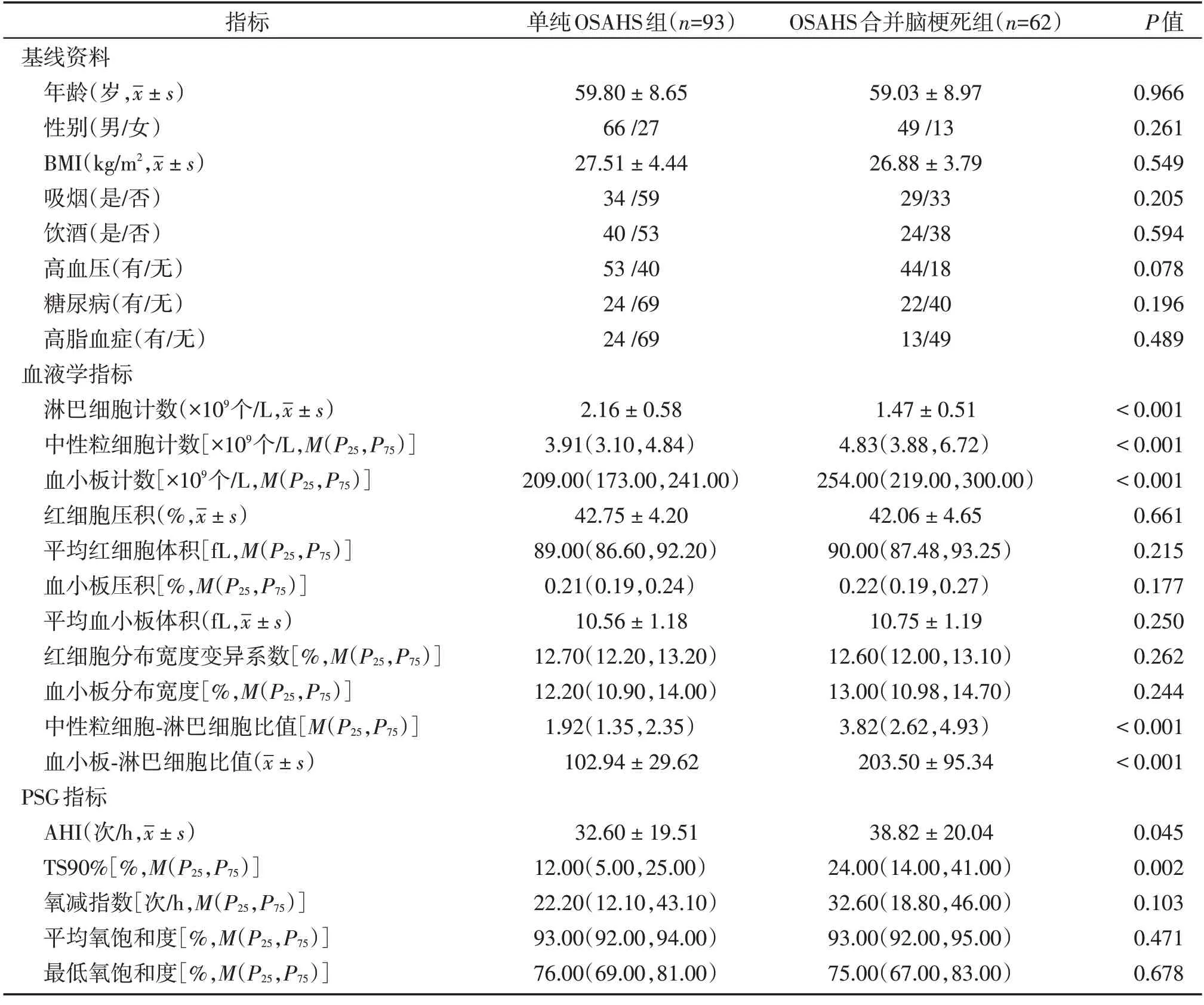
表1 研究人群的临床资料比较Table 1 Comparison of clinical data of the two groups
2.2 OSAHS合并脑梗死患者PSG监测指标和PLR、NLR之间的相关性
在OSAHS 合并脑梗死组中,PLR、NLR 与AHI、TS90%、氧减指数存在正相关(P<0.05),与平均氧饱和度、最低氧饱和度之间存在负相关(P<0.05,表2)。
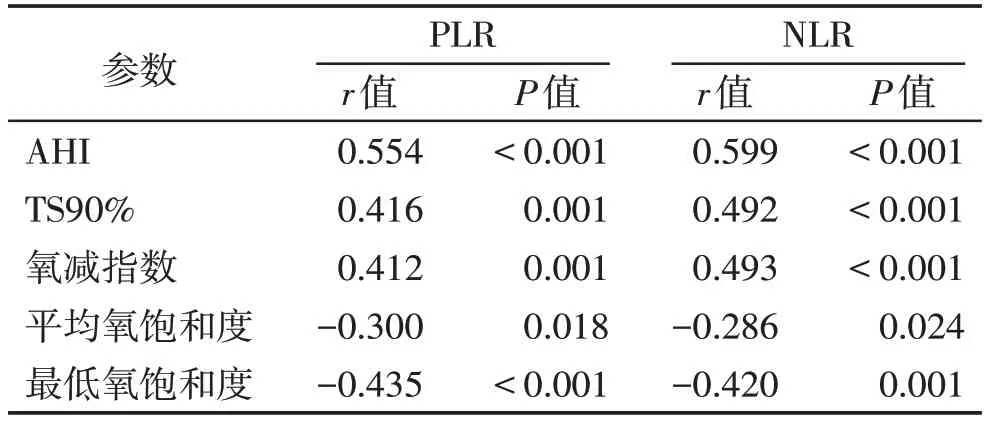
表2 PSG监测指标和实验室结果的相关性分析Table 2 Correlations between PSG results and laboratory results
62例OSAHS合并脑梗死组中,有9例(14.52%)轻度OSAHS,10 例(16.13%)中度OSAHS,43 例(69.35%)重度OSAHS。OSAHS 合并脑梗死患者血清PLR 值会随着AHI 值的增加有递增趋势(r=0.554,P<0.001),且重度OSAHS组血清PLR显著高于轻度OSAHS 组(P=0.008)和中度OSAHS 组(P=0.008,图1,2)。
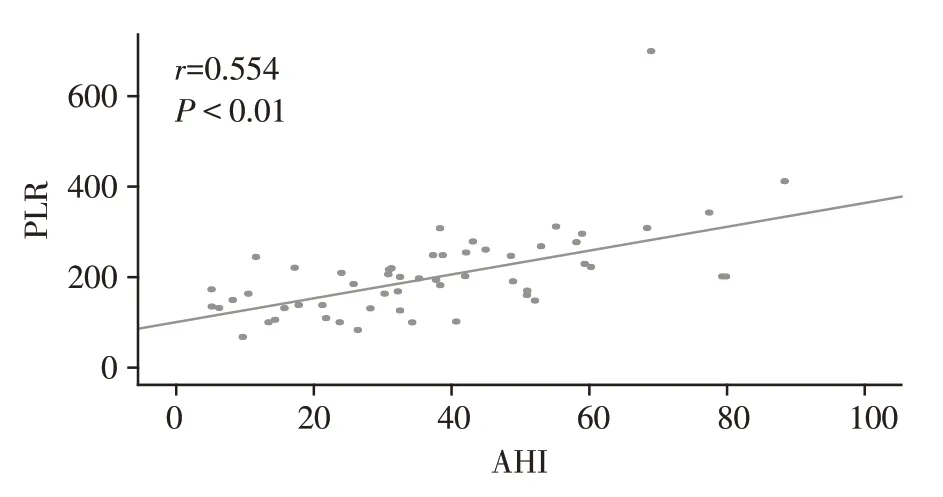
图1 PLR值与AHI呈正相关Figure 1 PLR was positively correlated with AHI
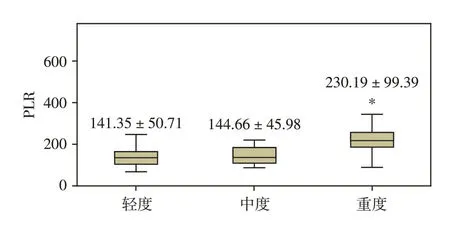
图2 PLR值-OSAHS严重程度分级Figure 2 PLR-severity of OSAHS
2.3 OSAHS 患者合并新发脑梗死影响因素的Logistics回归分析
将表1 中两组间有统计学差异(P<0.05)的指标纳入多因素Logistics 回归分析后,结果显示血清PLR(OR=1.040,95%CI:1.027~1.053)是OSAHS新发急性脑梗死事件的独立危险因素(P<0.001,表3)。
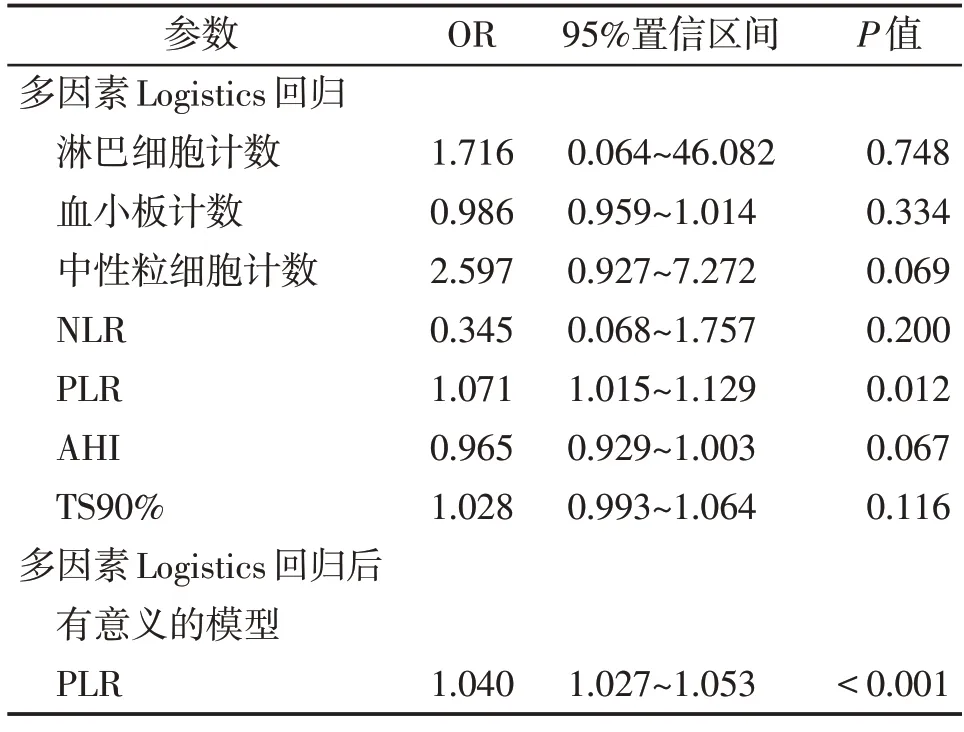
表3 Logistics回归分析Table 3 Logistics analysis
2.4 PLR对OSAHS患者新发脑梗死的预测价值
ROC曲线分析显示,PLR预测OSAHS患者新发脑梗死的AUC 为0.888(95%CI:0.832~0.945,P<0.001,图3),PLR处于最佳截断界值130.79时,敏感度为82.30%,特异性为83.90%。
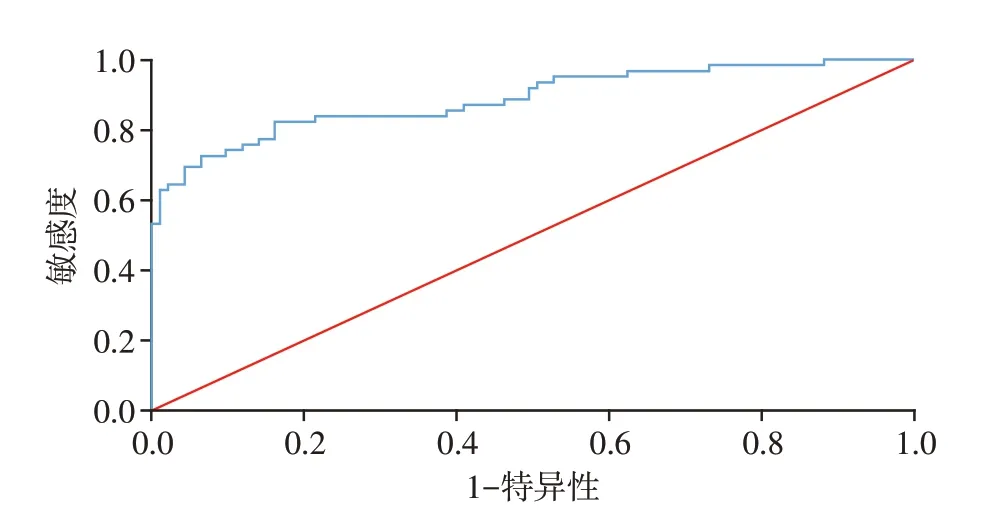
图3 ROC曲线分析(PLR)Figure 3 ROC curve analysis(PLR)
3 讨论
OSAHS 是临床常见的睡眠呼吸障碍疾病,OSAHS 是脑梗死发生以及复发的独立危险因素已成共识,但OSAHS 促发急性脑梗死的具体机制尚未明确。Popadic 等[7]研究表明OSAHS患者体内免疫紊乱、代谢异常,间歇性低氧刺激机体释放炎症因子,进一步诱发全身炎症反应。Wocf 等[8]认为全身炎症反应在动脉硬化和内皮功能障碍、血管重塑的发病机制中起着基础性作用,进而通过多种病理生理途径导致脑梗死的发生。Jensen 等[9]指出OSAHS患者的脑血管反应性降低,脑血流速度及脑血流量降低,进一步加剧脑损伤。此外有多项研究提出OSAHS 患者长期处于缺氧状态,损伤内皮细胞,释放大量血小板活化因子,加强血小板黏附、聚集功能,进一步导致高凝状态促发血栓形成[10-11]。由于全身炎症和由此引起的血管损伤是OSAHS继发脑梗死的共同潜在机制,寻找能反映全身炎症反应及凝血功能亢进的生物标志物则有利于判断病情变化及预后评估。
PLR 作为新兴的生物标志物,国内尚未报道其在OSAHS 与脑梗死关系中的临床应用。PLR 综合了血小板和淋巴细胞的预测信息,检测经济便捷,并且作为一个比率,比单个血液参数更稳定,目前逐渐受到关注[12]。本研究结果显示,与单纯OSAHS组比较,OSAHS 合并脑梗死组的患者体内NLR、PLR 值显著升高,差异有统计学意义(P<0.001)。该发现与前人的研究相符[13-14],提示OSAHS合并脑梗死组患者体内的炎症级联反应被激活。Spearman相关性分析显示,在OSAHS合并脑梗死组中,PLR、NLR 与AHI、TS90%、氧减指数呈正相关,与平均氧饱和度、最低氧饱和度之间存在负相关。PLR 值随着AHI 增加有递增趋势,提示PLR 或许可作为评估OSAHS 新发脑梗死患者的病情变化及临床追踪的指标。Logistic回归分析显示,PLR为OSAHS患者新发脑梗的独立危险因素(P<0.001)。ROC曲线分析结果示,PLR预测OSAHS患者新发脑梗死的AUC为0.888(95%CI:0.832~0.945),PLR 处于最佳截断界值130.79 时,敏感性82.30%,特异性83.90%,提示PLR有望成为临床上预测OSAHS患者新发脑梗死的有效生物标志物,有待进一步前瞻性研究加以证实。
PLR 体现OSAHS 促发脑梗死的病理生理途径尚不明确,Bikov等[15]认为可能与患者体内炎症活动增加及血栓前状态加重有关。另一项尸检研究表明[16],脑梗死区域白细胞上调、淋巴细胞减少与血脑屏障的破坏、内皮细胞的激活和复杂的神经激素反应有关。Phillipson 等[17]提出中性粒细胞通过吞噬作用、活性氧的产生、基质金属蛋白酶的释放等过程作为血管动脉粥样硬化和全身炎症反应的主要驱动因素。淋巴细胞介导固有免疫反应,其减少提示了机体的病理性应激状态,与机体炎症反应的增加有关[18]。多项研究表明急性脑梗死患者体内血小板功能异常,指明血小板活化反映了机体的血栓前状态,且血小板和血小板衍生的微囊泡对炎症细胞经激活的内皮细胞迁移的作用,诱导慢性炎症的级联反应,刺激血管平滑肌细胞的增殖和迁移,最终促进动脉粥样硬化血栓性疾病的发展[19-20]。综上可见PLR 可反映炎症和血栓前状态的变化,为OSAHS 患者脑梗死的发生提供了新的有预测意义的可计量指标,也为PLR值的临床应用提供了新的诊疗视角。
综上所述,在调整人口统计学变量、心脑血管危险因素后,OSAHS患者体内较高水平的PLR值与新发脑梗死的风险相关,OSAHS合并脑梗死患者血清PLR 值会随着AHI 值的增加有递增趋势;血清高PLR 值也将成为OSAHS 患者新发脑梗死的较为可靠的预测因子。这为OSAHS 患者中发生脑梗死高危人群的早期筛查、预防和治疗提供了新的依据。但由于本研究是回顾性研究且样本量不够充足,有待大规模、多中心前瞻性临床试验以进一步验证。
