mTOR信号通路在调控卵巢癌CD4+Treg糖代谢中的作用
2023-05-18刘书娜陶子琦
付 鑫,吴 茗,3,陈 献,刘书娜,张 磊,李 荣,徐 娟,陶子琦,王 婷,王 芳*
1南京医科大学第一附属医院检验学部,2国家医学检验临床医学研究中心分中心,江苏 南京 210029;3复旦大学附属儿科医院,国家儿童医学中心,上海 201102;4深圳市宝安区妇幼保健院检验科,广东 深圳 518000
卵巢癌(ovarian cancer,OC)是严重威胁女性健康的恶性肿瘤,其死亡率居生殖系统恶性肿瘤前列[1],由于其发病隐匿,发展迅速,容易在盆腹腔脏器广泛转移,多数卵巢癌患者初诊时已为晚期,预后极差。目前卵巢癌的基本治疗方案仍是根治性手术联合辅助性化疗,但卵巢癌化疗易耐药且易复发,治疗效果不甚理想[2],迫切需要新的有效治疗策略。免疫治疗有望成为最有希望的一种新型治疗方案,CD4+调节性T 细胞(regulatory T cell,Treg)介导的肿瘤微环境中的免疫抑制是肿瘤免疫治疗的关键障碍[3]。研究发现,T细胞在肿瘤微环境中被激活后其代谢方式发生改变,而不同的代谢方式又会影响T细胞的分化和功能发挥。肿瘤微环境中的“Warburg 效应”也与抑制性T细胞的产生相关,从而促进肿瘤免疫逃逸[4]。全面了解Treg的代谢特征以及控制代谢的关键调控分子对控制或逆转肿瘤免疫抑制微环境至关重要。本课题组前期研究表明,在卵巢癌细胞SKOV3的生长环境中,CD4+T细胞中Foxp3 阳性细胞比例上升,糖代谢水平增强[5-6],而其中介导糖代谢水平改变的关键调控分子有待研究。
哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是一种关键的调节细胞生存、代谢和免疫的蛋白激酶[6],作为细胞内非常重要的信号转导通路,其在调控卵巢癌CD4+Treg糖代谢中的作用尚未有报道。本研究从卵巢癌患者外周血CD4+Treg 中mTOR 信号活化情况入手,探究mTOR信号在调控CD4+Treg的糖代谢中的作用,为寻找卵巢癌新的免疫治疗靶点提供思路。
1 对象和方法
1.1 对象
收集2020年6月—2021年1月就诊于南京医科大学第一附属医院和南京市妇幼保健院的卵巢癌患者(OC)、卵巢良性肿瘤患者(ovarian benign tumor patients,BOT)和健康志愿者(healthy controls,HC)外周血标本各10 例。病例入组标准:临床诊断明确、未经任何治疗的初诊患者,无其他重大传染病史,不伴其他严重疾病,并排除糖尿病患者。本研究经南京医科大学第一附属医院伦理委员会批准(伦审号:2017-SRFA-064)。
健康对照外周血由健康志愿者提供。人卵巢浆液性囊腺癌细胞株SKOV3 来源自中科院上海细胞库。
淋巴细胞分离液Ficoll(天津灏洋生物制品有限公司);鼠抗人CD4、鼠抗人CD25、鼠抗人CD127、鼠抗人mTOR 抗体(BD 公司,德国);CD3/CD28 T 细胞扩增磁珠(Invivogen 公司,美国);PCR 引物(南京金斯瑞生物科技有限公司);RNeasy Micro Kit(Qiagen公司,美国);KRPH缓冲液(北京雷根生物技术有限公司);Prime Script RT reagent Kit(TaKa Ra 公司,日本);糖摄取分析试剂盒(Biovision公司,美国);兔抗人GAPDH 单克隆抗体(上海碧云天生物技术有限公司);SYBR Premix Ex TaqTMⅡ(大连宝生物工程有限公司);兔抗人p-mTOR 单克隆抗体、兔抗人p-P70S6K 单克隆抗体、兔抗人p-4E-BP1 单克隆抗体、兔抗人LDH-α单克隆抗体、兔抗人Glut1单克隆抗体、兔抗人PKM2单克隆抗体、兔抗人GPI单克隆抗体、兔抗人HIF-1α单克隆抗体(Cell Signaling 公司,美国);糖酵解分析试剂盒(Cayman公司,美国)。
1.2 方法
1.2.1 流式检测外周血中mTOR+CD4+Treg百分比
使用Ficoll 液密度梯度离心法分离外周血单个核细胞,于流式管中加入一定浓度的抗体如下:鼠抗人CD4、鼠抗人CD25、鼠抗人CD127、鼠抗人mTOR 抗体,经孵育、洗涤后使用BD FACS Calibur流式细胞仪检测。
1.2.2 流式分选和扩增CD4+Treg细胞
抽取健康志愿者外周血50 mL,Ficoll 液分离外周血单个核细胞,无菌条件下加入以下抗体:鼠抗人CD4、鼠抗人CD25、鼠抗人CD127,室温孵育20 min,全程注意避光操作,最后用PBS 清洗2 次,并进行流式分选(BD FACS AriaⅡ),收集分选的细胞铺入圆底96孔板中,并加入Treg细胞扩增磁珠进行细胞培养。
1.2.3 SKOV3细胞与CD4+Tregs共培养体系的建立
体系最终体积1.5 mL/孔,在Transwell板的下室加入2×105个SKOV3细胞,在上室加入8×105个CD4+Tregs,37 ℃、5%CO2培养箱培养72 h后,收集共培养前、后各组的CD4+Treg细胞,用于后续实验。
1.2.4 荧光定量PCR
各处理组CD4+Treg细胞分别收集,使用RNeasy Micro Kit 试剂盒按说明书步骤提取总RNA,并调整RNA 浓度为500 ng/mL,采用Prime Script RT reagent Kit 试剂盒,37 ℃15 min,85 ℃5 s 条件下进行RNA逆转录,荧光定量PCR 用于检测mTOR 信号通路相关AKT、Rheb、mTOR、HIF-1α、4E-BP1、TSC2、P70S6K 基因、糖代谢相关TPI、PKM2、Glut3、ENO1、Glut1、LDH-α、GPI 基因的mRNA 表达水平,扩增程序:按SYBR Premix Ex TaqTMⅡ试剂盒推荐程序。引物序列见表1。

表1 引物序列一览表Table 1 PCR primer sequences
1.2.5 细胞总蛋白提取和Western blot
收集各组CD4+Tregs,蛋白裂解液用于提取细胞总蛋白,测定浓度后加入5×蛋白上样缓冲液进行稀释,金属浴加热煮沸,-20 ℃保存。随后使用10%分离胶进行Western blot 电泳,浓缩胶用80 V 电泳,至蛋白压缩至分离胶且marker 分散后将电压调整为100 V。待电泳结束,以100 mA 转膜1 h 50 min,载有蛋白的PVDF膜在5%脱脂奶粉溶液、室温摇晃下封闭3 h 后,放入一抗中4 ℃孵育过夜,次日1×TBST 洗膜3 次后,加入HRP 标记的山羊抗兔IgG 二抗室温孵育2 h,1×TBST 再次洗膜3 次,PVDF 膜表面均匀加入发光试剂后曝光成像。
1.2.6 糖摄取实验
收集各组CD4+Tregs 细胞,PBS 清洗计数,加入3×105个/孔细胞于平底96 孔板中,每孔用无血清培养基补足体积至100 μL,饥饿细胞过夜,第2 天用PBS 洗涤细胞后,加入2%BSA 的KRPH 缓冲液100 μL/孔,预孵育40 min后,加入10 mmol/L 2-脱氧葡萄糖(2-DG)10 μL/孔,孵育20 min,按说明书充分反应后检测412 nm波长的吸光度值,每10 min检测1 次,糖摄取水平为吸光度值根据标准曲线将细胞摄取葡萄糖类似物2-DG的含量换算得到。
1.2.7 糖酵解水平测定
收集各组CD4+Treg 细胞,PBS 洗涤后,于96 孔板中加入细胞3×105个/孔,加入RPMI 1640培养基补足体积为200 μL/孔,培养箱中培养24 h后离心收集上清液,比色法检测上清液中L-乳酸的含量,再根据标准曲线转化为糖酵解水平。
1.3 统计学方法
所有数据使用SPSS 25.0 统计学软件进行数据分析,同时使用Image Lab 软件提取Western blot 图像的数据。各组数据均以均值±标准差()表示,两组间的对比在正态性检验之后用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 卵巢癌患者外周血中mTOR+的CD4+Treg 百分比升高
OC、BOT和HC组外周血,分离得到外周血单个核细胞后,应用流式细胞术检测其mTOR+CD4+Treg的百分比(图1),结果显示OC 外周血中mTOR+CD4+Treg 比例显著高于HC[(77.4 ± 8.12)%vs.(64.19±9.7)%,P<0.01],OC组与BOT组相比差异无统计学意义[(77.4 ± 8.12)%vs.(74.6 ± 9.25)%,P>0.05],表明OC 患者外周血中mTOR+的CD4+Treg比例升高。

图1 卵巢癌患者、卵巢良性肿瘤患者和健康对照者外周血中mTOR+CD4+Treg 比例Figure 1 The percentages of mTOR+CD4+Treg in peripheral blood of OC,BOT and HC
2.2 卵巢癌细胞的生长促进人外周血CD4+Treg中mTOR的表达
为了进一步研究mTOR 信号通路在CD4+Treg中的作用,建立CD4+Treg与SKOV3 共培养体系,将分选扩增后的CD4+Treg与卵巢癌细胞SKOV3共培养3 d,流式分选检测mTOR+的CD4+Treg百分比,结果显示CD4+Treg 与SKOV3共培养后mTOR+细胞百分比明显升高(P<0.05,图2A、B);RT-PCR 检测其mTOR 信号通路相关基因的表达水平,发现除TSC2 外,SKOV3 共培养组CD4+Treg 的mTOR 信号相关基因的表达水平均高于CD4+Treg单独培养组(图3C);Western blot 检测其mTOR 通路相关蛋白表达水平,SKOV3 共培养组CD4+Treg 的mTOR 信号通路相关蛋白(p-mTOR,p-P70S6K、p-4EBP1)的表达水平高于CD4+Treg 单独培养组(图2D)。以上结果提示卵巢癌细胞的生长会促进人外周血CD4+Treg 中mTOR 的表达和下游信号通路的活化。

图2 卵巢癌细胞的生长促进人外周血CD4+Treg中mTOR的表达Figure 2 The growth of ovarian cancer cells promotes the expression of mTOR in CD4+Treg in human peripheral blood
2.3 阻断SKOV3生长环境中CD4+Treg的mTOR信号后其糖摄取和糖酵解水平下降
使用mTOR分子抑制剂雷帕霉素阻断与SKOV3共培养后CD4+Treg的mTOR信号后,其糖代谢特征变化情况如图3所示。与对照组相比,雷帕霉素处理组CD4+Treg 的葡萄糖摄取(OD 值:3.31±0.19vs.3.04±0.21,P<0.01;2-脱氧葡萄糖换算值:193.49±13.28vs.174.05±14.58,P<0.01)和糖酵解(OD 值:1.82±0.07vs.0.39±0.13,P<0.001;L-乳酸相对值:21.97±0.87vs.4.85±1.54,P<0.001)水平降低,差异有统计学意义,提示mTOR 信号与卵巢癌患者CD4+Treg的糖代谢过程密切相关。

图3 SKOV3 生长环境中阻断mTOR 信号前后CD4+Treg的糖摄取(A)和糖酵解(B)水平Figure 3 The glucose uptake(A)and glycolysis(B)levels of CD4+ Treg before and after blocking mTOR signals in SKOV3 growth environment
2.4 阻断SKOV3生长环境中CD4+Treg的mTOR信号后其糖代谢相关基因和蛋白水平下调
接下来,使用雷帕霉素处理与SKOV3共培养后的CD4+Treg,RT-PCR 和Western blot 检测其糖代谢相关基因和蛋白的表达水平,雷帕霉素处理组CD4+Treg 糖代谢相关基因Glut1、Glut3、HIF-1α、TPI、LDH-α、PKM2、ENO1、GPI表达水平均下降(图4A),雷帕霉素处理组的糖代谢相关蛋白Glut1、PKM2、LDH-α、HIF-1α表达水平也下降(图4B~F),差异有统计学意义。提示在SKOV3生长环境中,mTOR 信号在调控CD4+Treg的糖代谢过程中发挥重要作用。
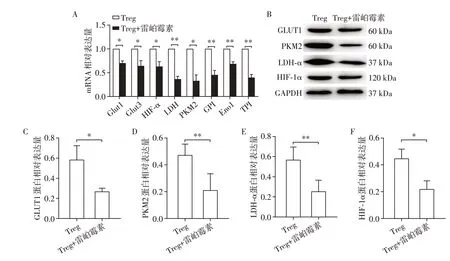
图4 阻断CD4+Treg的mTOR信号后其糖代谢相关基因和蛋白表达水平Figure 4 The expression levels of glucose metabolism-related genes and proteins of CD4+Treg cells after blocking the mTOR signal of CD4+Treg
3 讨论
近年来,卵巢癌的免疫疗法发展迅速,而卵巢癌免疫抑制微环境是肿瘤免疫逃逸和免疫治疗障碍的主要因素,Treg 细胞作为导致免疫抑制微环境形成的重要组成部分[7],了解与其增殖分化和抑制能力相关的重要调控分子有助于寻找肿瘤的关键治疗靶点。细胞代谢是癌细胞和免疫细胞维持其活力和功能的关键因素,在代谢限制的肿瘤微环境中,Treg细胞表现出更高的糖摄取和糖酵解能力,并依赖于有氧糖酵解维持其抑制功能[8]。全面了解Treg 细胞的代谢特征以及控制代谢的关键调控分子,进而可通过调控Treg 细胞的代谢,使其免疫抑制功能减弱,降低其对效应性T细胞功能的抑制,从而控制或逆转肿瘤微环境中的免疫抑制状态,有望为卵巢癌免疫治疗策略提示新思路[9]。本课题组前期研究发现卵巢癌患者外周血中CD4+Treg 糖代谢相关因子表达增高,糖代谢功能活跃[5,10],而其中调控糖代谢的关键分子尚未阐明。
mTOR 属于磷酸肌醇3-激酶(PI3K)相关激酶家族成员,是一种非典型的丝氨酸/苏氨酸蛋白激酶[11]。mTOR信号通路在促进细胞生长、导致凋亡、加速血管生成、介导自噬等过程中发挥着极其重要的生物学功能[12],其在肿瘤中通常被激活,与肿瘤的发生发展密切相关[13]。越来越多的证据表明mTOR 信号传导参与了多种免疫细胞的功能调节,也是决定T 细胞命运的主要参与者[14],且mTOR 信号在每个T 细胞亚群中都有着不同的作用,mTORC1 激活促进Th1、Th2、Th17 和效应性CD8+T细胞以及记忆性CD8+T细胞的生成,并在Treg细胞的稳定和激活中发挥重要作用[15-16]。为满足与T细胞激活相关的能量需求,T 细胞受体和共刺激信号以及细胞因子通过上游PI3K/AKT 信号网络调整mTOR 通路,mTOR 促进T 细胞代谢的关键转录调控因子HIF-1α,SREBP 等表达,进而驱动包括与糖酵解、磷酸戊糖途径、脂质或固醇合成等过程的代谢基因的表达来调节T 细胞代谢[17]。然而,mTOR信号通路是否在调控卵巢癌生长环境中CD4+Treg的糖代谢中发挥重要作用仍待研究。
本研究从卵巢癌患者外周血中mTOR+的CD4+Treg的百分比变化情况入手,结果表明,卵巢癌患者外周血中mTOR+的CD4+Treg比例升高,为进一步探究其作用,构建了SKOV3 与CD4+Treg 的共培养体系,结果与临床样本结果相符合,与SKOV3 共培养组mTOR+的CD4+Treg比例也升高,且上调的mTOR信号通路相关基因和蛋白的结果说明在卵巢癌生长环境中,CD4+Treg的mTOR信号通路发生明显活化。为了进一步探究mTOR 信号通路是否在CD4+Treg 糖代谢中发挥作用,本研究使用雷帕霉素抑制细胞的mTOR 信号激活。结果表明,雷帕霉素处理过的CD4+Treg的糖摄取和糖酵解水平显著下降,糖代谢相关基因和蛋白表达明显下调。
免疫代谢已经成为肿瘤免疫治疗研究的一个重要领域,本研究证实,mTOR信号通路可调控与卵巢癌细胞共培养的CD4+Treg糖代谢,在促进免疫抑制微环境从而导致卵巢癌免疫逃逸的过程中发挥至关重要的作用。因此,在肿瘤微环境中,针对这一通路进行Treg 细胞能量代谢的再编程可能是一种新的肿瘤治疗策略,有望为卵巢癌的免疫治疗提供新的靶点。有研究认为,mTOR 的活性被认为是维持其抑制能力的必要条件[18],目前的研究暂不足以说明mTOR 信号通路是否与卵巢癌微环境中CD4+Treg的抑制功能有关,而mTOR信号通路是否通过调控CD4+Treg 糖代谢进而影响其免疫抑制功能将是我们未来研究的重点。
