白斑狗鱼Wnt4基因的克隆及其表达分析
2023-05-18赵瑞阳张俊杰
李 菁,赵瑞阳,张俊杰
( 新疆农业大学 生命科学学院,新疆 乌鲁木齐 830052 )
无翅型MMTV整合位点家族信号通路是目前生物体中常见的信号通路之一,它是受到配体蛋白Wnt和膜蛋白两种蛋白相互作用产生的一种下游通路,经此途径,细胞外的信号传递到细胞内,从而参与到生物体的早期细胞发育及生殖器官的形成过程中[1]。在不同种类的动物中,Wnt信号通路进化十分保守。最初在小鼠乳腺肿瘤中被发现[2],命名为1nt1基因,在小鼠的胚胎生长发育过程中有支持作用,通过研究发现该基因的功能与果蝇的wingless基因类似,从此合并为Wnt基因[3]。Wnt蛋白属于分泌蛋白,通过不同的结构功能蛋白结合不同功能的受体,不同种类的受体分子各自诱导不同的细胞反应,从而达到调控下游靶向基因的目的[4]。Wnt蛋白与其下游效应蛋白共同形成一系列重要的信号通路。Wnt信号通路在细胞生长、细胞分化、细胞极性和凋亡等多种发育过程中发挥重要作用。Wnt4基因是Wnt基因家族的一员,是参与性腺早期生长分化的重要基因之一,在动物的生长发育、繁殖阶段及性别的维持方面具有重要支持作用。Wnt4蛋白是人类和小鼠性腺分化的关键调控因子[5],在早期胚胎发生中起关键作用,尤其在卵巢的发育和雌性功能的维持方面具有支持作用。在哺乳动物中,Wnt4蛋白对于将缪勒管发育成雌性输卵管和子宫也是必需的[6]。在小鼠的性别完全形成之前,Wnt4蛋白在小鼠卵巢中的表达较精巢更为持久、显著[7]。在人类的性别决定机制中Wnt4基因扮演着重要角色,其与Dax1基因共同调控参与雌性的性别决定机制,抑制雄性器官的形成[8]。有学者在黑鲷(Acanthopagrusschlegelii)的性别相关基因研究中发现,Wnt4对雌性生殖器官的发育形成有重要作用[9];Wnt4基因在栉江珧(Atrinapectinata)的卵巢中的表达量显著高于精巢[10];而栉孔扇贝的Wnt4基因在精巢中的表达量显著高于卵巢[11],与黑鲷的表达模式不同。对水生动物Wnt4基因的研究主要集中在克隆及表达分析方面,目前已涉及斑马鱼(Daniorerio)[12]、海胆[13]、栉江珧[10]、栉孔扇贝(Chlamysfarreri)[11]、三角帆蚌(Hyriopsiscumingii)[14]、厚壳贻贝(Mytiluscoruscus)[15]、虹鳟(Oncorhynchusmykiss)[16]、黑鲷[9]、青鳉(Oryziaslatipes)[17]等物种。
然而在硬骨鱼中Wnt4基因的相关研究较少。白斑狗鱼(Esoxlucius)是广泛分布于世界各大自然水域的冷水性鱼类[18],在我国主要分布于新疆额尔齐斯河流域[19],其生长迅速,适宜生长温度范围较广,肉质鲜美,已成为新疆地区重要养殖鱼类之一[20]。有研究表明,白斑狗鱼雌性生长明显快于雄性[21],开展单性养殖有助于扩大养殖的经济效益。目前白斑狗鱼的性别发育机制尚未阐明,Wnt4基因在其性腺发育过程中的作用未见报道,笔者通过反转录PCR方法克隆得到白斑狗鱼的Wnt4基因,通过实时荧光定量PCR方法对Wnt4基因在白斑狗鱼生长发育不同阶段的组织中的表达情况进行分析,从而探讨白斑狗鱼Wnt4基因在性别形成与分化中的功能,为白斑狗鱼性别决定机制提供基础资料。
1 材料与方法
1.1 材料
试验用鱼为本实验室人工繁殖的白斑狗鱼仔鱼,亲鱼为乌伦古湖野生白斑狗鱼,饲养于新疆农业大学水产实验室,分别取180日龄[体质量(300±30) g、体长(25±3) cm]及320日龄[体质量(600±30) g、体长(52±3) cm]雌性成鱼和雄性成鱼各3尾,对活鱼进行快速解剖,分别取性腺、肾脏、肌肉、鳃、脑、头肾、肠道组织装入无菌冻存管中,将其迅速置于液氮里,转移至-80 ℃超低温冰箱中。
1.2 方法
1.2.1 试剂
Trizol试剂购自Invitrogen公司,反转录试剂盒PrimeScriptTMRT reagent Kit with gDNA Eraser (Perfect Real Time)、PCR试剂盒TaKaRa TaqTM购自宝生物工程大连有限公司,荧光定量试剂盒购自天根生化科技(北京)有限公司。
1.2.2 引物设计
根据美国国家生物技术信息中心数据库中白斑狗鱼基因组测序信息,结合已报道鲑科鱼类Wnt4基因的蛋白质编码(CDS)区域设计引物Wnt4-F-Primer、Wnt4-R-Primer(表1),用于白斑狗鱼Wnt4基因扩增。根据克隆得到的基因片段设计实时荧光定量PCR引物Wnt4-F-QPCR、Wnt4-R-QPCR,引物的设计采用Primer 5.0软件,由生工生物工程(上海)股份有限公司合成。

表1 试验所涉及的特异引物Tab.1 Primer sequences used in the experiments
1.2.3 性腺总RNA的提取及cDNA的制备
采用Trizol法提取白斑狗鱼不同时期的不同组织总RNA,采用分光光度计检测RNA的光密度(显示1.8~2.0表示RNA完整性良好),1.0%的琼脂糖凝胶电泳检测RNA的完整性。按照TaKaRa反转录试剂盒说明书完成cDNA的制备,将其置于-20 ℃冰箱保存。
1.2.4 Wnt4基因的克隆
PCR反应以精巢cDNA为起始模板,反应体系为:2.5 mmol/L dNTP Mixture,4 μL;10×PCR buffer,5 μL;正、反向引物各2 μL;TaKaRa TaqTM(5 U/μL),0.5 μL;cDNA,3 μL;最后加入ddH2O补齐至50 μL。反应程序为:94 ℃ 5 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min,循环35次;72 ℃延伸10 min,4 ℃终止程序。PCR反应结束后,在1.5%的琼脂糖凝胶电泳中以D2000 DNA Marker作为分子质量标准进行检测,再置于紫外凝胶成像系统中观察电泳结果,将产物送生工生物工程(上海)股份有限公司测序。
1.2.5 Wnt4基因的生物信息学分析
采用DNAMAN软件将测序所得cDNA序列进行拼接,运用BLAST查询该物种在数据库中同其他物种Wnt4蛋白序列的同源性;使用生物信息学网络平台上的ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/orfig.cgi)工具分析白斑狗鱼Wnt4基因序列的开放阅读框,进一步推导出该蛋白的氨基酸序列;采用DNAMAN、Clustal X软件进行氨基酸序列多重对比;运用MEGA 6.1软件(邻接法的Boisson Model)对其构建系统发育树[22]。
1.2.6 Wnt4基因荧光定量表达
以反转录的各组织cDNA为模板,利用实时荧光定量PCR技术对Wnt4基因在白斑狗鱼各个组织的表达量进行测定,选定β-actin基因作为内参表达基因,Wnt4基因为目的基因。采用SYBR Green I荧光染料(天根)为原料,BIO-RAD CFX96定量PCR仪为试验仪器。反应体系10 μL为:2×SuperReal PreMix Plus(天根),7.8 μL RNase Free dH2O,上、下游引物各0.6 μL,模板cDNA 1 μL。反应程序为:95 ℃ 5min;95 ℃ 30 s,59 ℃ 30 s,39个循环;95 ℃ 30 s。采用 2-ΔCt法计算Wnt4基因的相对表达量。试验数据采用平均值±标准误表示,数据处理采用SPSS 21.0进行单因素方差分析,进行LSD多重比较及邓肯多重比较。
2 结 果
2.1 白斑狗鱼Wnt4基因扩增与克隆
将cDNA模板与特异性引物进行PCR扩增,反应产物采用琼脂凝胶电泳检测,分子长度约1500 bp,长度符合目的基因序列。对测序片段进行拼接,获得Wnt4的cDNA序列,长度为1505 bp。运用美国国家生物技术信息中心上的ORF Finder对白斑狗鱼Wnt4基因的开放阅读框进行查询,得出1条序列长度为1059 bp的开放阅读框,编码352个氨基酸(图1)
图1 白斑狗鱼Wnt4基因 PCR扩增结果Fig.1 The PCR amplification result of Wnt4 gene in northern pike E. lucius1~4表示白斑狗鱼扩增结果;M表示DNA marker.The number from 1 to 4 represents the amplification result of northern pike E. lucius; M stands for DNA marker.

图2 白斑狗鱼Wnt4蛋白质氨基酸序列推导图Fig.2 Amino acid sequence of Wnt4 protein in northern pike E. lucius代表正向引物;代表反向引物.represents the forward primer; represents the reverse primer.
2.2 同源性分析
运用Clustal X软件对白斑狗鱼等13个物种进行同源性分析,结果显示,白斑狗鱼Wnt4蛋白与硬骨鱼类的同源性更高,与虹鳟同源性为96.59%,与青鳉同源性为93.48%,与胡子鲇(Clariasbatrachus)、大西洋鳕(Gadusmorhua)、斑马鱼的同源性均为92.61%,与原鸡(Gallusgallus)、非洲爪蟾(Xenopuslaevis)、人类(Homosapiens)同源性分别为84.38%、86.08%、80.40%,与黑天鹅(Cygnusatratus)、大鼠耳蝠(Myotismyotis)、印度水牛(Bubalusbubalis)、褐家鼠(Rattusnorvegicus)同源性分别为84.38%、80.68%、80.68%、79.83%。从Wnt4蛋白氨基酸同源性分析上可以得出,白斑狗鱼与虹鳟、青鳉等鱼类同源性均在90%以上,与哺乳动物和两栖动物的Wnt4蛋白氨基酸同源性则较低。

图3 白斑狗鱼与其他物种Wnt4蛋白氨基酸序列比对分析Fig.3 Multiple sequence alignment analysis of amino acid sequences of Wnt4 protein in northern pike E. lucius and othersWnt4蛋白保守结构域由表示.The conserved domain of Wnt4 protein is represented by the black box.
2.3 系统进化树
运用MEGA 6.1软件对白斑狗鱼及其余13个处于不同分类地位的物种进行系统进化树的构建(图4)。结果显示,Wnt4蛋白氨基酸构建的系统发育进化树首先分为3大类,分别为脊索动物门、棘皮动物门和软体动物门。白斑狗鱼与白边锯鳞鱼(Myripristismurdjan)、红鳍东方鲀(Takifugurubripes)、尼罗罗非鱼(Oreochromisniloticus)、金头鲷(Sparusaurata)聚为一亚支,非洲爪蟾与原鸡聚为一支,并与白斑狗鱼所在的硬骨鱼纲聚在一起,这一分支再与哺乳动物(人类、小家鼠、绵羊)聚成一亚支,最后与软壳动物和棘皮动物共同会聚为系统发育树。Wnt4氨基酸序列系统发育树表明,白斑狗鱼与白边锯鳞鱼亲缘关系最近,与青灰拟球海胆(Paracentrotuslividus)和栉孔扇贝、厚壳贻贝的亲缘关系最远。这与氨基酸同源性分析结果一致,系统进化关系符合传统的物种进化理论。
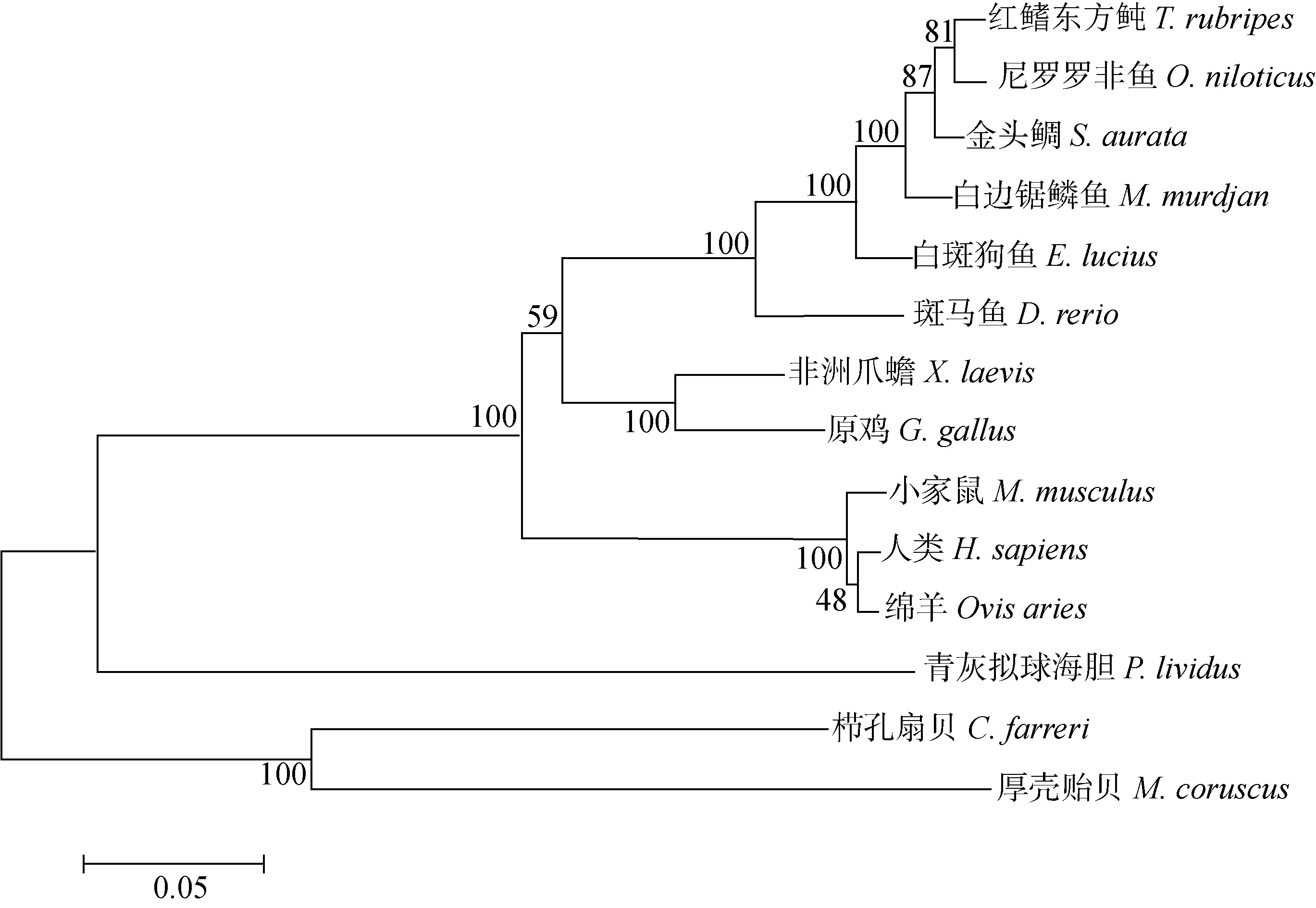
图4 基于不同物种的Wnt4氨基酸序列构建的邻接系统发育树Fig.4 NJ phylogenetic tree constructed based on Wnt4 amino acid sequence of different species
2.4 Wnt4基因在不同组织的表达情况
实时荧光定量PCR结果显示,Wnt4基因在白斑狗鱼卵巢、精巢、肠道、头肾、肾脏、肌肉、鳃、脑这8个组织中均有不同程度的表达,显示出Wnt4基因在各个组织中表达的广泛性。各个组织之间表达存在差异,180日龄期(图5a),Wnt4基因在卵巢、肌肉、头肾、脑组织中的表达量相对较高,而在肠道、肝脏、肾脏的表达量相对较低,卵巢的表达量显著高于精巢(P<0.05)。320日龄期(图5b),Wnt4基因在肠道、肾脏、肝脏开始出现较明显的表达,并且卵巢的表达量极显著高于精巢(P<0.01)。对比不同时期的精巢表达量可以发现,随着性腺的生长发育,320日龄期卵巢的表达量明显低于180日龄期,Wnt4基因的表达量在性腺(精巢和卵巢)中呈现下降趋势。

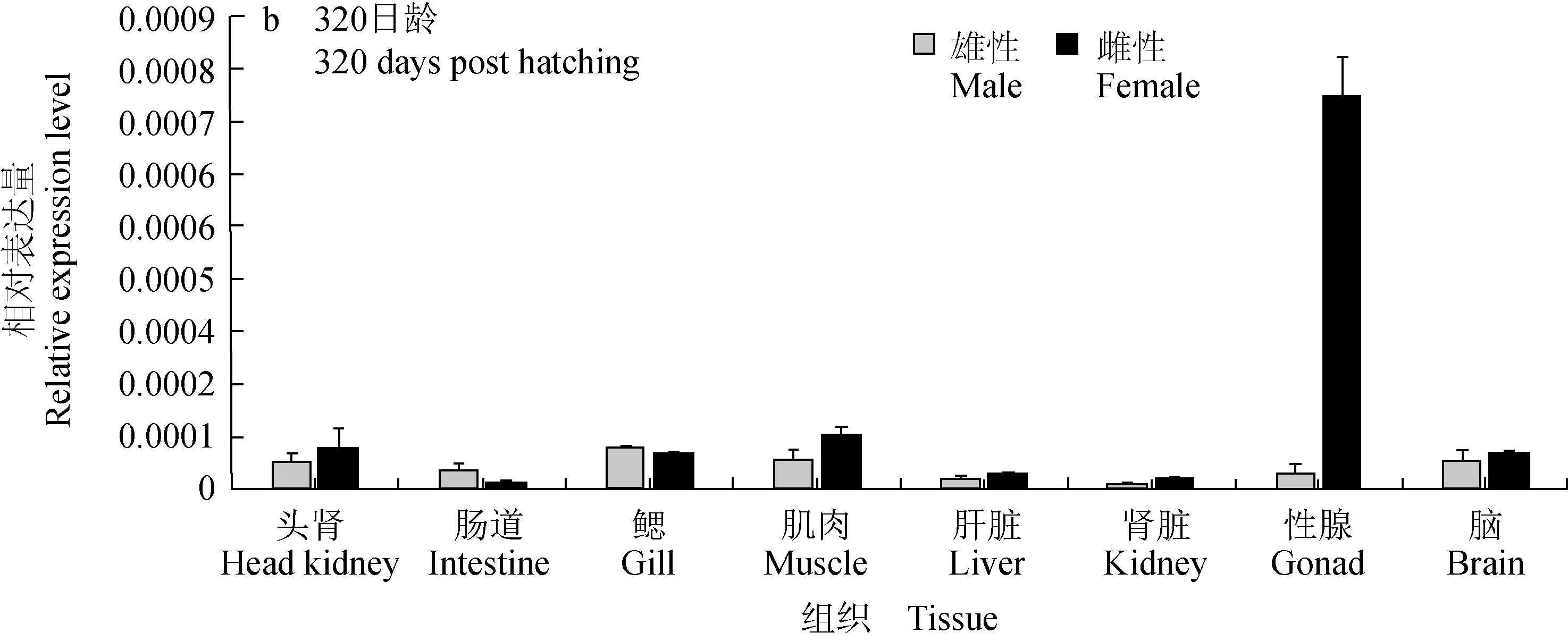
图5 实时荧光定量PCR检测Wnt4基因在不同日龄期白斑狗鱼不同组织的相对表达量Fig.5 Relative expression levels of Wnt4 gene in different tissues of northern pike E. lucius at different ages detected by real-time PCR**为差异极显著(P<0.01).** indicates very significant difference at P<0.01 level.
3 讨 论
3.1 Wnt4蛋白结构预测及其同源性进化关系分析
Wnt4蛋白可能是一种影响组织离散区域发展的信号分子。Wnt基因存在于脊椎动物和无脊椎动物中,目前已知人类的Wnt蛋白有19种。Wnt基因过表达可能与人乳腺组织的异常增殖有关[23]。由Wnt蛋白介导的Wnt信号通路,其主要功能是协调和影响大量的细胞过程,如细胞增殖、分化、肿瘤发生、凋亡和参与微生物感染期间的免疫防御[24]。笔者克隆得到的白斑狗鱼Wnt4基因序列具有Wnt基因家族的特征,编码352个氨基酸,含有2个以上的N糖基化位点,对比不同的Wnt4蛋白发现其保守序列超过100个。符合大多数推导的蛋白质,长度约为350~380个氨基酸,包含超过100个保守残基,且相当均匀地分布在整个序列中[3]。
氨基酸同源性分析发现,白斑狗鱼Wnt4蛋白与虹鳟、青鳉、胡子鲇等硬骨鱼类的相似性均在92%以上,从进化发育树的遗传距离程度上看,白斑狗鱼与白边锯鳞鱼亲缘关系最近,与软壳动物亲缘关系较远,说明笔者克隆的Wnt4基因属于Wnt基因家族成员,且从系统进化关系看Wnt4基因进化亦符合传统的物种进化理论。
3.2 Wnt4表达模式分析
Wnt4基因作为生长因子参与调控动物体生长发育的不同过程,与机体肾脏、肾上腺、乳腺及垂体及生殖器官的形成有关,特别是与动物的性别发育密切相关。在哺乳动物胚胎的形成过程中,发育初期时Wnt4基因在睾丸和卵巢都有表达,随着胚胎发育到一定时期,Wnt4基因在睾丸的表达发生下调,从而出现基因表达的二态性[25]。有研究表明,小鼠Wnt4基因的缺失会导致雌性向雄性的逆转,从而进一步提示了Wnt4基因在雌性性腺发育过程中起到的分子调控机制[6,26]。Wnt4基因在长牡蛎(Crassostreagigas)[27]雌、雄性腺中的表达呈现明显的二态性,卵巢的表达量显著高于精巢。并且在不同的日龄期中白斑狗鱼的卵巢表达量都显著高于精巢,这与Wnt4基因在牙鲆(Paralichthysolivaceus)性腺中的表达情况一致[28]。在虹鳟中存在2种Wnt4基因,Wnt4a1、Wnt4a2基因在生殖细胞周围的体细胞中都被检测到,且存在轻微的偏向雄性表达的性别二态性,在虹鳟性腺发育的早期并未出现卵巢表达优势[16]。
本研究中,白斑狗鱼的Wnt4基因在卵巢、精巢、肠道、头肾、脑等不同组织均有表达,这与栉孔扇贝[11]、长牡蛎[27]、厚壳贻贝[15]的Wnt4基因广泛组织表达模式类似。白斑狗鱼Wnt4基因在320日龄期的表达较180日龄期有降低的趋势,推测Wnt4蛋白在其性腺发育的早期参与到某些器官的形成及功能的维持。在哺乳物及软体动物中存在相似的结果,Wnt4蛋白参与哺乳动物早期胚胎发育,参与排泄、生殖器官的发育[25]。Wnt4基因在整个脊椎动物中都是高度保守的,最初是在非哺乳类脊椎动物中被研究的。在哺乳动物小鼠和袋鼠中,Wnt4基因在卵巢中的表达显著高于精巢,在精巢几乎不表达[29,30]。Wnt4基因与神经的发育有关,也参与其他功能的维持,如:在斑马鱼[11]、鸡[31]和非洲爪蟾[32]中,Wnt4基因在大脑中表达,提示其在胚胎发生过程中起抑制细胞运动的作用;在某些哺乳动物肾脏的形成过程中,缺失Wnt4基因的小鼠,会出现肾衰竭导致死亡[33];有研究表明在肾小管形成过程中,Wnt4蛋白在间质细胞向上皮细胞转化的过程中扮演重要角色,Wnt4蛋白作为分泌型糖蛋白,是肾小管形成所必需的组分[34]。
Wnt4基因在白斑狗鱼的不同部位呈现出广泛的表达特点,其中卵巢的表达量最高,并且卵巢的表达量显著高于精巢,随着性腺发育到后期,Wnt4基因在卵巢的表达量呈下降趋势。推测该基因在白斑狗鱼发育的早期参与多个部位的生长发育,并且在卵巢发育前期对卵巢具有支持作用。白斑狗鱼雌、雄生长速度差异明显,研究白斑狗鱼性别相关发育基因有助于对今后实现单性养殖提供理论支持。
4 结 论
笔者克隆获得了白斑狗鱼Wnt4基因,通过分析其编码的氨基酸序列发现,该蛋白与虹鳟、青鳉同源性较高,与非洲爪蟾和褐家鼠等相似性较低。Wnt4基因在白斑狗鱼不同组织中的表达结果显示,Wnt4基因在性腺中的表达具有明显的二态性,该基因在卵巢中的表达显著高于精巢,并在以性腺为首的8个不同组织中均有不同程度的表达。这说明在白斑狗鱼早期发育过程中Wnt4基因对包含卵巢在内的多个组织的生长发育均有支持作用。
