胡麻DNA 指纹图谱的构建与遗传多样性分析
2023-05-18许嘉诚张梦阳陈翠萍闫殿海
许嘉诚,张梦阳,陈翠萍,闫殿海,刘 洋*
(1 青海大学农牧学院,西宁 810016;2 农业农村部植物新品种测试(西宁)分中心,西宁 810016;3 青海省农林科学院,西宁 810016)
胡麻(Linum usitatissimumL.)又称油用亚麻,为亚麻科亚麻属一年生草本经济作物,是我国北方地区重要的油料作物。 胡麻籽粒富含多种生物活性物质,具有重要的食用价值和营养价值,广泛应用在天然健康产品中[1]。 据统计,2000—2017 年胡麻的单产水平稳步提升,近十年的胡麻消费量也保持年均11.8%的增长率,市场需求旺盛[2]。 对胡麻的分子研究国内外均有报道,如Bickel 等[3]最早利用AFLP 和RAPD 进行胡麻遗传图谱的构建;李丹丹等[4]采用AFLP 分子标记的方法,利用聚类分析将80 个胡麻品种(系)分为4 个种群,并分析了胡麻农艺性状、胡麻种群划分、胡麻地理来源之间的相关性;李闻娟等[5]利用筛选的SRAP 引物对胡麻品种‘陇杂1 号’和‘陇杂2 号’进行纯度鉴定;郝荣楷等[6]利用形态学标记以及SRAP 分子标记对96 个胡麻品种进行了指纹图谱的构建与遗传多样性分析,并分析了核心种质资源的表型变异[7-8]。 运用SSR 分子标记的胡麻研究始于对引物的筛选[9-11],之后潘根等[12]应用SSR 分子标记分析了24 个胡麻品种,构建了相关的指纹图谱并进行了遗传分析,未来将有更多胡麻品种、更多引物位点的相关研究[13]。 目前,国内已建立了初级核心种质资源库,但利用分子标记辅助选择技术改良胡麻的研究较少[14]。 因此,构建胡麻DNA 指纹图谱库,对其新品种鉴定及种质资源保护具有重要的现实意义和广阔的研究前景。 本研究采用SSR 标记技术,利用筛选出的20 对多态性好的引物,对61 份胡麻材料构建胡麻DNA 指纹图谱,以期建立一套稳定、快速、可靠的胡麻品种鉴定体系,为胡麻的品种鉴定和选育提供参考。
1 材料与方法
1.1 试验材料与试剂
1.1.1 试验材料
在青海省农林科学院作物育种栽培研究所收集的200 多份胡麻种质资源中,选取61 份材料作为本研究的试验材料(表1)。

表1 试验所用61 份胡麻材料Table 1 Sixty-one flax materials used in the experiment
1.1.2 试验试剂
试验试剂10 ×PCR buffer、TaqDNA 聚合酶、dNTPs 等均购于宝生物工程(大连)有限公司;试验所用引物由上海捷瑞生物工程有限公司合成。
1.2 试验方法
1.2.1 DNA 的提取
参照李荣华等[15]的方法提取胡麻DNA。 提取的DNA 样品经超微量紫外分光光度计检测,判断浓度以及纯度是否符合试验标准,并于-20 ℃冰箱冷冻保存。
1.2.2 PCR 扩增
PCR 反应体系为:总体积10 μL,DNA 75 ng,引物1.2 μmol∕L,10 × PCR buffer 1.2 μmol∕L,dNTPs 0.8 μmol∕L,TaqDNA 聚合酶0.2 μmol∕L,用ddH2O 补足。
扩增程序为:94 ℃预变性2 min;94 ℃变性30 s,59 ℃退火30 s,72 ℃延伸45 s,循环9 次;94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸1 min,循环29 次;72 ℃延伸10 min,4 ℃保存。
1.2.3 聚丙烯酰胺凝胶电泳
加入10 μL Loading Buffer 进行聚丙烯酰胺凝胶电泳,电泳后,经银染与显影得到清晰条带,进行读带分析。
1.3 数据分析
通过读带分析记录同一引物下的等位基因位点数。 在61 个DNA 样本中同一等位基因位点上有明显条带的记作“1”,无明显条带则记作“0”,缺失样本记作“.”,以此做出“0-1”矩阵型读带表。 利用Popgen 32 软件分析读带表计算出多态性指数等,采用NTSYSpc 2.1 软件进行非加权组平均法(UPGMA)聚类分析。
2 结果与分析
2.1 多态性引物的筛选与多态性分析
参考Cloutier 等[16]的分析数据并结合先前研究合成193 对引物。 挑选6 份不同来源的胡麻材料对引物进行初筛,根据初筛结果(图1)挑选条带清晰、多态性好的引物;用所有的供试材料进行复筛,最终筛选出构建胡麻指纹图谱的20 对核心引物(表2)。

图1 多态性引物的筛选Fig.1 Screening of polymorphic primers

表2 20 对多态性SSR 引物序列信息Table 2 Sequence information of 20 pairs of polymorphic SSR primers
由表3 可知,筛选出的20 对多态性好的引物共扩增出88 个等位基因位点,每个引物的等位基因数在2—12 个,有效等位基因数在1.431—6.547 个,其中引物Lu2796 的等位位点数最多(12 个),引物Lu3218、Lu2966、Lu2382 的等位位点数最少(2 个),其余引物的等位位点数为3—8 个。 多态信息含量(PIC)值在0.120—0.870,平均值为0.508,以引物Lu2796 最高,引物Lu3218 最低。 多样性指数在0.822—2.015,平均值为1.458,最高为引物Lu2796,最低为引物Lu3218。 引物Lu2796 在有效等位基因数、等位位点数、多态信息含量和多样性指数上均为最高。 不同引物扩增条带片段大小在200—450 bp。
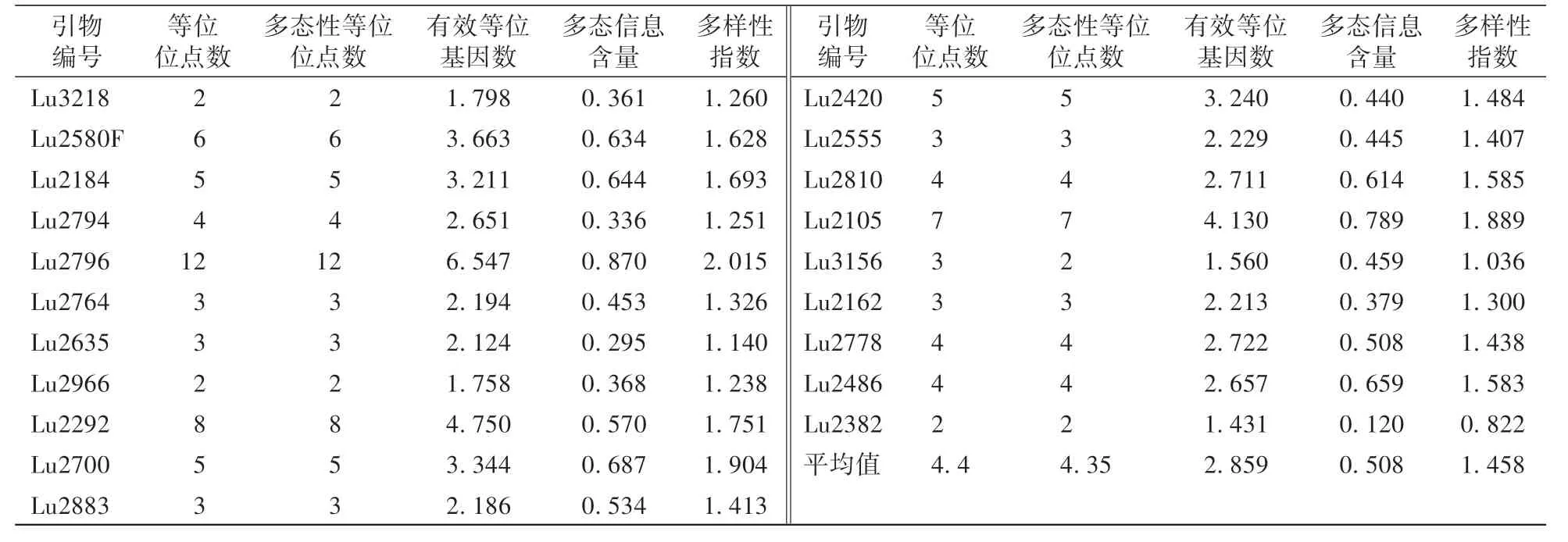
表3 SSR 引物多样性分析指标Table 3 SSR primer diversity analysis indicators
2.2 遗传多样性分析
非加权组平均法(UPGMA)聚类分析(图2)表明:61 份胡麻材料的遗传相似系数在0.250—0.780;在遗传相似系数为0.771 5 处可将61 份胡麻材料分为3 类:第一类包括‘内亚5 号’、DEHISCINTK CREDITAN、莎车早熟种红、雁杂10 号选系-1、‘陇亚六号’等38 个材料;第二类包括‘坝选三号’、‘坝亚九号’、‘坝亚11 号’、KENYAC 1709、Crista Fiber、PALA Blue 等15 个材料;第三类包括10446146、俄罗斯高杆亚麻、‘坝亚七号’、‘坝亚12 号’、庆阳老胡麻、两当胡麻、‘雁杂10 号’、‘坝亚一号’。 甘肃陇亚系列的‘陇亚1 号’、‘陇亚2 号’、陇亚六号’、‘陇亚10 号’、‘陇亚11 号’、‘陇亚13 号’油用亚麻材料聚类在一起,河北坝亚系列的‘坝亚三号’、‘坝亚九号’、‘坝亚11 号’、‘坝亚13 号’油用亚麻材料聚类在一起,由此也验证了分子标记的准确性。

图2 61 份胡麻材料聚类分析Fig.2 Cluster analysis of 61 flax materials
2.3 指纹图谱构建
由表4 可见,具有特征引物的材料共有19 个,其中‘陇亚10 号’、‘陇亚2 号’、晋亚5 号选系-2 有最多的特征引物(3 对),此类材料具有较高的特异性,易于鉴别。 莎车亚麻选系-1、‘宁亚6 号’、天水白和两当胡麻有2 对特征引物。 莎车早熟种红、平罗红、‘陇亚11 号’、‘陇亚13 号’、‘晋亚5 号’、‘匈牙利3号’、10446146、‘坝选三号’、CDC Bethune、阿里安、PALA Blue 和KENYAC 1709 各有1 对特征引物。 筛选出的20 对引物对样品DNA 都具有良好的多态性,能将某一材料从其余60 份材料中筛选出来的特征引物共有13 对(Lu2580F、Lu2184、Lu2794、Lu2796、Lu2764、Lu2292、Lu2700、Lu2420、Lu2810、Lu2105、Lu2162、Lu2778、Lu2486),其中引物Lu2292 可一次区分6 份材料(‘陇亚10 号’、‘陇亚2 号’、晋亚5 号选系-2、‘宁亚6 号’、阿里安、KENYAC 1709)。 能将2—3 份材料从其他材料中筛出合并为一类的共有17 对引物,如Lu2796 可以将Crista Fibe 和PALA Blue 从其他材料中筛出组成一类,Lu2580F 可将‘晋亚5 号’与OTT7703*ARGCB*AR*C19 从其他材料中筛出组成一类。 利用2 对或2 对以上的引物构建指纹图谱可提高鉴别的准确性,组合运用这类引物可改进鉴定过程,提高鉴定效率。
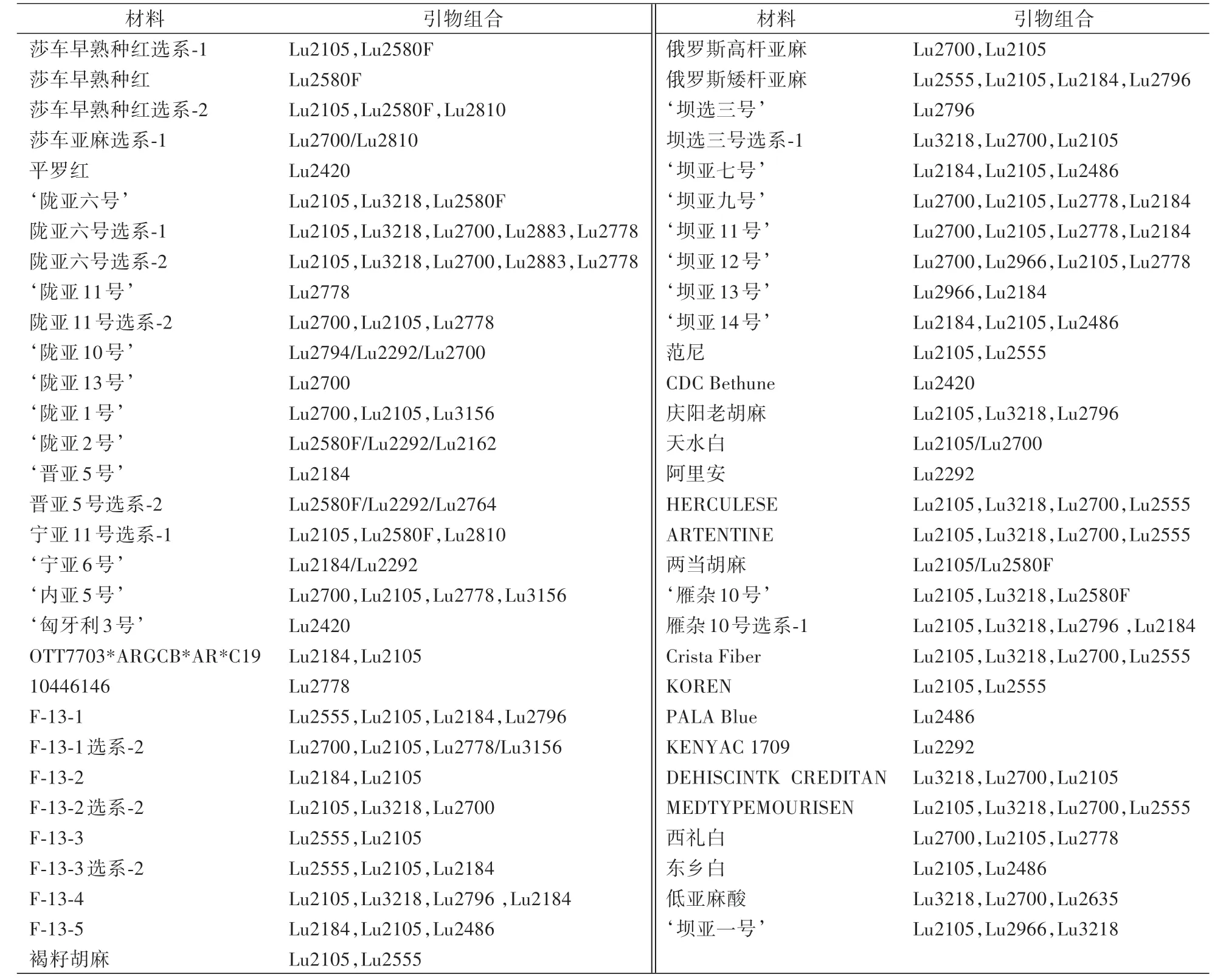
表4 61 份胡麻材料鉴别的引物组合Table 4 Primer combinations for identification of 61 flax materials
综上,组合利用上述20 对多态性引物可将61 份胡麻材料DNA 完全鉴别。 第一步:利用Lu2105 将61 份胡麻材料DNA 分为十大类。 其中有两大类各只有1 份材料(天水白、两当胡麻),第三大类为‘陇亚2 号’、晋亚5 号选系-2,第四大类为褐籽胡麻、范尼、CDC Bethune、KOREN,第五大类为‘坝选三号’、坝选三号选系-1、DEHISCINTK CREDITAN、低亚麻酸,第六大类为莎车早熟种红选系-1、莎车早熟种红选系-2、宁亚11 号选系-1,第七大类为莎车亚麻选系-1、平罗红、F-13-1、F-13-3、F-13-3 选系-2、俄罗斯矮杆亚麻、东乡白,第八大类包括庆阳老胡麻、F-13-4、雁杂10 号选系-1 等8 份材料,第九大类包括‘坝亚七号’、‘坝亚14 号’、F-13-5 等13 份材料,第十大类包括西礼白、‘陇亚1 号、‘坝亚11 号’等18 份材料。 第二步:利用Lu2700 在这几大类中筛选,将‘陇亚10 号’、‘陇亚13 号’、俄罗斯高杆亚麻、‘陇亚11 号’、陇亚11 号选系-2、‘陇亚1 号’、‘内亚5 号’等13 份材料从其他材料中分出。 第三步:组合其他引物将剩余材料筛选出来,如组合Lu2184 与Lu2486 将第九大类中的8 份材料全部鉴别出来。 对这20 对多态性引物在61 份材料中的扩增结果,以十进制数字0—9 进行编码,构建61 份胡麻材料的DNA 指纹图谱(表5),并根据《农作物种子标签二维码编码规则》[17]中的二维码设计标准进行QR 码的绘制(图3)。
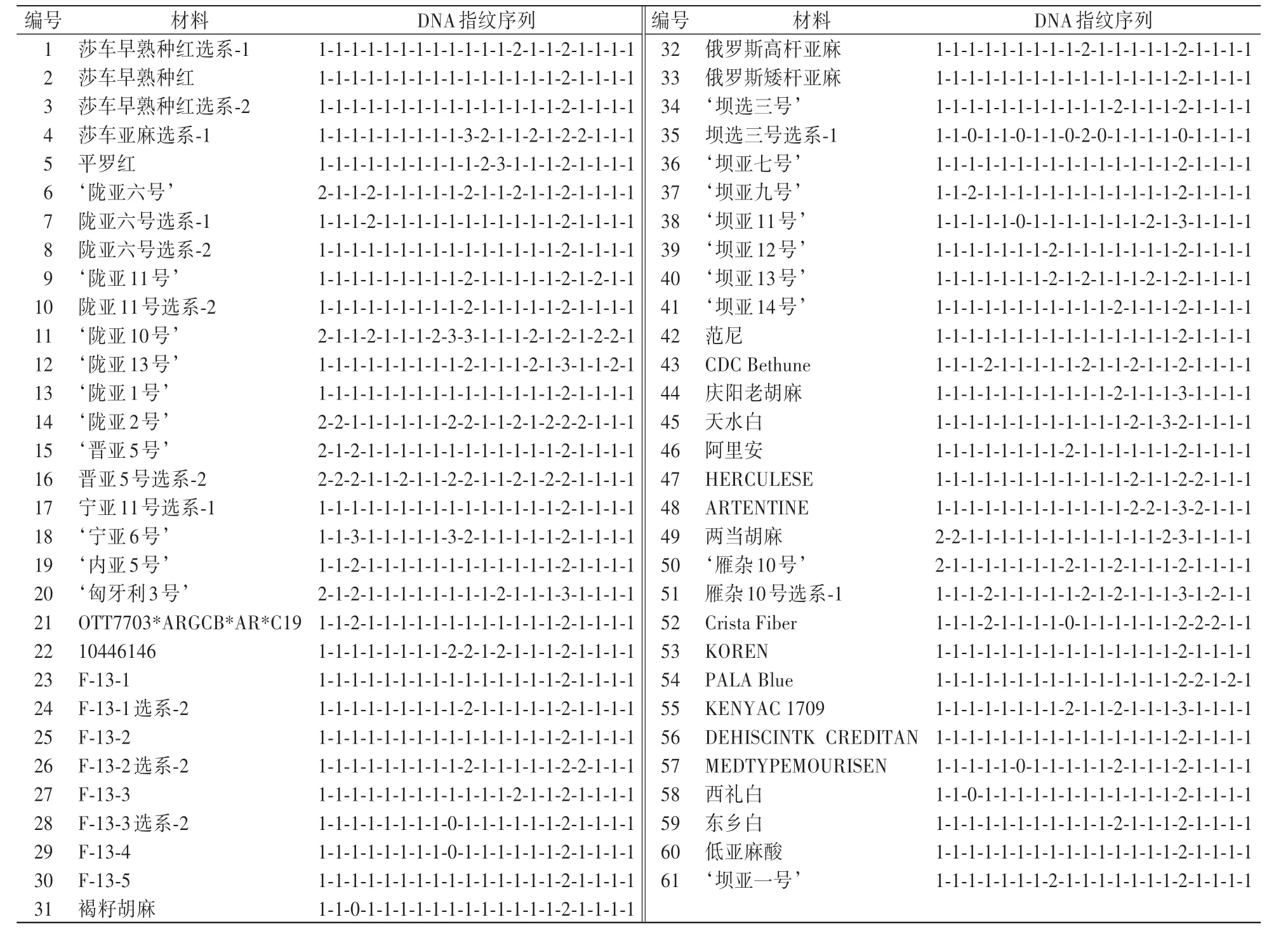
表5 61 份胡麻材料的DNA 指纹序列Table 5 DNA fingerprint sequences of 61 flax materials

图3 部分胡麻材料的唯一QR 标识码Fig.3 Unique QR identification code of some flax materials
3 讨论与结论
自Gorman 等[18]在1996 年首次利用分子标记技术研究胡麻以来,应用于胡麻的分子标记研究不断增加。 目前常用的分子标记包括AFLP、RAPD、SSR 以及SNP。 Bickel 等[3]和李丹丹[4]对胡麻遗传连锁图谱构建的研究采用的是AFLP、RAPD 和SRAP 标记方法,但存在标记数量少、对试验样品的DNA 质量要求较高、试验步骤复杂且稳定性较差的问题,在如今的研究中,这三类标记方法逐渐被取代[19];作为第三代分子标记的SNP 分子标记拥有稳定性高、位点丰富、检测快速、易于实现自动化分析等优点,其高效的测序技术与易于实现的自动化分析对未来的遗传图谱构建速度有着极大的提升作用[20-21],但不断增加的分子标记数量的成本问题及计算效率与技术限制的矛盾亟待解决,所以SNP 测序技术更适合于开发大量的、准确的分子标记。 而SSR 标记技术具有高多态性、共显性以及在基因组中丰度较高且操作简便省时、成本低等诸多优点,已用其建立了水稻、小麦、玉米等作物的分子遗传图谱[22-24],因此从降低成本、操作简便等因素考虑,本试验采用SSR 分子标记的方法。
本研究利用20 对SSR 引物将61 份胡麻材料进行遗传多样性分析,并构建出61 份材料的指纹图谱,绘制了胡麻材料的QR 标识码。 结果表明:相同选系材料,如莎车早熟种红、莎车早熟种红选系-1、莎车早熟种红选系-2 分为一类,‘陇亚六号’、陇亚六号选系-1、陇亚六号选系-2 分为一类,但也出现了‘雁杂10号’与雁杂10 号选系-1 并未在同一类的情况,可能是自然突变或机械混杂导致的;甘肃陇亚品系分为一类,河北坝亚品系分为一类,表现出明显的地域特征。 该结论与黄文功等[25]对7 个国家48 个亚麻品种ISSR 分析的结论相符,地理相近的品种在聚类分析中基本归为一类。 因此,可通过聚类分析结果进行胡麻育种中亲本的选配,并根据育种目标选育多态性更好的品种来丰富胡麻基因资源的多样性。 本试验筛选的20 对引物等位基因位点共有88 个,其中多态性等位基因位点有87 个,多态性比率为98.86%,高于潘根等[12](多态性比率25%)和黄文功等[25](多态性比率91.1%)的研究结果,说明本试验筛选的20 对引物具有很高的多态性,可以广泛应用于胡麻的SSR 分析中。
