镁铝层状双金属氢氧化物对水体中钒吸附的性能
2023-05-18麻梦梦梁梦梦马中建
麻梦梦,周 丹,*,秦 天,梁梦梦,马中建
(1.成都理工大学生态环境学院,四川成都 610059;2.攀钢集团矿业有限公司,四川攀枝花 617000)
工业排放的“三废”中会有大量的钒进入水体环境,钒对环境的污染越来越严重[1]。四川省攀枝花钒钛磁铁矿区钒资源储量约占全国的62%,含钒矿物的开采、钒制品的生产与加工等阶段产生了大量有毒有害含钒废水,严重威胁流域水环境安全[2]。
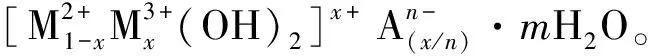
目前关于Mg-Al LDHs对阴离子形态金属钒的吸附研究较少,还未探讨其作为吸附剂治理钒污染水体的可能性。因此,本试验选用共沉淀法合成Mg-Al LDHs,通过X射线衍射(XRD)、扫描电子显微镜(SEM)和傅里叶红外光谱(FTIR)3种表征手段对材料进行表征分析,结合等温吸附试验、吸附动力学试验及吸附模型分析Mg-Al LDHs对钒的吸附特性,验证了Mg-Al LDHs作为吸附剂处理含钒废水的有效性,为治理水体中阴离子钒提供新的技术方法,保障污水治理效果稳定化。
1 材料与方法
1.1 材料制备
LDHs合成方法主要有共沉淀法、离子交换法、诱导水解法、焙烧还原法、溶胶-凝胶法、重构法、成核/晶核隔离法、尿素水解法、表面合成法等,其中共沉淀法和水热合成法应用最为广泛[7]。Mg-Al LDHs采用操作简便的共沉淀法制备。将MgCl2和AlCl3·6H2O按摩尔比为3∶1称取,溶于蒸馏水中,搅拌均匀,配制成一定物质的量比的金属离子溶液。采用1 mol/L NaOH溶液作为沉淀剂,在30 ℃的环境下,按照1(金属离子溶液)∶7(NaOH溶液)滴速比例缓慢搅拌混合,生成沉淀。将混合溶液放入65 ℃恒温箱中老化18 h后,抽滤,用蒸馏水洗涤。滤饼放入烧杯中并用保鲜膜封口,在80 ℃恒温箱中加热18 h,将得到的固体研磨成粉末,即为Mg-Al LDHs。以上药品皆为分析纯。
1.2 样品表征
本试验在Bruker D8 advance-广角XRD上完成样品的物相分析,扫描角度为5°~85°,若XRD的基线较为平稳,出现较窄且强度高的衍射峰峰形,说明晶体有较高的结晶度;采用SEM(Prisma E, Thermofisher)对样品的形貌进行观察,可分析晶体的粒径、形态和均一程度等微观细节;采用红外吸收光谱仪(Nicolet iS10,Thermofisher)对样品进行FTIR分析,可以得到LDHs的层间阴离子及其成键类型等信息。
1.3 吸附试验
(1)等温吸附试验
称取一定量的偏钒酸钠(NaVO3),配制质量浓度为10、20、40、60、80、100、150、200、300、400、600、800、1 000、1 200 mg/L的钒溶液作为储备液。准确称取10 mg的Mg-Al LDHs样品于50 mL的离心管中,分别加入上述配制的钒溶液20 mL。将离心管置于恒温振荡器中振荡,转速为200 r/min,温度设定为25 ℃,连续振荡12 h后过滤,设置3组平行试验。将上清液稀释加酸后,通过型号为Nexion 1000的电感耦合等离子体质谱仪(ICP-MS)测定平衡溶液中钒的浓度。平衡吸附量计算如式(1)。
(1)
其中:qe——平衡吸附量,mg/g;
c0——吸附前溶液中钒的质量浓度,mg/L;
ce——吸附平衡时溶液中钒的质量浓度,mg/L;
V——溶液体积,mL;
w0——溶液中吸附剂的用量,mg。
(2)吸附动力学试验
称取10 mg的Mg-Al LDHs样品于50 mL的离心管中,加入20 mL质量浓度为400 mg/L的钒溶液,设置10、20、30、60、120、180、240、360、480、600、720、1 440、2 880 min共13个时间梯度。将离心管置于恒温振荡器中振荡,转速为200 r/min,温度设定为25 ℃,连续振荡至设置的时间节点后取出过滤,设置3组平行试验。将上清液稀释加酸后,用ICP-MS测定平衡溶液中钒的浓度。
2 结果与分析
2.1 Mg-Al LDHs的表征分析
(1)物相分析
Mg-Al LDHs的XRD谱图如图1所示,在2θ处出现了(003)、(006)两个尖锐且对称性较好的衍射峰,(009)衍射峰清晰可见。2θ值较低处有尖且强的低晶面指数衍射峰,较高处有宽且弱的衍射峰,符合水滑石特征衍射峰。此外,谱图基线较为平稳,表明Mg-Al LDHs结晶度较高,为具有LDHs结构特征的水滑石[8]。
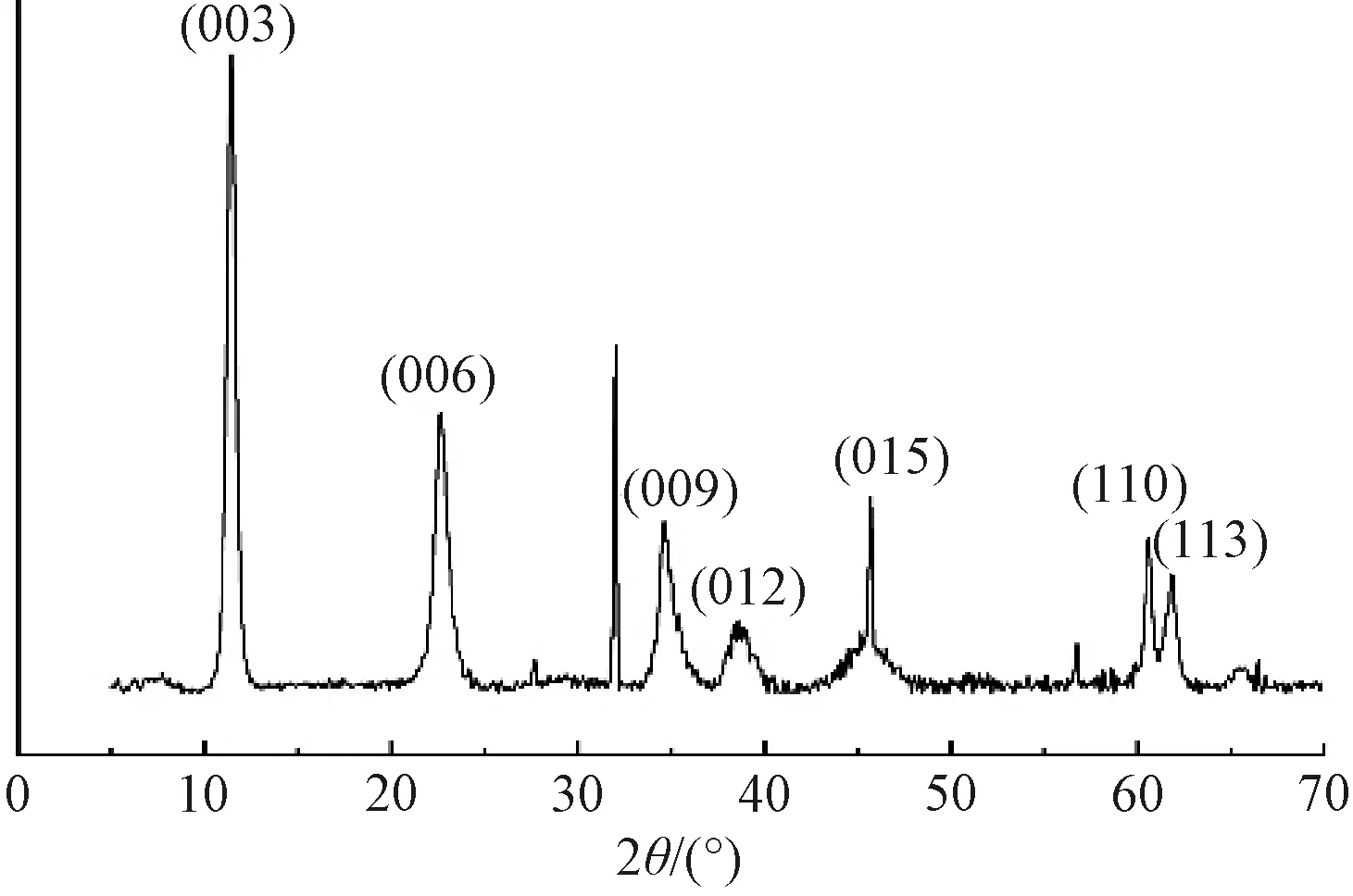
图1 Mg-Al LDHs的XRD图Fig.1 XRD Image of Mg-Al LDHs
(2)形貌分析
图2为Mg-Al LDHs的SEM图像。由图2(a)可知,Mg-Al LDHs表面比较粗糙,边缘不规则,颗粒粒径变化幅度较大;图2(b)显示Mg-Al LDHs表面有大量不规则的沟壑和孔隙结构。

图2 Mg-Al LDHs的SEM图Fig.2 SEM Image of Mg-Al LDHs
(3)FTIR分析
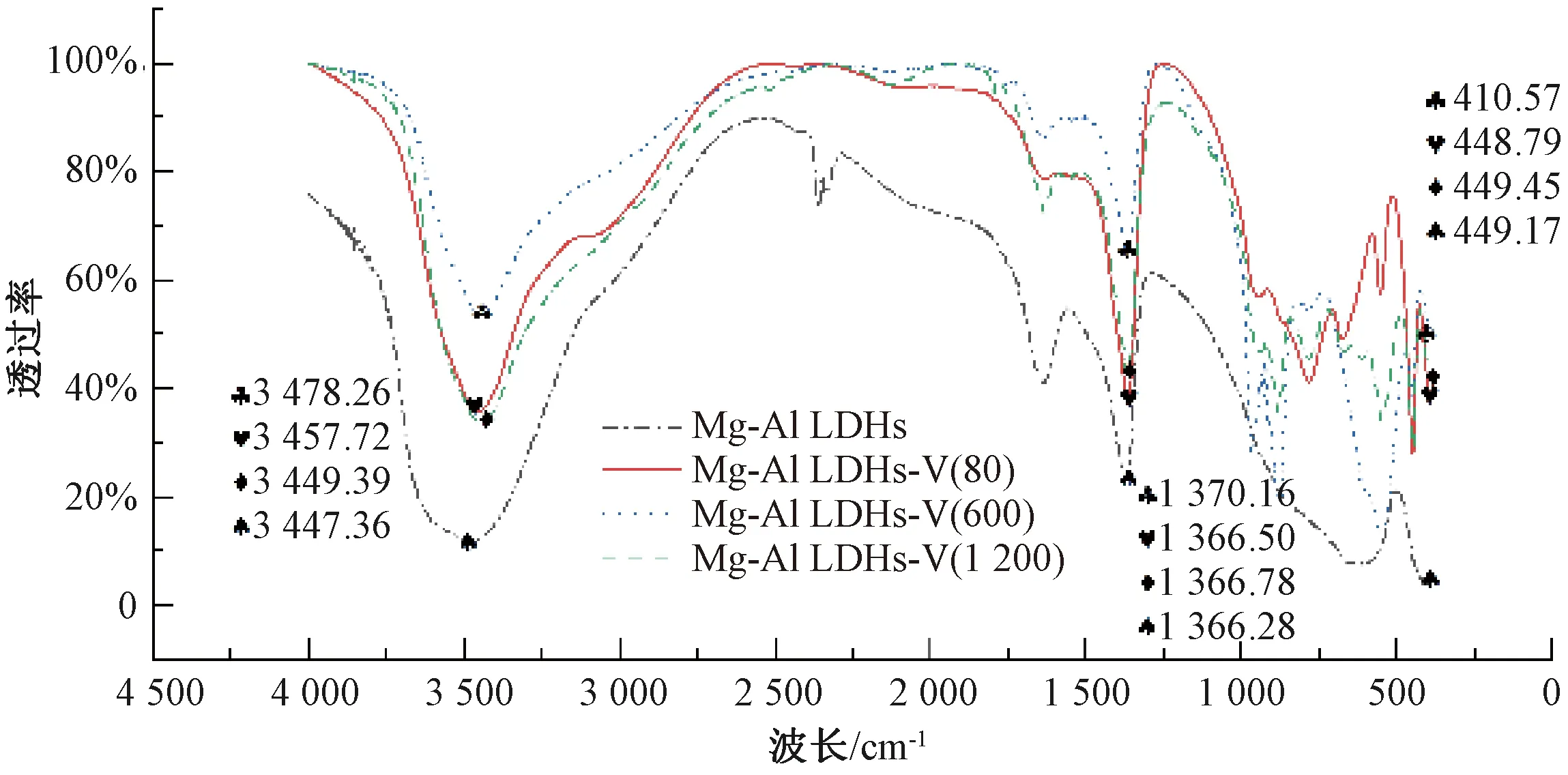
由图3可知,Mg-Al LDHs在3 478.26 cm-1处出现由层板上的羟基和层间水的伸缩振动产生的宽而强的特征吸收峰,表明混合铝镁离子溶液生成的不是独立的氢氧化物沉淀。在1 633.42 cm-1的吸收峰为结晶水的弯曲振动峰,在410.57 cm-1附近出现与LDHs层板上Al-O键相关的晶格振动吸收峰,表明Mg-Al LDHs层间结构较好。
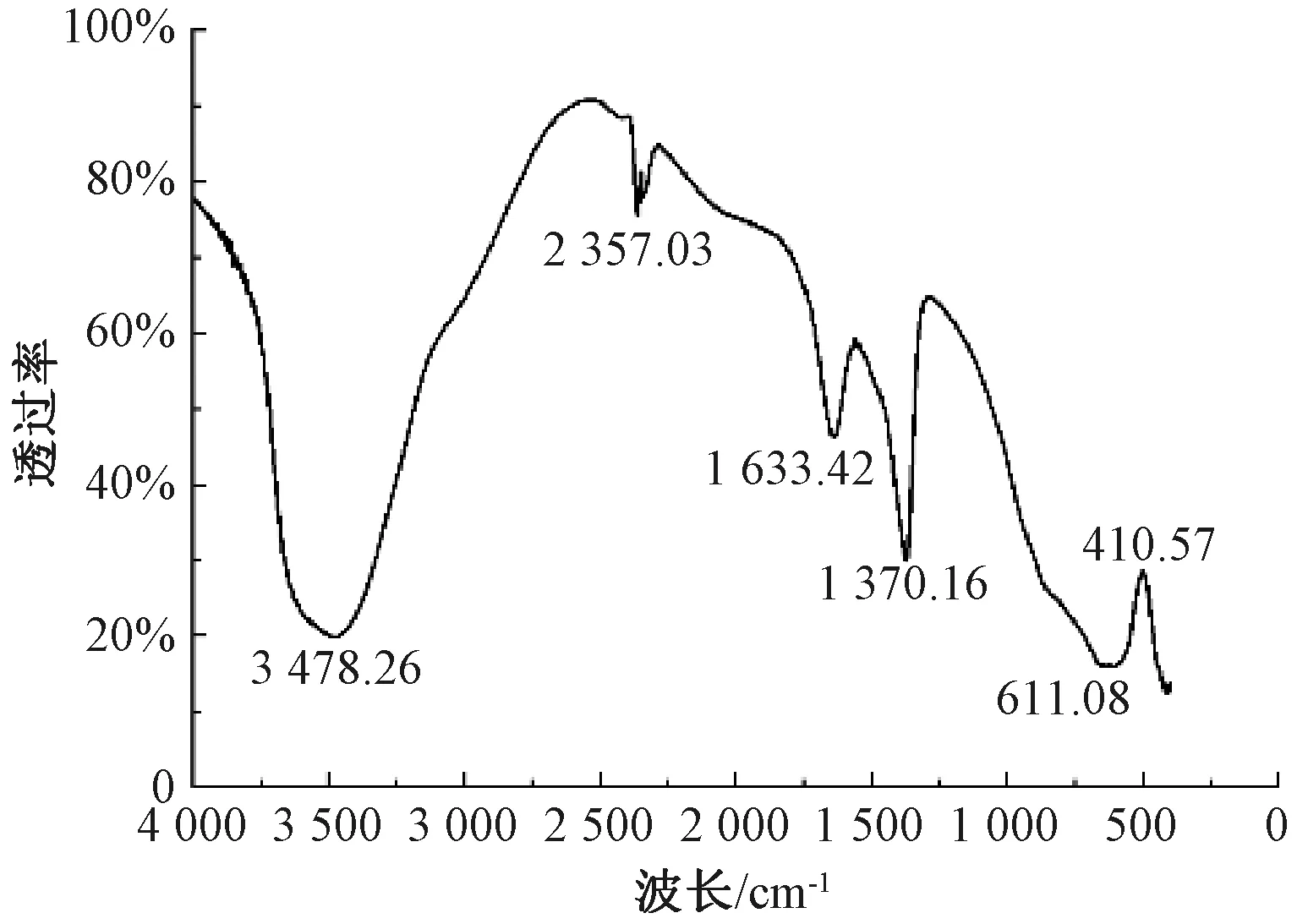
图3 Mg-Al LDHs的FTIR图Fig.3 FTIR Image of Mg-Al LDHs
2.2 Mg-Al LDHs对钒的吸附特性研究
2.2.1 等温吸附曲线
通过等温吸附试验,在相同平衡时间的条件下,测试Mg-Al LDHs对不同钒初始浓度的平衡吸附量,并选用Langmuir及Freundlich模型对数据进行拟合;通过吸附动力学试验,在相同钒初始浓度条件下,测试Mg-Al LDHs在不同平衡时间的平衡吸附量,采用两种经典的动力学模型(准一级动力学模型、准二级动力学模型)进行拟合分析,研究Mg-Al LDHs对钒的吸附特性。
Mg-Al LDHs对钒的吸附过程可用Langmuir及Freundlich模型进行拟合,表达式分别如式(2)及式(3)。
(2)
(3)
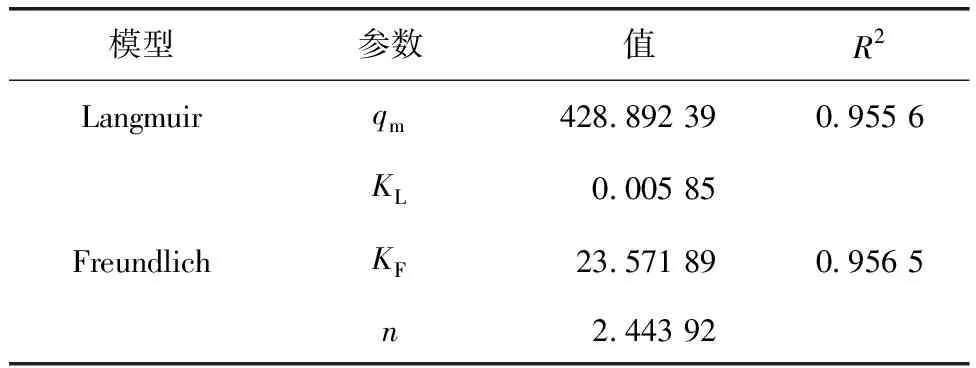
其中:qm——用Langmuir模型拟合出的最大吸附量,mg/g;
KL——Langmuir常数;
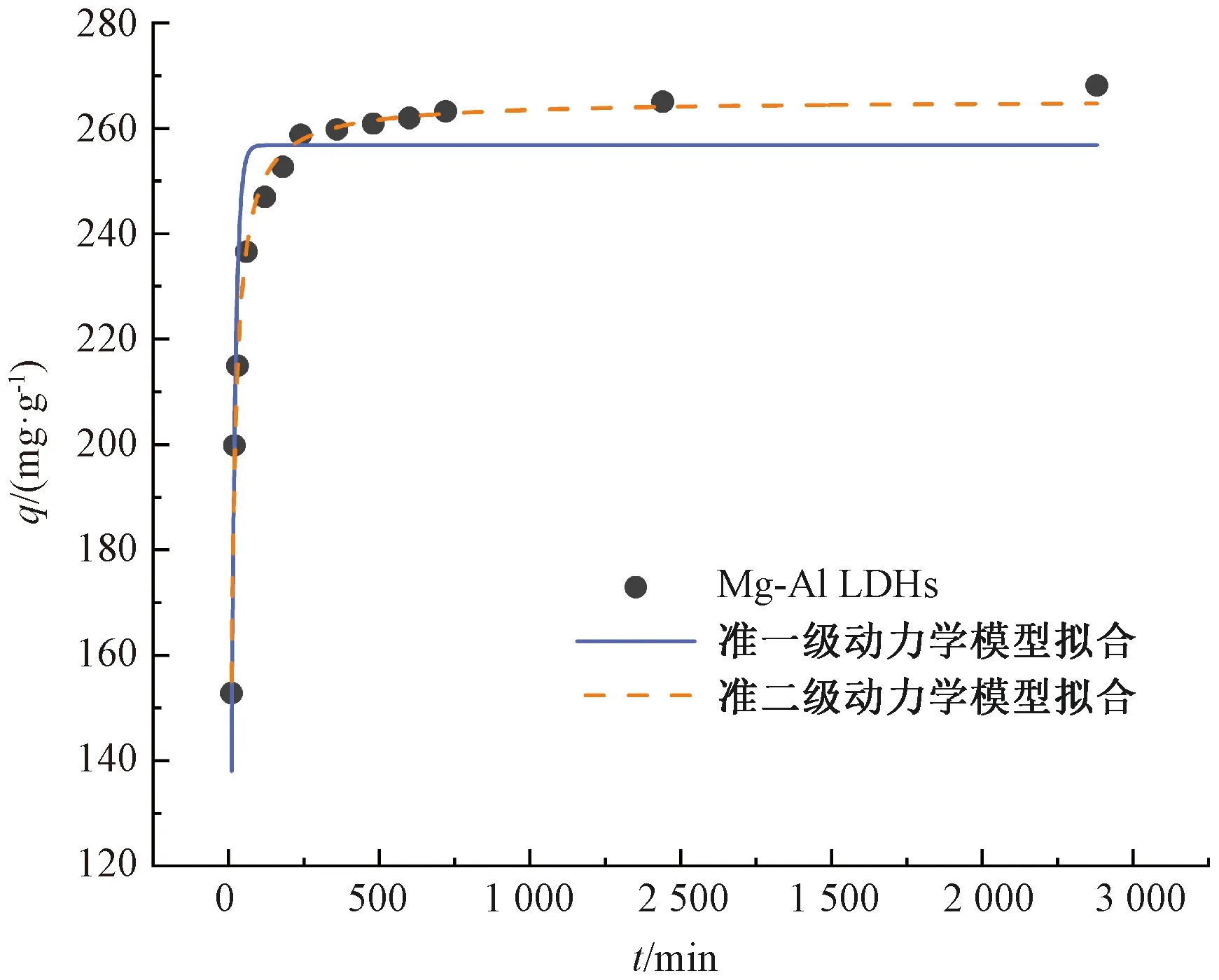
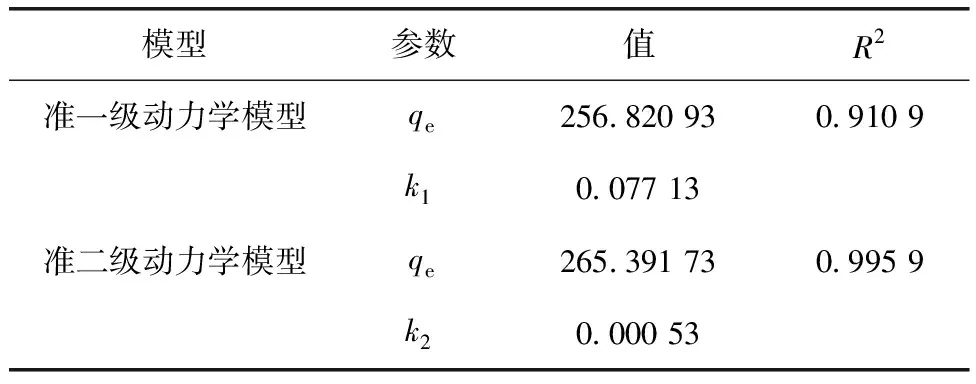
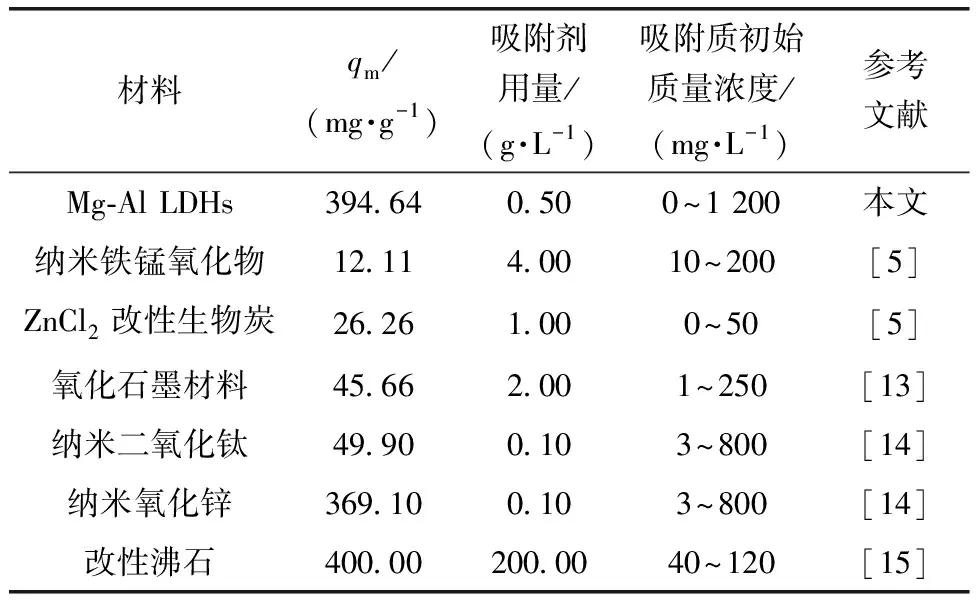
KF和n——Freundlich常数,通常认为1 拟合结果如图4所示。两种等温吸附模型拟合的相关参数如表1所示。 图4 Mg-Al LDHs对钒的等温吸附拟合Fig.4 Isothermal Adsorption Fitting of Mg-Al LDHs for Vanadium 表1 Langmuir和Freundlich模型参数Tab.1 Parameters of Langmuir and Freundlich Model 由图4可知,Mg-Al LDHs对钒的吸附符合Langmuir和Freundlich等温吸附模型。从表1得出,Freundlich吸附等温式描述Mg-Al LDHs吸附钒的过程所得出的相关系数略大于Langmuir吸附等温式,表明Freundlich模型拟合效果比Langmuir等温吸附模型好,说明Mg-Al LDHs对钒的吸附行为发生了非均质分布多吸附位点吸附。 2.2.2 吸附动力学模拟 本试验采用两种经典的动力学模型(准一级动力学模型和准二级动力学模型)对数据进行拟合分析。 准一级动力学模型表达如式(4),准二级动力学模型表达如式(5)。 q=qe[1-exp(-k1t)] (4) (5) 其中:q——时间为t时吸附剂对钒的吸附量,mg/g; k1——反应速率常数,h-1; k2——二级反应速率常数,g/(mg·min)。 拟合结果如图5所示,Mg-Al LDHs对溶液中钒吸附的两种动力学模型拟合的相关参数如表2所示。 图5 Mg-Al LDHs对钒的吸附动力学拟合Fig.5 Kinetic Fitting of Vanadium Adsorption on Mg-Al LDHs 由图5可知,随着时间的延长,Mg-Al LDHs对钒的吸附量不断增加,但吸附时间的增加使吸附速率有所减小。这是因为在吸附初始阶段,钒的浓度相对较大,Mg-Al LDHs表面活性位点和层间可交换阴离子充足,吸附速率较快。随着反应的进行,吸附位点的减少及离子交换能力减弱导致吸附速率降低,并且在360 min左右吸附达到平衡。根据表2,两种动力学模型的拟合相关系数均大于0.9,说明Mg-Al LDHs对钒的吸附符合两种动力学模型,但准二级动力学模型的拟合效果比准一级动力学模型更好,即Mg-Al LDHs对钒的吸附更符合准二级动力学模型。这说明吸附速率的控制步骤为化学反应过程,Mg-Al LDHs与钒的氢氧化物之间可能通过共用或者交换电子形成化学键,类似于Mg-Al LDHs吸附砷和锑的机制[9-10]。 表2 准一级动力学模型和准二级动力学模型参数Tab.2 Parameters of Quasi-First-Order Dynamic Model and Quasi-Second-Order Dynamic Model 2.2.3 Mg-Al LDHs吸附后红外光谱表征 图6 Mg-Al LDHs吸附不同浓度钒的红外光谱图Fig.6 Infrared Spectra of Mg-Al LDHs for Adsorbtion of Different Concentrations of Vanadium 从表3中可以看出,适宜条件下,Mg-Al LDHs、纳米氧化锌和改性沸石对钒的平衡吸附量远高于表中其他吸附剂,在一定程度上说明了该材料具有良好的吸附钒的性能。纳米氧化锌虽然吸附能力高,但团聚、溶解等环境行为使其具有不稳定性,会带来锌离子的二次污染,且纳米氧化锌已被证明具有细胞毒性,可经呼吸道进入生物体,不适合作为土壤修复材料[11]。在相同吸附剂用量条件下,Mg-Al LDHs比改性沸石吸附钒的效率更高,Mg-Al LDHs的制备成本低且不存在二次污染等问题[12]。因而综合比较,Mg-Al LDHs是目前对钒具有最高吸附效率的吸附剂,且绿色环保无二次污染,具有极高的应用价值。 表3 不同吸附剂对钒的吸附效果Tab.3 Adsorption Effect of Different Adsorbents on Vanadium (1) 通过XRD、SEM、FTIR这3种表征手段对Mg-Al LDHs进行表征分析,结果表明Mg-Al LDHs结构完整,结晶度较高,有良好的层状结构,符合典型的水滑石结构。 (2) Mg-Al LDHs对钒的等温吸附更加符合Freundlich等温吸附模型,说明Mg-Al LDHs对钒的吸附为非均质分布多吸附位点吸附,Mg-Al LDHs对钒的最大吸附量为394.64 mg/g。 (3) 准二级动力学模型能够更好地描述Mg-Al LDHs对钒的吸附行为,说明吸附的控制步骤为化学反应过程。 (4) 综合比较其他类型的吸附材料,Mg-Al LDHs对钒吸附效率较高,且绿色环保无二次污染,具有极高的应用价值和广泛的应用前景。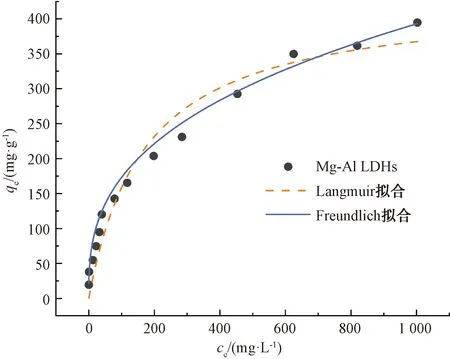
3 Mg-Al LDHs吸附性能对比
4 结论
