拟南芥AtGST8 的功能及其过表达植株对甲基紫精胁迫的响应
2023-05-14王玲娟鲁帅高聪韩缤莹赵成磊薛鹏辉曹云英
王玲娟,鲁帅,高聪,韩缤莹,赵成磊,薛鹏辉,曹云英
(南通大学 生命科学学院,江苏 南通 226019)
谷胱甘肽S-转移酶(glutathione transferase,GST)是一个蛋白质超家族,包含多个基因类型,它们具有还原型谷胱甘肽(reduced glutathione,GSH)的结合域和催化结构域,可催化GSH 与底物连接,形成水溶性产物,从而达到解毒的目的[1]。植物受到不良环境、病原微生物侵染、重金属毒害等非生物胁迫时,细胞器容易受损,体内的GST 会被诱导表达[2-4],从而保护植物免受或减轻伤害。植物在生长发育过程中受到不利条件时会引起氧化应激反应,从而破坏植物内的氧化还原平衡,导致活性氧(reactive oxygen species,ROS)的积累[5]。植物主要通过酶促和非酶促两大抗氧化系统及时清除ROS,调节氧化还原平衡,从而使植株免受伤害。谷胱甘肽和抗坏血酸(AsA)等低分子量化合物组成非酶促抗氧化系统,它们不仅可以直接与ROS 反应,还可以作为一些抗氧化保护酶的底物去除体内的ROS[6]。超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、抗坏血酸过氧化物酶(ascorbate peroxidase,APX)和GST 等多种保护酶组成酶促抗氧化系统[7-8]。此外,一些GST 具有GSH-Px 活性,能够将氢过氧化物转化为羟基醇类物质,防止组织中的氢过氧化物降解形成对植物细胞有毒害作用的产物——乙醛衍生物[9],从而抑制由氧化伤害引起的程序性细胞死亡[10]。
植物中GST 家族成员目前可分为10种,其中phi(GSTF)、tau(GSTU)和脱氢抗坏血酸还原酶等是植物所特有的[11]。tau 类在植物中成员最多[12]。拟南芥目前已经鉴定了48 个GSTs 基因[13-14],大多属于phi 和tau 类[15]。研究表明GST 基因在发育和胁迫响应中发挥重要的作用,据报道,过表达GST 能增加植物对低温、盐和除草剂的耐受性,转基因植物的生长也发生了变化[16-17]。GST8 已从干旱胁迫的拟南芥中分离出来,根据序列相似性推测其属于tau类,又称为GSTU19[18],但GST8 在拟南芥中的定位及组织中的表达情况目前尚不清楚。甲基紫精(methyl viologen,MV)又称百草枯二氯化物,是一种触杀性的除草剂[19]。有报道过表达GST8 可以提高拟南芥对盐和干旱等胁迫的耐性,但对MV 的响应及其机理仍不清晰。为此,本研究中首先构建了该基因的绿色荧光蛋白(green fluorescent protein,GFP)融合蛋白载体,确定其亚细胞定位;其次构建了带有该基因启动子的β-葡萄糖苷酸酶(beta glucuronidase,GUS)融合蛋白载体,运用GUS 染色和实时荧光定量PCR 技术,明确其在拟南芥组织中的表达;最后构建了过表达AtGST8 载体并获得了过表达AtGST8植株,然后通过生理测定、组织染色和基因表达分析,以明确该基因在拟南芥幼苗受到MV 处理后的作用,旨在为抗性材料的选育提供理论依据。
1 材料及方法
1.1 植物材料和生长条件
拟南芥种子先后经体积分数为75%的酒精和体积分数为20%的漂白剂消毒、无菌水洗涤,然后将其均匀铺在含有质量分数为1%的蔗糖和质量分数为0.7%的琼脂的1/2 MS 培养基上。在4 ℃冰箱中春化处理2 d 后移至光照培养箱(全友,南京)中生长,其中昼/夜光周期为14 h/10 h,温度为22 ℃/20 ℃,湿度恒定为80%±5%。
1.2 亚细胞定位
AtGST8全长编码序列(coding sequence,CDS)是从提取拟南芥植株中的总RNA(Total RNA Isolation System Kit,Promega)开始,再以逆转录的cDNA为模板,使用序列特异性引物(5'-CACCATGGCGA ACGAGGTGATTCTTCTT-3'和5'-TTACTCAGGT A CAAATTTCTTCCTGAGC-3')扩增而获得。采用Gateway法将其先通过BP 反应构建到入门载体pENTR/DTOPO(pENTRTMDirectional TOPOCloning Kits)中,再通过LR 反应(LR ClonaseTMⅡEnzyme Mix)将其构建到过表达载体pMDC43(12 460 bp)中,获得AtGST8基因的GFP 重组质粒(AtGST8-GFP)。将重组质粒导入根癌农杆菌GV3101中,再将菌液注射到烟草下表皮,黑暗下培养3 d,最后通过激光共聚焦显微镜(Leica TCS SP8)观察AtGST8在细胞中的定位情况。
1.3 组织表达分析
选择野生型拟南芥Col-0植株1 月龄的叶片提取总DNA(DNA quick Plant System,Tiangen),使用特异性引物(5'-CACCGCCACGTAATACAGTGCGTA GGGT-3'和5'-CTGGAGAAGCAAAGGACTCTTGTT CC-3')进行PCR 扩增带有AtGST8基因的启动序列的产物。通过Gateway 法构建AtGST8pro:GUS载体(方法同AtGST8-GFP),表达载体为pMDC163(12 833 bp)。将重组质粒通过浸花转化法获得转基因植株[20],潮霉素筛选获得带有GUS 报告基因的阳性植株。将不同生长阶段的阳性植株的各组织进行GUS 染色[21],所有染色均平行进行3 次。同时通过荧光定量技术分析了野生型各组织中AtGST8的表达水平[22]。
1.4 过表达植株的获得、鉴定及处理
以AtGST8cDNA 为模板,使用特异引物(序列同AtGST8-GFP),通过Gateway 法将AtGST8转到表达载体pMDC32(11 752 bp)中,获得带有AtGST8基因的阳性过表达植株,以T2 代苗进行鉴定并作MV处理,采用荧光定量PCR 技术进行鉴定。将野生型Col-0及过表达AtGST8株系OE-24和OE-443 周龄的幼苗用含20 μmol/L MV 的MS 营养液浇灌,生理指标和基因表达的分析采用处理3 d 后的幼苗来进行。
1.5 生理指标的测定
APX 酶液采用50 mmol/L、pH=7.0 的PBS 提取,酶活性测定参照文献[29]的方法。CAT 和过氧化物酶(peroxidase,POD)的酶液采用50 mmol/L、pH=7.8 的PBS 来提取,活性测定参照文献[24]的方法。采用WST 法测定SOD 活性,SOD 和GSH-Px 酶液的提取及测定参照试剂盒(建成,南京)来进行。GST酶活的测定参照文献[30]并作修改,采用pH=6.5的PBS 来提取酶液,反应体系包括0.1 mL 酶液、0.8 mL浓度为10 mmol/L 的1-氯-2,4-二硝基苯(CDNB)、2 mL PBS 及0.1 mL 浓度为10 mmol/L 的GSH。将每分钟每毫克蛋白质样品OD 减少或增加0.01 定义为CAT 或POD 的1 个活力单位(U);将每小时每克鲜重样品抑制NBT 光化还原50%所需的酶量定义为SOD 的1 个酶活单位(U)。
1.6 基因表达分析
AtGST8和保护酶系统相关基因的表达采用荧光定量技术来进行。样品经液氮研磨,用TRIZOL(Invitrogen)法提取总RNA,用第一链cDNA 合成试剂盒(Roche)获得cDNA。以ACT2(At3g18780)为内参基因,参照文献[22]的方法,通过荧光定量PCR 分析其基因表达水平,具体引物序列见表1。

表1 荧光定量表达分析用的引物序列Tab.1 Primer sequences for fluorescence quantitative expression analysis
1.7 统计分析
使用SPSS 软件版本20.0 进行数据分析,使用Duncan's 法进行差异显著性检验(P<0.05),使用OriginPro8 进行图表绘制。
2 结果与分析
2.1 AtGST8 基因的亚细胞定位
图1 为AtGST8基因的亚细胞定位,从中可以看出细胞膜中有明显的荧光信号,细胞核中也有少量信号,这表明AtGST8基因至少定位于细胞膜。

图1 AtGST8 基因的亚细胞定位Fig. 1 Subcellular location of AtGST8 gene
2.2 AtGST8 基因在组织中的表达
2.2.1 GUS 组织表达分析
选取AtGST8pro:GUS 的转基因植株T2 代进行GUS 染色,分析AtGST8在组织中的表达情况(图2)。从图中可见,在转AtGST8基因启动子区域的拟南芥的种皮和胚中均没有发现蓝色,表明该基因在上述两个部位均未表达(图2(a)和(b));在7 日龄的幼苗中可以看到叶片及心叶都被染成了蓝色,表明该基因在此部分表达较强(图2(c));根部的成熟区尤其根尖蓝色较深,表明该基因表达显著(图2(d)和(e))。另外,在土壤中生长35 d 的拟南芥莲座叶叶肉细胞(图2(f))、茎(图2(g))、柱头和花(图2(h))及果荚(图2(i))中均发现AtGST8表达,且在莲座叶中表达较弱,而在花和果荚中的表达与发育进程相关。在花中的表达随着开放程度增大而减弱,但是在果荚中,果荚越成熟,表达越明显(图2(h)和(i))。

图2 AtGST8pro:GUS 在转基因拟南芥中的表达Fig. 2 The expression patterns of the AtGST8pro:GUS in transgenic Arabidopsis
2.2.2 荧光定量分析AtGST8的表达
选取拟南芥野生型Col-0的叶、茎、花及果荚对不同器官中AtGST8基因进行荧光定量表达分析。从图3(a)中可以看出,AtGST8基因在果荚中表达量最高,叶片中最低。角果、花和茎的表达量分别比叶片增加了180%、100%和30%。同时,对获得的4个过表达株系T2 代AtGST8基因的表达进行了分析,各株系的表达量均显著高于野生型(图3(b))。

图3 茎、叶、花和荚中AtGST8 基因的表达及过表达AtGST8 株系的鉴定Fig. 3 Expression of AtGST8 gene in stems,leaves,flowers and pods and identification of over-expressed AtGST8 lines
2.3 MV 胁迫对过表达AtGST8 植株MDA、和伤害程度的影响

图4 MV 下拟南芥野生型和过表达AtGST8 植株中MDA 和产生速率的变化Fig. 4 Changes of MDA and production rate in wild-type and over-expressed AtGST8 plants of Arabidopsis under MV
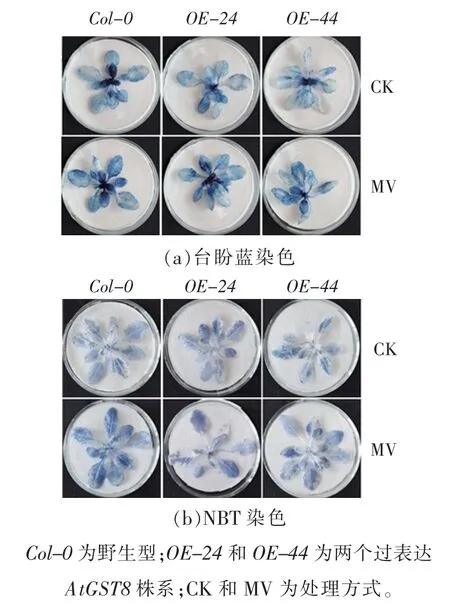
图5 MV 下拟南芥野生型和过表达AtGST8 植株幼苗组织的染色变化Fig. 5 Staining changes of wild-type and over-expressed AtGST8 plants in Arabidopsis seedlings under MV
2.4 MV 胁迫对过表达AtGST8 植株抗氧化物质含量的影响
正常生长条件下,野生型Col-0和过表达AtGST8植株中的AsA 含量无显著差异。但MV 处理显著增加了所有材料中的AsA 含量,且野生型Col-0增幅小于过表达AtGST8植株(图6(a))。与未处理相比,MV 处理后野生型Col-0的AsA 含量增加了34.3%,过表达AtGST8植株OE-24、OE-44则分别增加了42.3%和40.0%。与对照相比,MV 处理使野生型Col-0植株中GSH 含量显著下降(图6(b)),GSSG 含量则显著增加(图6(c)),GSH/GSSG 表现与GSH 一致(图6(d))。与对照相比,过表达At-GST8植株经MV 处理后的GSH、GSSG 及GSH/GSSG 差异均不显著(图6(b)—(d))。实验结果表明,MV 胁迫下过表达AtGST8植株中AsA 含量及GSH/GSSG 比较高,有利于体内活性氧的清除,从而保持较为正常的生理功能;而野生型Col-0植株中GSH/GSSG 比显著下降,因而受到伤害较大。
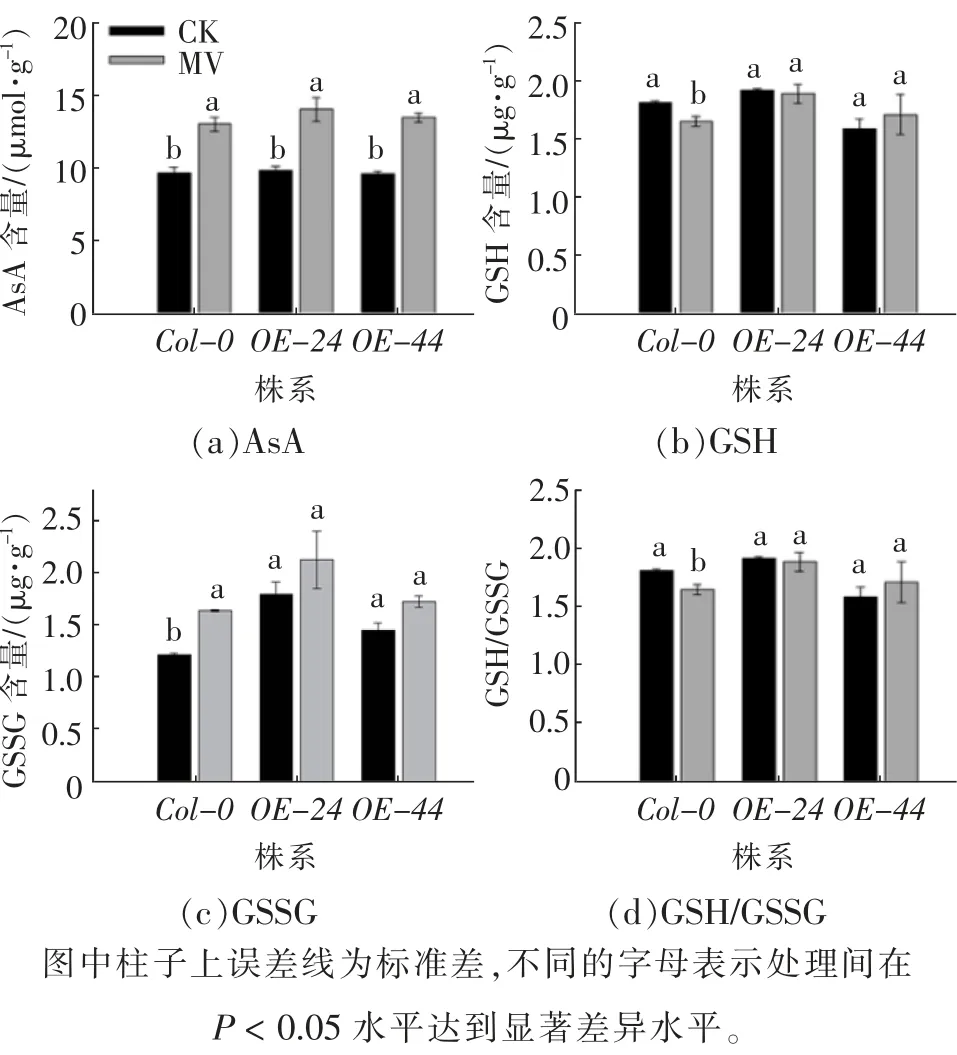
图6 MV 下拟南芥野生型和过表达AtGST8 植株中抗氧化物质含量的变化Fig. 6 Changes of antioxidant content in wild-type and over-expressed AtGST8 plants of Arabidopsis under MV
2.5 MV 胁迫对过表达AtGST8 植株抗氧化保护酶活性的影响
SOD、POD 和CAT 是一类氧化胁迫保护酶,能及时清除体内活性氧,从而保护植株免遭伤害。从图7(a)—(c)中可见,MV 处理后,野生型Col-0和过表达AtGST8植株中相应的POD、SOD 和CAT 活性均比对照显著增加,其中POD 活性在MV 处理后所有材料增幅范围为15.0%~22.3%,SOD 为14.4%~35.2%,CAT 为12.4%~21.4%。过表达AtGST8植株中,除POD 增幅稍低外,SOD 和CAT 活性增幅均高于野生型Col-0,这表明过表达AtGST8植株可能利用更多的SOD 将胁迫产生的活性氧转变成H2O2,再利用CAT 来清除H2O2,从而减轻植株氧化损伤。

图7 MV 下拟南芥野生型和过表达AtGST8植株中保护酶活性的变化Fig. 7 Changes of protective enzyme activity in wild-type and over-expressed AtGST8 plants of Arabidopsis under MV
APX 在抗坏血酸的转变中发挥重要的作用。从图7(d)中可看出,植株经MV 处理后,拟南芥野生型Col-0和过表达AtGST8植株OE-24、OE-44中的APX 活性均显著提高,增加幅度达46.3%~73.3%。GSH-Px 可以在H2O2的作用下将GSH 转变成GSSG,从而减少H2O2的毒害。从图7(e)可看出,正常生长条件和MV 胁迫下,过表达AtGST8植株中GSH-Px活性均稍高于野生型Col-0。MV 胁迫后,GSH-Px 活性野生型Col-0中增加了5%左右;过表达AtGST8植株OE-24、OE-44则分别增加了19.8%和16.6%,增幅明显高于野生型Col-0。表明过表达AtGST8 植株可以通过增加植物体内GSHPx 的活性,催化GSH 与H2O2作用,起到保护细胞膜结构和功能完整性的作用。
由图7(f)可以看出,正常生长条件和MV 胁迫下,过表达AtGST8植株中的GST 活性均高于野生型Col-0。经MV 处理后,与对照相比,过表达AtGST8植株OE-24、OE-44中GST 活性分别增加了16.2%和50.5%,处理前后GST 活性差异呈显著水平。而野生型Col-0中的GST 活性仅增加了4.5%,与对照相比差异不显著。
2.6 MV 胁迫对过表达AtGST8 植株活性氧保护酶相关基因表达的影响
对参与活性氧清除保护酶的相关基因表达进行了分析(图8)。与对照相比,MV 处理均使野生型Col-0中POD 基因PRX34、CAT 基因CAT1和APX基因SAPX表达明显上调,而GST8的表达量则无明显变化;过表达AtGST8植株OE-24和OE-44中的PRX34、CAT1、SAPX和GST8的表达量均上调,且达到显著水平。表明在MV 处理下,可导致PRX34、CAT1、SAPX和GST8的上调,进而促进了保护酶活性的增加。

图8 MV 下拟南芥野生型和过表达AtGST8 植株中保护酶相关基因表达的变化Fig. 8 Changes of protective enzyme relative gene in wild-type and over-expressed AtGST8 plants of Arabidopsis under MV
3 讨论
在植物中,多种胁迫可诱导GST 表达来减轻氧化损伤对植物的伤害,从而增强植物的抗性[31]。如高温、外源H2O2、HgCl2、水杨酸和百草枯条件下会使组织中GST上调表达[32],本研究中拟南芥野生型Col-0经MV 处理后GST表达没有显著变化,但过表达AtGST8植株却显著增加(图8(d)),推测其可能是造成过表达AtGST8植株受伤害较小、野生型Col-0伤害较大的主要原因(图4 和图5)。也有研究表明,外界条件造成GST 的变化可能与GSTs 的种类有关,如在大豆和玉米中观察到双氯胺和乙醇处理诱导tau 类GST 的表达量上调,但对phi 类GST 的影响却相反[13]。本研究中也发现MV 处理对AtGST8(GSTU19)表达量的影响与tau 类GST 一致(图8(d))。此外,使用物质的种类及浓度对GSTs表达的影响也有差异。与phi 的GSTF7和GSTF8相比,在水杨酸处理下,拟南芥中tau 类GSTU19和GSTU7更容易被诱导表达,且在低浓度(0.1 mmol/L)下效应更显著,而phi 类GSTF在高浓度(1 mmol/L)下表达量会高些[7]。在MV 处理下,低浓度(0.01~0.03 mmol/L)下过表达棉花GST的转基因烟草中其表达量增加,但在高浓度0.05 mmol/L 时增加更明显[33]。本研究中采用20 μmol/L 的MV 处理则是显著增加了AtGST8的表达(图8(d))。表明处理物质的种类及浓度也是影响植物中GST 的重要原因。
有多个研究结果表明,过表达GST基因能够提高植物的抗逆性,如柽柳中过表达基因GSTZ1可明显提高转基因拟南芥对盐和干旱的耐受性[34]。与生长素结合蛋白基因Atpm24编码序列相同的GST基因过表达明显增强拟南芥对紫外辐射损伤作用的耐性[35]。水稻基因OsGSTl2转入到拟南芥后,植株能表现对重金属的高耐受性[3]。转基因石竹过表达GST后通过合成螯合素,可将多余的重金属铜离子隔离和解毒,从而提高对铜离子的耐性[36]。也有研究发现,GSTU19过表达通过增加幼苗的存活率、叶片的保水率从而提高拟南芥对盐、干旱胁迫的耐受性,加速了种子萌发过程中子叶的生长,提高了拟南芥对低浓度MV(小于3 μmol/L)胁迫的耐性[11]。AtGSTF8和AtGSTU19突变体在盐胁迫下和H2O2含量增加而提升了其对盐的敏感性[37]。本研究中也构建了过表达载体,发现过表达AtGST8可以减少膜脂过氧化产物MDA 的积累和超氧阴离子的产生(图4 和图5),提高了拟南芥幼苗对高浓度MV(20 μmol/L)的耐性。
GST含量增加能帮助植物维持体内氧化还原的稳态,从而保护植株免受氧化损伤[31]。植物体内之所以能够维持氧化还原稳态,其重要原因是体内活性氧产生与清除保持平衡。AsA 和GSH 作为重要组成部分,在非酶促系统中参与活性氧清除,有研究发现,野生型幼苗可能主要通过AsA 依赖的途径来完成[38],另一方面,谷胱甘肽依赖途径导致GSSG积累的增加,可能又会降低AsA 的利用率。还有研究发现,GSH/GSSG 的比值对植物逆境响应有重要影响[39]。本研究中发现所有供试材料经MV 处理后AsA 含量均显著增加,但过表达AtGST8植株增加更显著。MV 处理使野生型GSH 明显下降、GSSG明显上升,导致GSH/GSSG 明显下降,但过表达At-GST8植株则变化不明显(图6),表明较低的GSH/GSSG 及AsA 的增加较少是造成拟南芥野生型Col-0活性氧增加的重要原因。此外,植物在遭到逆境时,可通过抗氧化酶来调节活性氧水平[40]。在本研究中,MV 处理增加了所有植株中的SOD、POD、CAT、APX活性,但过表达AtGST8植株增幅大于野生型Col-0;显著增加了过表达AtGST8植株中GSH-Px 和GST 活性,而野生型Col-0变化不明显(图7)。同时也对保护酶中相关基因的表达水平进行了分析(图8),其变化趋势与保护酶活性一致。表明过表达AtGST8植株SOD 活性较高,能够将MV 胁迫产生的过多活性氧自由基转变成H2O2,利用CAT 进一步清除H2O2,或利用更多的GSH-Px 及GST 催化GSH 与H2O2反应,从而达到降低植株的氧化损伤的目的。
4 结论
利用转基因植株及GUS 染色发现该基因在幼苗、根、花中表达较强,茎和莲座叶中较弱,花和果荚中的表达随着发育进程而变化,花中随着花期进程而下降,果荚中却随着生育进程而不断上升。拟南芥AtGST8至少定位于细胞膜上。荧光定量分析该基因在野生型拟南芥不同器官中表达量,发现果荚中最高,叶片中最低。过表达AtGST8植株下维持较低的MDA 和O2·-与较高的AsA 含量及GSH/GSSG 比、抗氧化保护酶活性(SOD、POD、CAT、APX、GSH-Px 和GST)及转录水平,是植株在MV 胁迫下伤害较轻的重要原因,表明拟南芥过表达AtGST8通过提高活性氧的清除能力从而减轻了MV 胁迫对植株的损伤。
