常见酸碱的性质和用途
2023-05-13申艳秋

名师简介:申艳秋,辽宁省骨干教师,就职于辽宁省实验学校,从事化学教学工作30年,辽宁省初中化学名师工作室主持人,沈阳师范大学硕士研究生导师,2008、2012和2014年中考命题组成员。
常见酸碱的性质及用途、中和反应及其应用、常见酸碱指示剂与pH是中考化学试题的必考内容。命题时常会与实验探究活动、社会生活、生产实际密切联系,题干信息多样,情景模拟性强、知识的综合性强。题型多以选择题、简答题、实验探究题为主。
一、构建酸碱化学性质网络
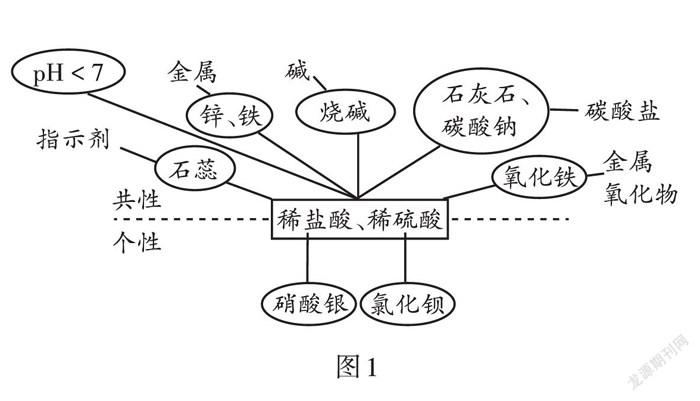
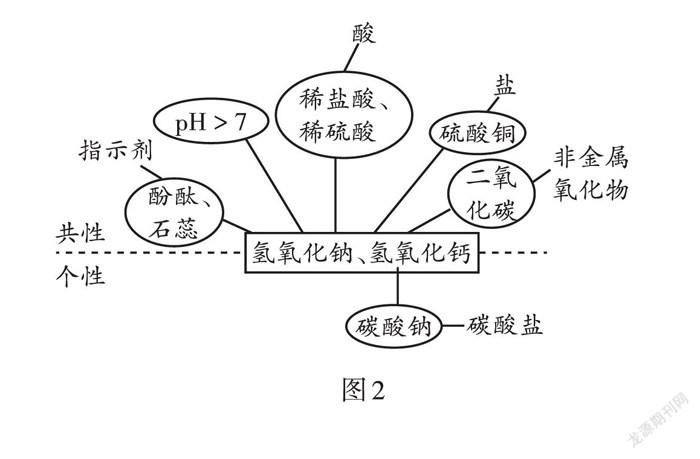
酸和碱的化学性质可用图1、图2表示,也可以利用下面的口诀记忆:酸碱学习并不难,记住通性是关键;酸碱见面必中和,生成盐水并放热;盐碱反应要双溶,不溶物质会生成。
二、总结归纳重点知识
1.溶液的酸碱性可用酸碱指示剂检验,溶液的酸碱度可用pH试纸测定。酸性溶液的pH越小,酸性越强;碱性溶液的pH越大,碱性越强。若用普通pH试纸测定,读数只取整数,若要精确测定溶液的pH可用pH计。
2.酸碱指示剂变色是发生了化学变化,生成了有颜色的物质。
3.使用pH试纸不可接触容器口,不可直接伸入待测液中。
4.酸碱度的应用:(1)控制化工生产中反应的酸碱度;(2)调节土壤酸碱度,适应农作物生长;(3)测定人体内某些物质或排出物的pH,了解健康状况,指导治疗;(4)检测分析环境污染,指导环保。
5.浓硫酸和浓盐酸在空气中敞口放置,溶质的质量分数都会变小,但原因不一样。浓硫酸变稀是因为吸水性,浓盐酸变稀是因为挥发性。因此,浓盐酸和浓硫酸都要密封保存。
6.稀释浓硫酸的操作可概括为:沿杯壁,缓慢倒,酸入水,不断搅。
7.酸溶液中因为为都含有氢离子,化学性质相似;酸根离子不同,又具有差异性。
碱溶液中因为都含有氢氧根离子,化学性质相似;阳离子不同,又具有差异性。
8.铁跟稀盐酸或稀硫酸发生置换反应时,其化合价由0 → +2。
9.浓硫酸不能干燥NH3,氢氧化钠固体不能干燥CO2、SO2、HCl等气体。氢氧化钠溶液不能作气体干燥剂。
10.澄清石灰水变浑浊的可能原因:加热饱和澄清石灰水,由于氢氧化钙的溶解度减小,有白色固体析出,是物理变化;向澄清石灰水中通入二氧化碳气体,由于生成碳酸钙白色沉淀,是化学变化。
11.中和反应的应用:(1)改良酸性土壤;(2)废水处理;(3)洗发、护发;(4)治疗胃酸过多;(5)缓解蚊虫叮咬后痛痒的症状。
三、走出酸碱学习误区
1.误以为酸碱一定能使指示剂变色,其实难溶性的酸或碱不能使指示剂变色;误认为使指示剂变色的溶液,一定是酸或碱,其实某些盐溶液(如碳酸钠溶液、硫酸铵溶液)也会使指示剂变色。
2.误认为浓盐酸瓶口冒出的白雾是氯化氢气体,其实氯化氢气体是看不见的,白雾是盐酸的小液滴,同时也反映出氯化氢极易溶于水的性质。
3.氢氧化钠固体密封保存的原因只答防止其与空气中二氧化碳反应而变质,漏答防止氢氧化钠固体潮解。
4.误认为碱溶液与非金属氧化物的反应是复分解反应。
5.误认为正常雨水的pH = 7,忽略二氧化碳溶于水,生成碳酸;誤认为酸中加水,溶液的pH最终会大于7。
6.误认为中和反应属于基本反应类型;误认为生成盐和水的反应一定是中和反应。
四、重视探究、突破难点
考查酸碱的性质时一般都是利用氢氧化钠溶液与二氧化碳、稀盐酸的反应,要求我们设计方案来判断反应是否发生、反应进行的程度以及探究反应后溶液中溶质的成分。例题请扫右侧二维码。
(作者单位:辽宁省实验学校)
