基于MRI T1增强影像的影像组学模型预测较低级别胶质瘤IDH基因型的价值
2023-05-12赵志勇曹云太张国晋孙建清李昇霖周俊林
赵志勇 张 婧 曹云太 张国晋 孙建清 李昇霖 周俊林
WHO 分级Ⅱ级弥漫性胶质瘤和间变型胶质瘤具有高度可变的临床表现,很难根据组织学分类进行很好地预测其预后,有文献将其合称为较低级别胶质瘤(lower grade glioma,LerGG)[1,2]。随着胶质瘤异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)基因分子的发现[3],研究显示LerGG中IDH基因型比传统组织病理学分级包含更多的预后信息,能更客观地预测病人的预后[4~6]。因此,术前确定IDH 基因型有助于LerGG 病人个体化诊疗方案的制定及预后评估。目前,术后组织病理检测仍然是诊断LerGG 的IDH 基因状态的金标准,但这一方法受限于组织标本的肿瘤含量,同时具有滞后性及有创性等不足。有研究报道基于MRI多模态的影像组学方法可以预测胶质瘤IDH基因状态[7],但这些研究所需的MRI序列较多;同时,这些研究大多关注胶质母细胞瘤。本文探讨基于MRI T1增强影像的影像组学预测LerGG胶质瘤IDH基因型的价值。
1 资料与方法
1.1 病例选择标准纳入标准:新确诊、未经治疗的LerGG;具有IDH 基因检测结果。排除标准:复发性LerGG;术前应用激素或替莫唑胺治疗;有颅内手术史;合并有其它颅内肿瘤;年龄<18 周岁;其它WHO分级Ⅱ~Ⅲ级胶质瘤,如多形性黄色星形细胞瘤、室管膜瘤或间变性室管膜瘤。
1.2 研究对象回顾性收集2017 年1 月至2020 年6月经手术病理证实为LerGG共170例,其中IDH野生型(IDH-wt)70例,IDH突变型(IDH-mut)100例。按2:1 的比例分为训练集(n=113,IDH-mut=69,IDHwt=44)和验证集(n=57,IDH-mut=31,IDH-wt=26),前者用来训练预测模型,后者用来验证预测模型。训练集男71例,女42例;平均年龄(43.32±11.94)岁;KPS 评分60 分3 例,70 分43 例,80 分45 例,90 分22例;WHO 分级Ⅱ级37 例、Ⅲ级76 例;癫痫72 例。验证集男27 例,女30 例;平均年龄(45.00±11.55)岁;KPS 评分60 分6 例,70 分16 例,80 分20 例,90 分15例;WHO 分级Ⅱ级23 例、Ⅲ级34 例;癫痫34 例。本研究通过兰州大学第二医院伦理委员会审核(伦理编号:2020A-70)。
1.3 IDH的检测 利用单克隆抗体H09(德国Dianova公司)对胶质瘤样本进行免疫组织化学分析,检测IDH1-R132H突变状态,如果有肿瘤细胞染色,则确定为IDH1-R132H免疫染色阳性。染色阴性病例通过焦磷酸测序法进一步验证IDH1/2的突变状态,并使用ABI3500Dx 试剂盒5.4Kit(美国Applied Biosys⁃tems公司)进行序列数据分析。
1.4 MRI检测 使用西门子3.0T 和Philips 1.5T 扫描仪获得MRI T1增强图像。静脉注射Gd-DTPA 进行增强扫描,速度为3.0 ml/s。西门子3.0 T 的扫描参数:TR=1 900ms,TE=2.9 ms,矩阵286×256,视野230×230,层厚5.5 mm,层间距1.65 mm,层数20,翻转角150,采集时间1min8sec。Philips 1.5T 扫描参数:TR=450 ms,TE=15 ms,矩阵256×256,视野230×230,层厚6.0 mm,层间距1.17 mm,层数18,翻转角69,采集时间1min2sec。
1.5 构建影像组学模型
1.5.1图像处理及病灶分割 从PACS 系统中获取轴位MRI T1序列增强图像,以DICOM 格式导入ITKSNAP 软件(www.itksnap.org;Version 3.6.0)进行病灶分割。由两名放射科医生A 和B(分别具有6 年和8年MRI 神经系统肿瘤诊断经验)在不知分子分型和病理结果的情况下采取独立、盲法对图像上的肿瘤区域进行逐层手动分割,勾画包括肿瘤实体感兴趣区域(regions of interest,ROI)。通过融合每层图像的分割区域生成病灶感兴趣区体积(volume of interest,VOI)。随后医生C(具有15 年丰富诊断经验的放射科医生)对这种分割进行验证。A 医生分割所有训练集病例,B医生分割所有验证集病例;两位医生不确定时,由医生C 确定分割图像。为了评估所提取的影像组学特征的可重复性和一致性,两个月后,随机选择训练集30 例病人,通过医生A 和医生B 再次进行勾画,采用组内及组间相关系数(intra-/interclass correlation coefficients,ICCs)对测量者之间及不同扫描仪之间进行一致性评价。
1.5.2 影像组学特征的筛选、影像组学模型的构建及验证 根据图像生物标志物标准化倡议指南,使用pyradiomic 包从医学影像数据中提取标准化的影像组学特征。从每例病人的T1增强图像的ROI中提取1 595 个组学特征,其中包括14 个形状特征,306 个一阶特征(又称为直方图特征)以及1 275 个纹理特征。所有特征均使用最小-最大缩放算法进行归一化处理。利用Spearman 相关性分析和LASSO 分析对特征进行筛选和降维分析,排除相关系数小于0.3或P>0.05的影像组学特征。利用5折交叉验证法选择准确度最佳的分类器,并将LASSO 筛选出的与IDH基因型相关性最高的影像组学特征与筛选出的分类器相结合构建基于影像组学特征的预测模型。再利用ROC曲线分析模型的诊断效能。
1.6 统计学方法使用Python 3.7.1(https://www.py⁃thon.org)软件、R 软件(http://www.Rproject.org; Ver⁃sion 3.4.1)和SPSS 22.0 软件进行分析;正态分布计量变量采用±s描述,采用t检验;计数资料采用χ2检验;P<0.05为差异有统计学意义。
2 结果
2.1 一致性分析两个放射科医生和不同扫描仪所提取的影像学特征的一致性良好,ICCs值>0.75。
2.2 胶质瘤IDH 基因型与病人临床特征的关系在训练和验证集中,IDH基因型与性别和KPS评分、病理分级以及癫痫发作无明显关系(P>0.05),但IDHwt组年龄较IDH-mut组明显增大(P<0.05)。见表1。
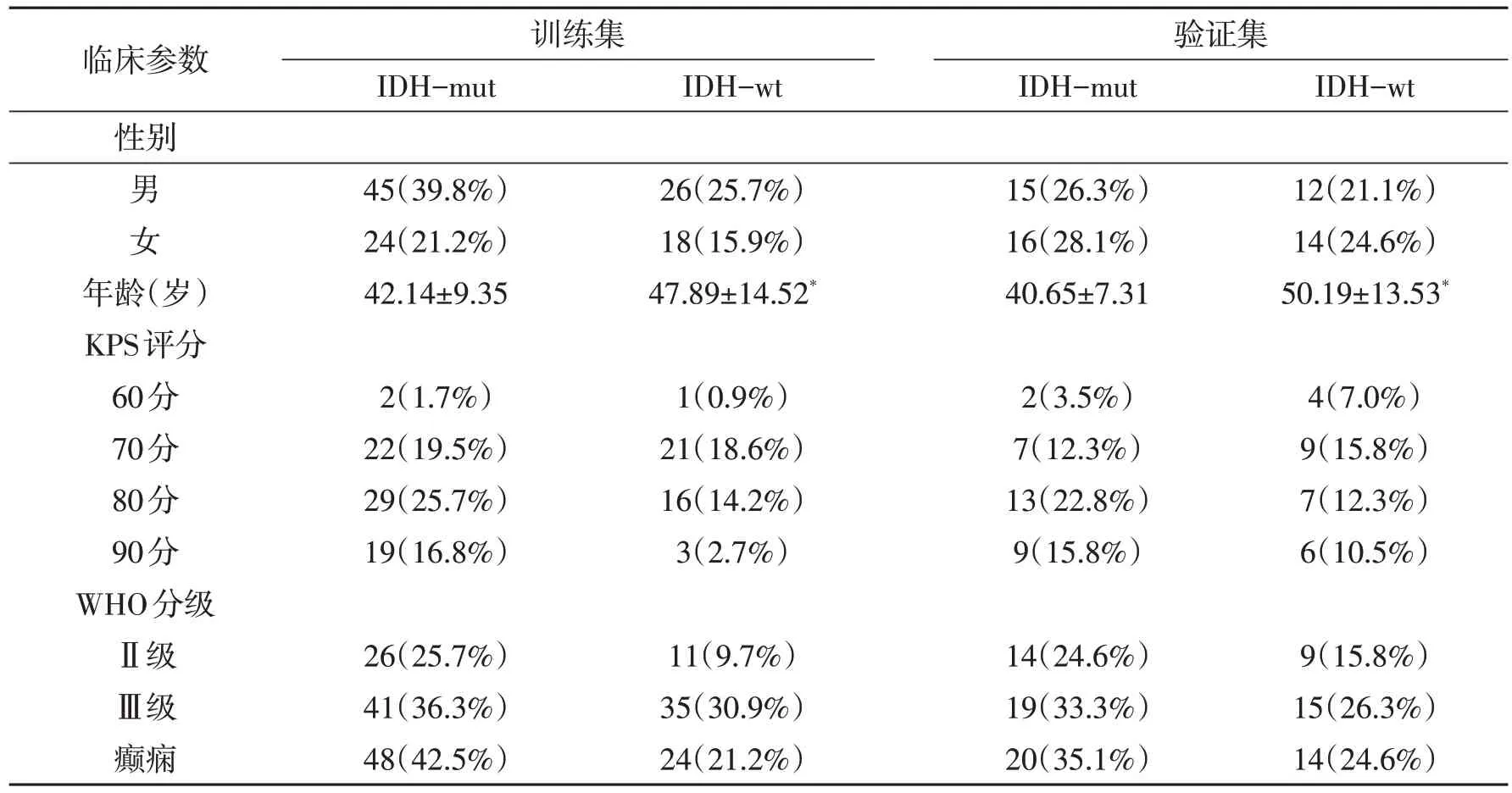
表1 训练集和验证集IDH-mut和IDH-wt组临床特征比较
2.3 影像组学特征处理与分析经Spearman 相关性分析、LASSO对特征进行降维筛选后,得到5个影像组学特征及其系数,分别为GLCM.sqrt.InverseVari⁃ance(1.723)、HLL.Kurtosis(0.872)、GLCM.HLL.Idn(1.060)、LHL.Median(-1.480)、SurfaceVolumeRatio(-1.166);其中前三个影像组学特征在IDH-mut 组中显著高于IDH-wt 组(P<0.05;图1),而后两个在IDH-mut组中显著低于IDH-wt组(P<0.05;图1)。
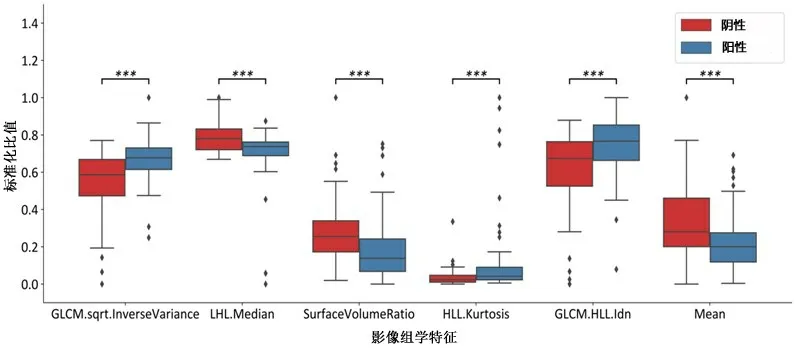
图1 利用LASSO降维后筛选出与较低级别胶质瘤IDH突变状态高度相关的、并用来构建预测模型的影像组学特征
在训练集和验证集中,根据影像组学构建的IDH-mut 预测模型具有较好的诊断性能(图2)。通过5-折交叉验证选出的准确度最高的最佳分类器,利用logistic回归模型分析构建基的影像组学模型预测IDH突变状态。ROC曲线分析显示预测模型在验证集和训练集的曲线下面积分别为0.84、0.82,准确度分别为79%、80%,敏感度分别为81%、88%,特异度分别为75%、66%(图3)。

图2 影像组学预测模型在训练集(A)和验证集中(B)影像组学评分分布图

图3 预测模型在训练集和验证集中评估性能
3 讨论
随着人工智能的兴起和胶质瘤基因分型的深入研究,越来越多的学者试图应用机器学习的方法对脑胶质瘤进行分级、分型以及鉴别诊断[8~11]。应用高级数学模型算法识别人类肉眼无法识别的医学影像征象,高通量提取肿瘤内部ROI 的影像数据并将其转化为具有高分辨率的、可发掘的、定量的特征空间数据(即影像组学特征),进一步分析这些特征与肿瘤异质性之间关联度,应用机器学习算法构建分类模型,从而实现对胶质瘤基因分型的精准评估。
IDH突变对胶质瘤病人的预后和疗效具有很强的预测价值。目前,应用肉眼可见的影像学特征非侵入性地对IDH突变进行评估被广泛研究了多年[12~14],但这些影像特征的描述是基于临床医师的一种定性和半定量的评估,研究结果的可重复性较低,不利于类似研究间的对比交流。基于多模态MRI影像组学方法预测胶质瘤IDH的突变对检查设备的要求较高、费时耗力且花费较高。如果能以较低成本、快速精准地根据术前影像预测IDH状态则对胶质瘤的诊断、手术计划和靶向治疗具有重要意义。Yu 等[15]基于MRI T2-FLAIR的影像组学特征构建WHO分级Ⅱ级胶质瘤IDH1突变状态的预测模型,结果显示预测模型的准确度、敏感度、特异度以及曲线下面积分别为80%、83%、74%及0.86。Liu 等[16]基于MRI T2影像组学特征构建低级别胶质瘤IDH的突变状态的预测模型,结果显示,模型预测IDH突变状态的曲线下面积为0.86,随着影像特征的增加,模型预测IDH突变状态的曲线下面积可达1.00。Kim 等[17]利用MRI 灌注像影像组学成功预测低级别胶质瘤IDH 突变状态,曲线下面积为0.729。
我们根据MRI T1增强影像提取影像组学特征,构建LerGG 中IDH 突变状态的预测模型,其性能在验证集中准确度、敏感度、特异度及曲线下面积分别为79%,81%,75%和0.84。这提示该模型能够区分IDH 在LerGG 中表达差异,对其突变状态具有较好的预测性能。其优点:①根据肿瘤的强化边界分割肿瘤能更精确地提取肿瘤内部的全部信息,减少水肿区域对特征的干扰[18],有利于提取到肿瘤内部更特异性的基因信息;②根据增强影像提取的肿瘤特征包含了肿瘤更多异质性信息,为胶质瘤基因分型的预测提供了更多的、有价值的参考,提高了模型的鉴别能力[19];③MRI 有无强化是鉴别大部分WHO 分级Ⅱ、Ⅲ级胶质瘤的重要依据[20],这也是影像组学反应特征差异的一个原因;④胶质瘤IDH 基因突变可以激活缺氧诱导因子,促进肿瘤新生血管生成,而肿瘤血管可经影像强化程度表征。
总之,基于MRI T1增强影像的影像组学模型对LerGG 中IDH 基因状态具有较好的预测能力,具有经济实用、便捷迅速实施的特点。
